形近义异,似是而非
——物质结构知识中一些易混概念的辨析及教学对策
2019-12-27
(上饶师范学院 化学与环境科学学院,江西 上饶 334001)
在高中化学物质结构知识的教学及化学奥赛的辅导中,经常会有学生问及诸如“判断和说明碱金属元素金属性及其单质晶体金属键的变化规律,碱土金属的氧化物离子性和离子键的变化规律,卤化氢分子共价性和共价键的变化规律”等类似的问题。实际上,这些问题都属于较高层次的化学概念的辨析题,目的是要考察学生对一些容易混淆的化学概念的精确理解和规律感悟,考生只有深刻掌握这些概念的本质和内涵,才能对问题作出正确的解答。
化学概念是对化学现象、化学事实通过分析、比较后而抽象、概括出来的理性知识,它已经脱离了现象或事实的表象而成为了一种更高级的思维形态,反映着化学现象和化学事实的本质,是化学学科知识体系的基础。化学概念中存在着很多“形近义异、似是而非”的现象,例如:质子数与质量数、原子量与原子质量、氧化物与含氧化物、同分异构体与同素异形体等等。在物质结构和性质的知识体系中,就有上述的“金属性与金属键”“离子性与离子键”“共价性与共价键”等极易混淆的概念。本文以此为重点,讨论和辨析化学概念中这些“形近义异、似是而非”的现象。
1 金属性与金属键
1.1 概念的含义
元素的金属性(metallic character)是指元素的原子失去电子而变成阳离子的倾向,它是各种元素的原子所表现出来的性质。原子越易失去电子,元素的金属性越强。元素失电子的倾向可用电离能(ionization energy,I)的相对大小来衡量,因此元素的金属性也常用元素的电离能(通常是第一电离能I1)的相对大小来比较:电离能(I1)越小,金属性越强。
在金属晶体中,金属原子的价电子脱落下来成为自由流动的电子,金属原子则变成了阳离子。带负电荷的自由电子就像“胶合剂”一样把千千万万个金属阳离子“胶合”在一起,这种“胶合”作用力就是金属键(metallic bond)。熔化金属晶体,或原子化金属晶体(相当于固态金属的气态升华),所需破坏的化学键作用力就是金属键,所以我们可以分别用熔点(melting point,m.p),或升华热(the heat of sublimation,S;也叫原子化焓,the heat of atomization,aH)的相对高低来比较金属键的相对强弱:熔点越高,金属键越强;升华热(原子化焓)越大,金属键也越强。当然,金属的沸点或硬度也是金属内部质点间作用力即金属键强弱的反映,一般而言,金属键越强,沸点越高,硬度越大。
1.2 宏观能量和理化性质方面的数据比较
碱金属、碱土金属元素的原子和单质晶体的一些性质见表1[1-4]。从表1中的数据可以看出,碱金属元素Li、Na、K、Rb、Cs的第一电离能I1的变化情况是520→496→419→403→376 kJ/mol,I1值逐渐减小,说明碱金属元素的金属性同族从上到下逐渐增强。数据还表明,碱金属晶体Li、Na、K、Rb、Cs的熔点和升华热都是分别逐渐减小的,说明碱金属单质中的金属键同族从上到下逐渐减弱。
碱土金属中的Be、Mg、Ca、Sr、Ba也有类似的情况。从表1可知,它们的I1值变化情况是900→738→590→550→503 kJ/mol。第一电离能逐渐减小,说明碱土金属元素的金属性同族从上到下也是逐渐增强。从表1中还可以看出,碱土金属晶体Be、Mg、Ca、Sr、Ba的熔点和升华热在总的趋势上都是分别减小的,说明碱土金属单质中的金属键同族从上到下在总的趋势上是减弱的。其中的Mg与Ca比较,熔点显得比较特别;Ba与Sr比较,升华热也显得比较特别,这可能是由于它们的密堆积方式即晶格类型不同所引起的,更为根本的原因还有待于进一步探讨。
从表1中元素的电离能、单质固体的熔点和升华热数据还可以看出,同周期从左到右,即同周期从碱金属到碱土金属,元素的金属性减弱,单质固体中的金属键增强,而且这种同周期横向比较中的减弱或增强幅度,远大于同族纵向比较中的变化幅度。例如,核电荷相近的同周期相邻元素3Li/4Be(左下标表示元素的核电荷数或原子序数)比较,电离能、熔点、升华热分别为520/900 kJ/mol、454/1551 K、161/326 kJ/mol,宏观数据相差很大;而核电荷相差较大的同族相邻元素3Li/11Na比较,电离能、熔点、升华热分别为520/496 kJ/mol、454/371 K、161/108 kJ/mol,宏观数据相差不大,这又是由其特殊的微观结构所决定的。
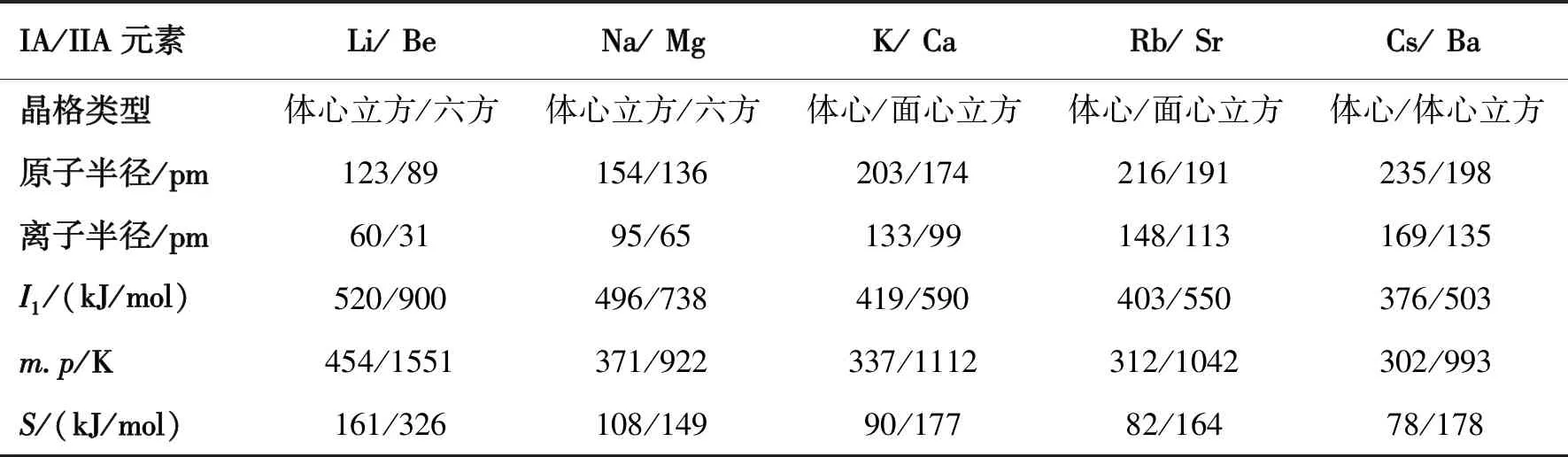
表1 IA和IIA金属元素的一些基本性质
1.3 微观结构方面的洞察分析
物质的结构决定着物质的性质,物质的性质反映着物质的结构。从微观结构方面洞察,元素电离能的大小,主要取决于元素的有效核电荷、原子半径,以及原子的电子层结构。同一主族元素,如碱金属或碱土金属,可认为其有效核电荷相差不大,但从上到下原子的电子层数增大,原子半径增大,原子核对外层电子的吸引力减小,所以元素的电离能减小,金属性增强;同一周期的主族元素,从左到右,有效核电荷增大,原子半径减小,原子核对外层电子的吸引力增大,所以元素的电离能增大,金属性减弱;电子层结构对电离能也有较大的影响,同周期碱土金属元素比相邻的碱金属元素电离能大很多,部分原因就在于碱土金属原子具有全充满的、比较稳定的ns2亚层价电子结构。
在金属晶体中,带负电的自由流动的电子像“胶合剂”一样把无数个带正电的金属阳离子“胶合”在一起。显然,这种“胶合力”即金属键的强度与金属原子脱落下来的价电子数(自由电子数)有关,也与金属阳离子的电荷和半径有关。同一主族元素的金属晶体,如碱金属或碱土金属晶体,原子脱落下来的自由电子数相同,原子脱落价电子后所形成的阳离子电荷也相同,但从上到下离子的半径增大,所以自由电子对阳离子的“胶合力”即金属键减弱;同一周期的金属元素,从左到右,如从碱金属到碱土金属,由于原子脱落下来的自由电子数增多,所形成的阳离子电荷增大、半径减小,三个因素同时作用的结果,导致自由电子对阳离子的“胶合力”即金属键显著增强。
2 离子性与离子键
2.1 概念的含义
原子相互结合成分子时,分子内原子间的结合力即化学键主要有两种基本类型:共价键和离子键。当结合的原子电负性相差不大时,原子间倾向于通过共用电子对及原子轨道的重叠而形成共价键(covalent bond),其分子或分子内的键以共价性(covalent character)为主;当结合的原子电负性相差较大时,原子间会倾向于发生电子转移而形成阴、阳离子,阴、阳离子间由于存在静电引力而形成离子键(ionic bond),其分子或分子内的键以离子性(ionic character)为主。
元素的电负性(electronegativity)是指元素的原子在分子中吸引电子(或电子对)的能力。很显然,原子间相互结合所形成的分子,其离子性或共价性成分的高低与成键原子的电负性差值密切相关:元素的电负性差值越大,所形成的分子或分子内的键离子性越大、共价性越小;元素的电负性差值越小,所形成的分子或分子内的的键共价性越大、离子性越小。近代实验表明,即使在电负性最小的铯元素(Cs)与电负性最大的氟元素(F)所形成的最典型的离子型化合物氟化铯(CsF)中,分子或键的离子性也不是100%的,而只有92%的离子性。也就是说,它们离子间也不是纯粹的静电作用,而仍有部分原子轨道的重叠,即阴、阳离子间的键仍有8%的共价性。研究表明,当两种元素的电负性差值为1.7时,原子间结合的单键约具有50%的离子性;大于1.7时,以离子性为主;小于1.7时,以共价性为主[1]。
离子化合物中阴、阳离子间静电引力即离子键的强弱可用晶格能来衡量。晶格能是指一定条件下相互远离的气态阴、阳离子聚集起来,结合成1mol固体离子化合物时所释放出来的能量。晶格能的大小与阴、阳离子的电荷数成正比,与它们之间的核间距成反比。晶格能越大,阴、阳离子间的结合力即离子键越强,离子化合物的熔、沸点越高,硬度越大。
2.2 宏观能量和理化性质方面的数据比较
钠的卤化物和碱土金属氧化物的一些基本性质见表2[1-2]。从表2中的数据可以看出,NaF、NaCl、NaBr、NaI的元素电负性X(鲍林数据)差值X的变化情况是3.05→2.23→2.03→1.73,X值依次减小,说明钠的卤化物的离子性依同族卤素从上到下的次序逐渐减弱。数据还表明,钠的卤化物的熔点也是依同族卤素从上到下的次序逐渐降低的,说明晶体中的离子键逐渐减弱。

表2 钠的卤化物和碱土金属的氧化物的一些基本性质
尤其值得注意的是,碱土金属的氧化物,其离子性和离子键的变化情况就不是上述钠的卤化物那种“同向关系”。从表2可知,碱土金属氧化物的熔点和硬度依同族元素从上到下的次序在总的趋势上逐渐降低,说明晶体中的离子键逐渐减弱(与钠的卤化物的变化情况相似);但MgO、CaO、SrO、BaO元素电负性差值X的变化情况是1.87→2.13→2.44→2.49→2.55,X值依次增大,说明碱土金属氧化物的离子性依同族元素从上到下的次序逐渐增强。
2.3 微观结构方面的洞察分析
从微观结构方面洞察,元素电负性的大小,主要取决于元素的有效核电荷和原子半径。同一主族元素,如卤素或碱土金属元素,可认为其有效核电荷增加得不是很显著,但从上到下原子的电子层数增大,原子半径增大得较为显著,故而原子核对价电子的吸引力减小,所以元素的电负性减小,钠的卤化物电负性差值减小,分子的离子性减弱;碱土金属氧化物的电负性差值增大,分子的离子性增强。同一周期的主族元素,从左到右,有效核电荷增大,原子半径减小,原子核对价电子的吸引力增大,所以元素的电负性增大,可以判断,同周期从碱金属到碱土金属,如从钠到镁,其氯化物或氧化物,元素的电负差值减小,分子的离子性减弱。
在离子化合物晶体中,静电引力就像“胶合剂”一样把阴阳离子“胶合”在一起。显然,这种“胶合力”即离子键的强度与阴阳离子的电荷和核间距密切相关,电荷越高、核间距越小,阴阳离间的“胶合力”即离子键越强。同一主族元素,如卤素或碱土金属元素,离子的电荷相同,但从上到下离子的半径增大,阴阳离子的核间距增大,所以钠的卤化物中的离子键减弱,碱土金属氧化物中的离子键在总的趋势上也是减弱的;同一周期的主族元素,从左到右,如从碱金属到碱土金属,由于阳离子电荷增大、半径减小,所以它们与同种元素形成的离子化合物离子键增强,可以预料,从钠到镁,其氯化物或氧化物中的离子键增强。
从表2中的数据还可以看出,BeO的熔点似乎有点“反常”,不符合碱土金属氧化物熔点的一般变化规律,这也是由铍特殊的微观结构所决定的:在碱土金属元素中,铍的原子半径最小、原子核对外层电子的吸引力最大,所以其电负性最大;碱土金属氧化物中BeO的元素电负性差值最小,所以它有较大成分的共价性,故其熔点不完全符合典型离子晶体的变化规律;由于BeO固体具有较高成分的原子晶体性质,所以其熔点还是很高的,并具有相当大的硬度。相比之下,NaI(元素间的电负性差值X为1.73)应该比BeO(X为1.87)有更大的共价性成分,但由于Na是一价元素,在NaI固体中不可能有键数较多的大分子原子晶体性质,所以其熔点不可能很高。
3 共价性与共价键
在卤素分子X2中,两个成键原子属于同种元素,电负性完全相同,所以卤素分子是完全的共价性分子。在卤化氢分子HX中,两个成键原子属于不同种元素,电负性存在着差异,所以卤化氢分子都是极性共价分子,都有一定的离子性;换句话说,它们都是具有一定离子性成分的共价分子。其变化规律是:同族元素从上到下,HX分子的离子性依次减弱,共价性依次增强(见表3中卤化氢分子的偶极矩变化规律[1-2])。

表3 卤化氢分子的偶极矩及键能数据
在共价分子中,带负电性的共用电子对就像“胶合剂”一样把两成键原子的原子核(带正电)“胶合”在一起,这种“胶合”作用力就是共价键(covalent bond)。显然,共用电子对对成键原子核的“胶合力”即共价键的强度与成键原子的电负性、有效核电荷和原子半径(或原子核间距即键长)密切相关,元素的电负性越大,有效核电荷越高、原子半径(键长)越小,共用电子对对成键原子核的“胶合力”即共价键越强。
在卤化氢分子HX中,同族元素从上到下,卤素X的原子半径显著增大、电负性显著减小,H与X成键后共用电子对对两原子核的“胶合力”依次减弱,故共价键依次减弱(见表3中卤化氢分子的键能变化规律)。
再比较不同类型分子的共价性和共价键情况。以I2分子与HF分子为例,前者是百分之百的共价性分子(偶极矩μ为零),后者是含有较大离子性成分的共价性分子(μ为1.91 D)。前者中I的电负性较小(2.66),I-I的键长较大(266 pm),所以共价键较弱(键能149 kJ/mol);后者中F的电负性很大(3.98),H-F的键长较小(92 pm),所以后者的共价键较强(键能569 kJ/mol)[1-2 ]。
4 结语
化学知识是包含许许多多化学概念的完整体系,化学概念是形成化学知识的单体和基础[5]。因此,加强化学基本概念的教学,能使学生对化学所研究的物质及其变化的认识不致停留在低级的感性阶段,能使他们更完全、更深刻地认识化学所研究的具体物质及其变化规律。对化学概念的理解不仅是学生学好化学理论、化学定律,理解物质性构关系的前提和基础,也是提升学生智力、特别是逻辑思维能力的必要条件。因此,化学概念在化学教学中占有十分重要的地位,在教学中必须予以足够的重视。
在化学概念的教学中,要使学生形成化学概念、掌握化学概念,就必须让学生明确概念的内涵和外延,明确概念的类别和概念之间的关系[5-7]。如“金属键”和“金属性”概念,前者是指金属晶体中结构质点间的结合力即自由电子对金属阳离子的胶合作用(概念的内涵),适用范围可以包含任何金属(概念的外延);后者是指元素的原子失电子的倾向(概念的内涵),适用范围可以包括任何元素(概念的外延)。本文中所述的这些“形近义异,似是而非”的概念,都属于物质结构或物质性质类的概念,概念间存在着“对立”(如“共价键”与“离子键”间,“共价性”与“离子性”间)或“交叉”(如“共价键”与“共价性”间,“离子键”与“离子性”间)等复杂微妙的关系,这些概念的教学要求我们无比重视从宏观现象(能量数据、理化性质)到微观结构的洞察分析和抽象推理,以及性构相依核心化学思想的指导作用[8]。
