CT联合实时超声引导经皮穿刺活检胸膜或胸膜下结节
2019-12-19赵艳军
刘 君,赵艳军,张 雷,刘 妍,李 薇
(南京医科大学附属无锡第二医院影像科,江苏 无锡 214002)
胸膜或胸膜下结节(small pleural or peripleural nodule, SPPN)常表现为平行于胸膜的扁平增厚,其临床及影像学表现均缺乏特异性,常需进行病理组织活检才能明确诊断[1]。CT已广泛用于引导经皮胸部穿刺,但传统CT引导不能实时监视穿刺过程、显示病灶随呼吸运动的位置变化,使得活检SPPN的技术难度较活检肺深部病灶更高[2-4]。超声具有可实时引导、无电离辐射损伤及多方位成像的优点,已用于活检胸膜或胸膜下肿块[5-6];但超声探头的窗口一般较窄,常不能同时兼顾穿刺点及病灶,且易受邻近肋骨和含气肺组织的干扰,故较少用于单独引导活检SPPN。本研究探讨CT联合实时超声引导穿刺活检SPPN的可行性。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月—2019年3月于我院接受经皮穿刺活检的38例SPPN患者的临床及影像学资料,男30例,女8例,年龄26~85岁,平均(65.3±13.4)岁。纳入标准:胸膜病灶或肺内病灶紧贴胸膜,与胸膜接触面长度>1 cm;结节最大径<3 cm或弥漫胸膜增厚>5 mm;术前胸部CT增强扫描排除血管性病变及病灶内动静脉瘘;能够配合检查。对其中17例行CT联合超声引导下活检(CT+US组),男14例,女3例,平均年龄(67.2±13.6)岁;21例行单纯CT引导活检(CT组),男16例,女5例,平均年龄(63.5±13.1)岁。
1.2 仪器与方法 采用Philips Precedence 16排螺旋CT机及FUJIFILM SonoSite便携式超声诊断仪为引导设备。活检术前均行胸部CT扫描,定位病灶后确定皮肤穿刺点及穿刺角度和深度,并标记皮肤进针点。由2名高年资放射科医师完成所有操作。CT扫描参数:管电压120 kV,管电流100 mA,层厚 5 mm,间隔5 mm,准直器宽度5 mm。
CT+US组:利用便携式超声诊断仪(低频探头频率3.5~5.0 MHz,高频探头频率4~13 MHz)在穿刺点周围探测病灶位置。将探头固定在计划穿刺路径上,按照CT预设的穿刺角度进行穿刺。根据穿刺针的延长线实时调整探头角度,待穿刺针进入超声视野后,针对声像图所示病灶进行实时引导,直到穿刺针针尖抵达病灶边缘(图1、2)。CT扫描确认穿刺针位置后,以18G全自动活检枪在实时超声监视下切割,取得1~2条长度为13~23 mm的组织。
CT组:以5 ml 1%利多卡因浸润麻醉穿刺点和穿刺路径后,采用16G外引导针逐步进针,进行常规经皮穿刺;再以穿刺层面为中心进行小范围CT扫描,引导调整穿刺深度和角度,重复上述操作,直至针尖抵达病灶边缘(图3)。采用18G全自动活检枪切割长度为13~23 mm的组织1~2条。
取样后拔出穿刺针,嘱患者仰卧、双手上举,复查胸部CT,观察有无气胸及出血。手术结束后,嘱患者以穿刺点向下的压迫体位卧床休息至少2 h,避免大声讲话及剧烈咳嗽。术后3~6 h拍摄常规立位胸片,以排除迟发性气胸。

图1 患者男,61岁,右侧胸膜下结节,CT联合超声引导穿刺,病理提示为腺癌 A.术前CT定位扫描确定穿刺路径; B.超声探测到CT标记的病灶(*); C.穿刺针按计划路径进入超声视野(白箭),直接经肋骨(△)后缘进入病灶; D.CT扫描确认针尖位置; E.超声监视下切割组织; F.术后复查,病灶内见少量气体
1.3 相关指标观察 测量病灶厚度、病灶与胸膜的接触面长度、穿刺深度(皮肤进针点到设定靶区的距离)、CT引导次数、手术时间(局部麻醉开始到确认针尖抵达设计靶区的时间)、占机时间(患者进入CT扫描室至离开的总时间)、CT扫描产生的有效辐射剂量以及术后并发症。以每次扫描的剂量长度乘积(dose-length product, DLP)累加表示CT剂量,分别计算引导扫描和围术期(术前定位和术后复查扫描的剂量之和)CT产生的有效辐射剂量,并计算总辐射剂量。有效辐射剂量=DLP×权重因子k,胸部k为 0.017 mSv/(mGy·cm)。
1.4 统计学分析 采用SPSS 10.0统计分析软件。计量资料以±s表示,组间比较采用t检验;采用χ2检验比较计数资料。P<0.05为差异有统计学意义。
2 结果
2组患者性别、年龄及病灶数、厚度、与胸膜接触面长度及穿刺深度差异均无统计学意义(P均>0.05),见表1。CT+US组引导CT扫描次数、手术时间、占机时间及引导扫描时的有效辐射剂量和总剂量均低于CT组(P均<0.01),2组围手术期有效辐射剂量及术后发生气胸、出血差异均无统计学意义(P均>0.05),见表2。
3 讨论
穿刺SPPN可以采用经皮垂直于胸膜病灶的直接进针法,或平行于胸膜沿病灶长轴的切线进针法[1]。由于SPPN多表现为平行于胸膜的扁平增厚,故垂直进针法能够获取的样本长度不及切线进针法;且经由皮肤垂直进入病灶,缺乏正常肺组织“桥”,更易发生皮下针道转移;能够获得的支撑穿刺针的软组织较薄,尤其对于前胸壁病灶,可致CT引导扫描时穿刺针不能牢固锚定而影响后续的方向调整[2]。切线进针法有助于克服垂直进针法的不足,但其穿刺路径过长,加上常规CT引导不能实时监测进针,因此其技术难度比穿刺深中超声较少用于引导活检SPPN,主要原因在于超声视野窄,且易受邻近肋骨和含气肺组织的干扰,单独超声常不能规划出最佳穿刺路径部肺病灶更高。使用CT透视功能可克服传统CT引导穿刺不能实时监控的不足,但亦使患者和操作者受到更大剂量的电离辐射[7]。超声具有可实时引导、无电离辐射损伤及多方位成像的优点。临床实践,且单纯超声定位SPPN非常耗时。

表1 2组患者一般资料和病灶特征比较
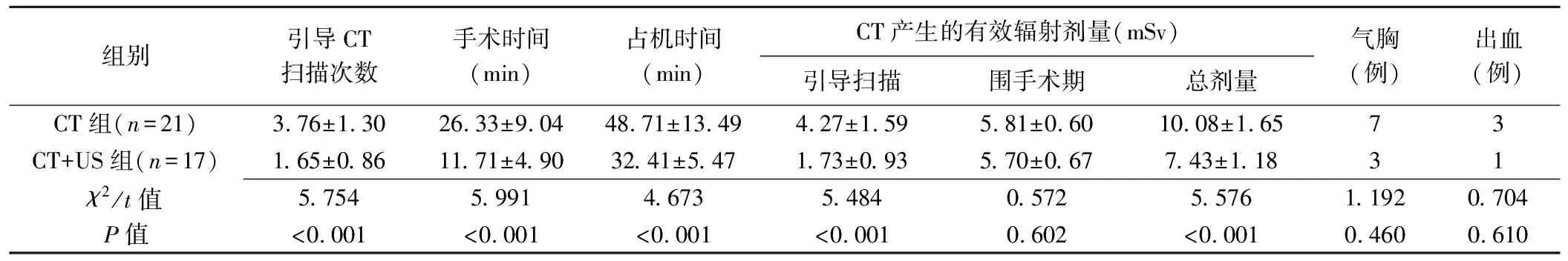
表2 2组穿刺相关指标和术后并发症比较

图2 患者男,73岁,胸膜多发钙化增厚,CT联合超声引导穿刺,病理提示纤维结缔组织 A.术前CT定位扫描确定皮肤进针点和穿刺路径; B.声像图示病灶,按CT所示穿刺路径进针,穿刺针(白箭)进入超声视野后,继续在超声监视下经肋骨(Rib)间隙进入病灶边缘(*); C.CT扫描确认针尖位置; D.术后复查CT未见气胸及出血

图3 患者男,45岁,右侧胸壁多发胸膜增厚,常规CT引导穿刺,病理提示转移性腺癌 A.术前CT定位扫描确定穿刺路径; B.以局部麻醉针头作为标记,再次扫描确认位置; C~E.反复CT扫描引导逐步进针; F.穿刺针针尖抵达病灶边缘后切割组织
本研究中,与常规CT引导穿刺SPPN相比,采用CT定位规划穿刺路径,联合超声按规划路径实时引导穿刺,可显著缩短手术操作时间和CT占机时间。实时超声引导能够在患者一次屏气内完成穿刺和组织切割,这对于小的可移动病灶尤为重要,尤其是那些仅附着于脏层胸膜的病灶。由于穿刺针针尖存在坡面,采用平行于胸膜的切线位进针,穿刺针坡面接触肋骨凸面时易偏离穿刺方向。单纯CT引导往往需多次扫描,以调整进针角度;联合超声监视可使穿刺针顺利通过肋骨凸面,即使对于那些完全位于肋骨下的病灶(超声探测病灶本身困难),超声亦有益于穿刺针顺利通过肋骨。
本研究结果显示,单纯CT引导组术后气胸(无症状)和肺内出血发生率分别为33.33%(7/21)和14.29%(3/21),而CT联合超声组分别为17.65%(3/17)和5.88%(1/17),2组差异无统计学意义,可能与样本量小有关。反复多次穿刺胸膜或针尖在胸膜处停留可能是导致气胸发生的主要原因[8]。常规CT不能动态监测、实时显示针尖与胸膜的位置关系以及病灶位置随呼吸运动的变化,需要频繁调整穿刺方向。本组中常规CT组引导CT平均扫描次数为(3.76±1.30)次(2~6次),而联合超声后下降至平均(1.65±0.86)次(1~3次),其中10例为1次穿刺成功。穿刺胸膜过程中,超声直视可减少反复损伤胸膜的机会,也有利于避免穿刺针在胸膜区停留导致的胸膜撕裂;活检针抵达设定靶区后,超声监视能够直接显示切割组织的深度,把握切割深度、掌握病灶随呼吸运动的位置变化能够减少盲切胸膜和肺组织的可能,这可能是CT联合超声组术后气胸和肺内出血率相对较低的主要原因。CT联合超声组患者辐射剂量较单纯CT组下降约60%,有效辐射剂量下降约27%。近期研究[9]表明,经胸超声可用于检测气胸、监测胸部穿刺后并发症,有助于进一步降低有效辐射剂量。
本研究的主要局限性:为回顾性研究,受CT和超声设备协调以及介入和超声医生工作日程等影响,未进行随机分组;未设立单独超声引导SPPN活检组,原因在于尽管对部分与胸膜有较大接触面的病灶可采用超声引导[10],但受病灶相对较小及呼吸运动和肋骨阻挡等因素影响,超声检查存在一定失败率。
总之,CT联合实时超声引导穿刺活检SPPN可实现CT精确定位制定手术路径与实时超声引导和监测优势互补,显著缩短穿刺操作时间,降低穿刺操作难度,减少辐射剂量。
