不同产地党参多糖含量及抗氧化活性比较
2019-12-03叶英李珊张景宜赵永珍哈生云刘圆
叶英 李珊 张景宜 赵永珍 哈生云 刘圆


摘要 [目的]比較不同产地党参多糖含量及抗氧化活性。[方法]采用单因素和正交试验设计优化党参多糖提取工艺条件,对不同产地党参多糖的含量进行比较,并采用ABTS、DPPH自由基清除率试验及铁离子还原法对不同产地党参多糖抗氧化活性进行比较。[结果]超声辅助法提取党参多糖的最佳工艺条件为超声温度60 ℃、超声时间40 min、料液比1∶30、提取次数3次;此条件下,吉林长白山的党参多糖得率最高,达29.56%,其次是青海尖扎党参,多糖含量达22.38%。不同产地党参多糖对ABTS自由基清除能力从大到小依次为甘肃定西、青海尖扎、青海大通、四川雅安、山西太行、吉林长白山,对DPPH自由基清除能力从大到小依次为甘肃定西、青海大通、青海尖扎、山西太行、吉林长白山、四川雅安,铁离子还原能力从大到小依次为青海大通、甘肃定西、吉林长白山、山西太行、四川雅安、青海尖扎。[结论]该研究为党参多糖的质量品质评价及抗氧化功能性食品的研究开发提供理论依据。
关键词 党参多糖;不同产地;含量;抗氧化活性
中图分类号 R284文献标识码 A
文章编号 0517-6611(2019)21-0184-05
doi:10.3969/j.issn.0517-6611.2019.21.055
开放科学(资源服务)标识码(OSID):
Comparison of Polysaccharide Content and Antioxidant Activity of Codonopsis pilosula in Different Producing Areas
YE Ying, LI Shan, ZHANG Jingyi et al
(College of Agriculture and Animal Husbandry,Qinghai University,Xining,Qinghai 810016)
Abstract [Objective] The research aimed to compare the polysaccharide content and antioxidant activity of Codonopsis pilosula in different producing areas.[Method]The extraction conditions of Codonopsis pilosula polysaccharides were optimized by single factor and orthogonal design. The content of Codonopsis pilosula polysaccharides from different producing areas was compared,and the antioxidant activities of Codonopsis pilosula polysaccharides were compared by ABTS free radical, DPPH free radical scavenging rate test and iron ion reduction method. [Result]The optimum conditions for ultrasonic extraction of Codonopsis pilosula polysaccharides were as follows: ultrasonic temperature 60 ℃, ultrasonic time 40 min, solidliquid ratio 1∶30, extraction times 3 times. Under the optimum extraction conditions, the yield of polysaccharide from Codonopsis pilosula was 29.56% in Changbai Mountain of Jilin Province,followed by Codonopsis pilosula in Jianzha of Qinghai Province, and the content of polysaccharide was 22.38%. The scavenging capacity of Codonopsis pilosula polysaccharides from different producing areas to ABTS free radicals from large to small was Gansu Dingxi,Qinghai Jianzha, Qinghai Datong, Sichuan Yaan, Shanxi Taihang, Jilin Changbai Mountain. The scavenging capacity of DPPH free radicals from large to small was Gansu Dingxi, Qinghai Datong, Qinghai Jianzha, Shanxi Taihang, Jilin Changbai Mountain, Sichuan Yaan, and iron reduction capacity from large to small was Qinghai Datong, Gansu Dingxi, Jilin Changbai Mountain, Shanxi Taihang,Sichuan Yaan, Qinghai Jianzha.[Conclusion] The research provides theoretical basis for the quality and quality evaluation of Codonopsis pilosula polysaccharides and the research and development of antioxidant functional foods.
Key words Codonopsis pilosula polysaccharide;Different producing areas;Content;Antioxidant activity
基金项目 青海省科技合作专项(2016-HZ-821)。
作者简介 叶英(1983—),女,湖北咸宁人,副教授,博士,从事青藏高原特色生物资源及功能性食品研发研究。通信作者,教授,博士,硕士生导师,从事民族药品种、品质评价和新药资源开发与利用研究。
收稿日期 2019-06-02;修回日期 2019-06-18
党参(Codonopsis pilosula)又名黄参、黄党[1],富含多种活性成分,药效与人参相近,它经常在医学上用来代替人参使用[2]。作为一种传统的滋补药,党参有补益元气、健脾、益肺的作用,主要用于血虚不足和萎黄、脾胃虚弱、长期腹泻等的治疗,具有祛痰止咳、生津止渴等效用[3]。党参不仅作为药材药用,还可作为保健食品食用,是天然的优质资源。近年来,研究学者对党参的化学成分及生物活性进行了广泛研究[4-6],同时也拓展了党参功能性食品的开发应用前景。党参主要成分包括萜类、糖、甾体类、黄酮类等,其中多糖作为党参的主要有效成分之一,具有抗氧化[7]、抗肿瘤[8-9]、增强记忆力[10]、提升机体免疫力[11]等作用。张雅君等[12]研究发现党参多糖是一种新型的免疫调节剂,对小鼠巨噬细胞的吞噬能力具有显著的提高作用;秦楠等[13]以党参多糖为原料,研制出党参荞麦保健醋饮料;廖威等[14]以党参、芦荟为研究原料,研制出具有消炎杀菌功能的复合保健饮品。
我国党参资源丰富,各地均有大量栽培,党参多糖及其抗氧化活性也成为研究热点[15-17],但是关于不同产地党参多糖含量及抗氧化活性比较鲜见报道。我国不同地区气候差异较大,可能导致党参品质迥异,尤其是青藏高原地理环境特殊,独特的冷凉气候致使许多植物有效成分的积累与其他地区截然不同,生物活性可能也会存在较大差异。该研究采集了我国地理分布差异较大的6种党参,通过单因素和正交试验对党参多糖提取进行工艺优化,并对青藏高原地区与国内其他几个党参主产区的党参多糖含量进行差异性研究,通过测定ABTS、DPPH自由基清除率及铁离子还原能力等,比较不同产地党参多糖的抗氧化活性,以便为党参多糖的质量品质评价、种植生境选择及抗氧化功能性食品的研究开发提供理论依据。
1 材料与方法
1.1 材料与试剂
党参,产地青海尖扎、青海大通、四川雅安、吉林长白山、山西太行、甘肃定西。
苯酚,天津市富宇精细化工有限公司;羟自由基试剂盒、超氧阴离子自由基试剂盒,南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(ABTS)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(DPPH),南京奥朵福尼生物科技有限公司;无水乙醇、冰乙酸、无水乙酸钠,均为分析纯。
1.2 仪器与设备
KC-130小型粉碎机,浙江武义鼎藏日用金属制品厂;SB-3200DTD超声波清洗机,宁波新芝生物科技股份有限公司;UV-2600紫外可见分光光度计,岛津企业管理有限公司;ESJ110-4B电子天平,沈阳龙腾电子有限公司;DF-101S集热式恒温加热磁力搅拌器,河南予华仪器有限公司;XW-80A旋涡混合器,上海驰唐电子有限公司;RE-2008B旋转蒸发仪,上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 党参多糖不同提取方法对比研究[18]。
党参粉碎后过60目筛,各称取2份1.00 g粉末,按1∶30料液比,浸泡于蒸馏水中30 min,并在相同条件(30 min,60 ℃)下进行常规加热提取和超声提取,依据苯酚-硫酸法[19]测定原理测定其多糖含量。
1.3.2 多糖含量测定方法。
参考朱志川等[20]的方法。分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL的1 mg/mL葡萄糖标准溶液于具塞比色管中,加入6%苯酚溶液1 mL并定容至2 mL,摇匀后快速加入5.0 mL H2SO4,静置5 min后再沸水浴15 min,冷却后于490 nm处测定吸光度,以葡萄糖标准溶液的质量浓度(mg/mL)为横坐标、吸光度为纵坐标,绘制葡萄糖标准曲线,得回归方程y=15.729x+0.017 1(R2=0.997 8),根据回归方程及公式(1)计算样品中多糖含量。
多糖提取率=(C×V×N)/M×100%(1)
式中,C为测定的不同吸光度所对应的多糖溶液浓度(mg/mL);V为移取稀释后粗多糖溶液的体积(mL);N为稀释倍数;M为干燥的党参样品粉末质量(g)。
1.3.3 单因素试验。
采取超声法进行单因素试验,研究不同提取温度(30、40、50、60、70 ℃)、提取时间(20、30、40、50、60 min)、料液比[1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)]及提取次数(1、2、3、4、5次)对党参多糖得率的影响。
1.3.4 正交试验。
以单因素试验结果为基础,多糖得率为考察指标,设计L9(34)正交试验(表1),以确定党参多糖提取的最佳工艺参数。
1.3.5 不同产地党参多糖含量比较。
分别称取6个不同产地(青海尖扎、青海大通、四川雅安、吉林长白山、山西太行和甘肃定西)党参样品各1.00 g,按“1.3.2”方法测定多糖含量,并进行比较。
1.3.6 ABTS自由基清除能力测定。
参考Zhang等[21]的方法。称取0.33 g过硫酸钾,加入7 mmol/L ABTS溶液,于避光、室温条件下搅拌均匀,反应16 h后,在734 nm处,用PBS溶液将该混合液的吸光度稀释至0.700±0.005。用蒸馏水配制党参多糖溶液至不同浓度(1.5、3.0、6.0、12.0、24.0、48.0、72.0、96.0、120.0 mg/mL),按体积比为1∶20(V∶V)与ABTS溶液混合均匀,并以VC為阳性对照,在避光、室温下反应6 min后于734 nm处测定吸光度,并按公式(2)计算ABTS自由基清除率[22]。
清除率=1-A1A0×100%(2)
式中,A1为测得样品吸光度;A0为测得空白对照吸光度。
1.3.7 DPPH自由基清除能力测定。
参考刘志庆等[23]的方法。各吸取2 mL不同浓度(0.005、0.010、0.025、0.050、0.100、0.200、0.300 mg/mL)的党参多糖溶液,并加入5×10-5 mol/L DPPH溶液2 mL,室温条件下静置反应30 min,于517 nm处测定吸光度,并按公式(2)计算清除率。
1.3.8 铁离子还原能力测定。
参考韩洪坤等[24]的方法。按10∶1∶1(V∶V∶V)体积比配制FRAP工作液(pH = 3.6,300 mmol/L NaAc-HAc缓冲液、20 mmol/L FeCl3溶液和10 mmol/L TPTZ溶液)。各吸取150 μL不同浓度(0、0.2、0.4、0.6、0.8、1.0 mmol/L)FeSO4溶液,分别加入4.5 mL上述工作液,37 ℃温水浴下反应10 min,于593 nm处测定吸光度,得标准曲线方程y=0.810 1x+0.042 8(R2=0.996 8)。
配制浓度为10 mg/mL的不同党参多糖溶液,按上述标准曲线操作方法进行试验,并用50 μg/mL VC溶液进行阳性对照,于593 nm处测定其吸光度。代入标准曲线算出对应的FeSO4浓度,还原力用对应的FeSO4浓度(μmol/L)表示。计算公式为抗氧化能力(μmol/L FeSO4)=OD样品-OD空白。
1.3.8.1 重现性试验。
称取同一份党参多糖样品,每2 h取一次,进行8次独立试验,计算该还原力结果所对应的相对标准偏差(RSD),以评价重现性优劣。
1.3.8.2 精密度试验。
按照上述“1.3.8.1”的操作步骤,以多次测定、计算出的還原力结果的相对标准偏差(RSD)来评价该方法的精密度优劣。
1.3.8.3 可靠性试验。
配制党参多糖溶液0、0.2、0.4、0.8、1.6、3.2 mg/mL,按照上述FeSO4标准曲线操作方法分别进行试验,用线性相关系数r评价该方法的可靠性,观察浓度-还原力线性关系。
2 结果与分析
2.1 常规加热法和超声提取法制备党参多糖比较
常规加热法和超声提取法对党参多糖得率的影响结果见表2所示,发现超声提取法效果优于常规加热法,党参多糖得率达19.52%±0.14%,是常规加热提取法的 3 倍,说明超声提取法是提取党参多糖的较优方法。
安徽农业科学 2019年
2.2 超声法提取党参多糖的单因素试验
2.2.1 提取时间对党参多糖得率的影响。
由图1可知,党参多糖得率随时间的增加明显升高,提取时间达40 min时,党参多糖得率最高,为18.66%±0.12%;时间超过40 min后,多糖得率下降,推测可能是由于超声提取时间过长导致党参多糖结构不稳定而分解,同时杂质溶出增加,进而导致多糖得率下降。因此,党参多糖提取时间建议控制在40 min左右。
2.2.2 料液比对党参多糖得率的影响。
由图2可知,随着料液比的增大,党参多糖得率呈现出先升高后降低的趋势,当料液比达1∶40时,党参多糖得率达最大值,为32.14%±0.47%。当料液比大于1∶40,党参多糖得率开始下降,这可能因为料液比过大导致党参中杂质溶出增加造成的,因此,从党参多糖得率和节约溶剂角度考虑,建议料液比选用 1∶40左右为宜。
2.2.3 提取温度对党参多糖得率的影响。
由图3可知,党参多糖得率随温度的升高而增大,当温度达到50 ℃时,多糖得率达到最大,为38.42%±0.25%,之后随着超声温度上升党参多糖得率开始缓慢下降,这可能是党参多糖结构在高温超声作用下被破坏的原因。因此党参多糖提取过程中温度应控制在50 ℃左右。
2.2.4 提取次数对党参多糖得率的影响。
由图4可知,党参多糖得率随提取次数的增加呈现出先增大后减小的趋势,当提取次数达3次时,党参多糖得率达最大值,为25.38%±0.32%。这可能是由于提取次数过多导致党参中其他非糖类物质溶出增加。因此,党参多糖提取次数建议3次为宜。
2.3 超声法提取党参多糖的正交试验
以单因素试验结果作为基础,多糖得率为考察指标,对提取时间、提取温度、料液比、提取次数4个因素进行考察,开展正交设计试验。结果见表3。 由表3可知,以党参多糖得率为指标,4个因素影响大小顺序为A(提取时间)>D(提取次数)>C(料液比)>B(提取温度),最优提取工艺组合为A2B3C1D2,即党参多糖最优提取工艺方案为提取时间40 min、提取温度60 ℃、料液比1∶30、提取次数3次。
2.4 不同产地党参多糖含量比较
经分析,6个不同产地党参多糖含量从大到小依次为吉林长白山、青海尖扎、四川雅安、青海大通、山西太行、甘肃定西。不同产地党参多糖含量差异较大,其中产自吉林长白山的党参多糖含量最高,为29.56%±0.15%,青海尖扎(22.38%±0.12%)次之,甘肃定西党参多糖含量最低,为19.58%±0.02%。这可能是由于党参的光照、土壤、降水量以及气候等条件环境不同造成的,长白山的火山使其土壤含有丰富的矿物质,降水量足,虽然光照时间短但有明显的垂直气候变化,可能有利于糖分积累,而甘肃定西属于黄土高原地域的丘陵沟壑区,土壤贫瘠,降水量少且多暴雨,独特的半湿润半干旱气候,可能不利于糖类物质的合成。
2.5 不同产地党参多糖体外抗氧化能力比较
2.5.1 ABTS自由基清除率分析。
由图5可知,党参多糖对ABTS自由基清除率开始随样品浓度增大而增加,达到一定浓度后,ABTS自由基清除率达到最大值,继续增大党参多糖样品浓度,清除率开始逐步减小,清除率减小可能是党参多糖的溶解性降低造成的。当清除率达最大值时,不同产地党参多糖对ABTS自由基清除能力从大到小依次为甘肃定西、青海尖扎、青海大通、四川雅安、山西太行、吉林长白山。甘肃定西产的党参多糖虽然含量最低,但是其抗氧化能力最强,对ABTS自由基清除率最高可达87.26%,这可能与党参多糖种类不同有关;青海尖扎及青海大通产的党参多糖对ABTS自由基清除能力次之,青海地处青藏高原,此生境中的植物大多具有抗逆性,化学成分积累有其独特性,较强的抗氧化能力可能与其长期高寒缺氧的适应性有关。
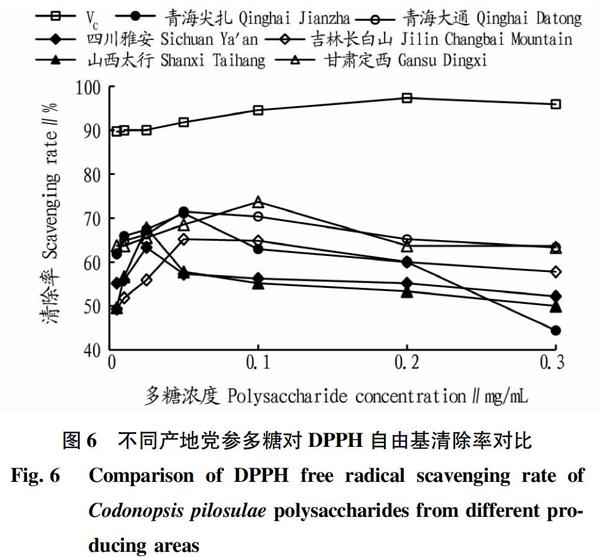
2.5.2 DPPH自由基清除率分析。
由图6可知,党参多糖对DPPH自由基清除效果在浓度为0~0.30 mg/mL呈现先增大后略微下降趋势,当浓度达到一定值后其对DPPH自由基的清除效率达到最大,而后随着浓度的增加清除率有一定程度下降,最终清除率变化趋于稳定。在最优浓度条件下,各产地的党参多糖对DPPH自由基清除能力从大到小依次为甘肃定西、青海大通、青海尖扎、山西太行、吉林长白山、四川雅安。对DPPH自由基清除率最高的是甘肃定西产的党参多糖,最高值达73.70%,其次是青海大通与青海尖扎,清除能力最弱的是四川雅安产的党参多糖,这可能与不同产地党参多糖种类及其溶解性差异有关,其具体作用机制还需进一步深入研究。
2.5.3 铁离子还原能力分析。
由图7可见,不同产地党参多糖水溶液(10 mg/mL)对铁离子还原能力在230~413 μmol/L FeSO4,经比较其抗氧化能力效果从大到小依次为青海大通、甘肃定西、吉林长白山、山西太行、四川雅安、青海尖扎。青海大通产的党参多糖对铁离子还原能力最大,达 413 μmol/L FeSO4,青海尖扎产的党参多糖對铁离子还原能力最差,仅为230 μmol/L FeSO4,两者均产于高寒缺氧的青藏高原,气候条件有相似之处,但是差异如此之大,推测可能是两地的土壤类型不同造成多糖种类迥异的原因,青海大通主要为黑钙土,植物生长所需的营养物质较为丰富,青海尖扎土壤相对贫瘠些,部分土壤盐碱化,易板结且透水透气性不太好,2种差异较大的土壤环境使党参多糖在积累过程中的差异较大,不同多糖种类及含量导致在铁离子还原方法(FRAP法)中三价铁离子被还原成二价铁离子的过程中起到的作用不尽相同,具体多糖种类及结构的差异有待深入研究。
2.5.3.1 重现性试验。
按照“1.3.8.1”操作,8个平行试验测定党参多糖溶液的还原力相对标准偏差RSD为3.93%,说明FRAP法用来测定不同产地党参多糖的铁离子还原力重现性较好。
2.5.3.2 精密度试验。
按照“1.3.8.2”操作,8个平行样品测定党参多糖溶液的还原力相对标准偏差RSD为1.07%,说明FRAP法用来测定不同产地党参多糖的铁离子还原力精密度良好。
2.5.3.3 可靠性试验。
以青海尖扎的党参提取多糖为例,以党参多糖样品的浓度x(mg/mL)和梯度浓度样品溶液的还原力y(μmol/L FeSO4)进行线性回归,得到的方程为y=13.255x+0.912(R2=0.997 6)。说明FRAP法对不同产地党参多糖铁离子还原力的测定具有很好的可靠性。
3 结论
由于党参产地不同导致其多糖含量存在较大差异,其中产自吉林长白山的党参多糖含量最高,为29.56%±0.15%,青海尖扎次之,甘肃定西党参多糖含量最低。通过对ABTS自由基、DPPH自由基清除率及铁离子还原能力等一系列体外抗氧化指标的测定,发现不同产地的党参多糖抗氧化能力具有一定的差异性,甘肃定西产的党参多糖虽然含量最低,但是其对ABTS、DPPH自由基清除效果却最强,吉林长白山产的党参多糖虽然含量最高,但其对ABTS自由基清除效果却是最弱的,而青海大通产的党参多糖铁离子还原能力最强,说明党参多糖的体外抗氧化能力与其含量多少关系不大,推测可能主要还是不同的气候条件及土壤条件致使多糖种类不同造成的。就青海2个产地的党参多糖而言,青海大通的总体抗氧化效果还是较强的,这可能与青藏高原高寒缺氧的气候有关,而青海尖扎产的党参多糖主要对ABTS、DPPH自由基具有较好的清除作用,其对铁离子还原能力最差,造成青海两地党参多糖对铁离子还原能力差异较大的原因可能是两地的土壤条件不同使得多糖结构差异较大。从多糖含量和抗氧化能力综合来说,青海产的党参品质较优,具有较好的种植前景,这可能与青藏高原高寒缺氧的气候有关。该研究首次对青藏高原和国内其他不同产地党参多糖含量及其抗氧化活性进行比较,试验结果可为党参多糖的品质评价、种植产地选择及抗氧化功能性食品开发提供一定的理论依据。
参考文献
[1] 景定坤.党参古今辨析及其药效本草考证[J].亚太传统医药,2018,14(11):92-94.
[2] 刘美霞,戚进,余伯阳.党参药理作用研究进展[J].海峡药学,2018,30(11):36-39.
[3] 樊长征,洪巧瑜.党参对人体各系统作用的现代药理研究进展[J].中国医药导报,2016,13(10):39-43.
[4] 裴小平,郑倩敏.党参多糖的提取方法及生理功能研究进展[J].安徽农业科学,2017,45(32):130-133.
[5] MEKA V S,NALI S R,SONGA A S,et al.Characterization and in vitro drug release studies of a natural polysaccharide Terminalia catappa gum(Badam gum)[J].AAPS Pharm Sci Tech,2012,13(4):1451-1464.
[6] 胡志航,赵建斌,柴建新,等.党参的毒理学试验研究[J].中国卫生检验杂志,2018,28(19):2325-2329.
[7] 郭晓农,戚欢阳,王兵,等.党参多糖抗氧化作用及其对果蝇寿命的影响[J].食品科学,2013,34(15):285-288.
[8] YANG C X,GOU Y Q,CHEN J Y,et al.Structural characterization and antitumor activity of a pectic polysaccharide from Codonopsis pilosula[J].Carbohyd Polym,2013,98(1):886-895.
[9] XU C,LIU Y,YUAN G X,et al.The contribution of side chains to antitumor activity of a polysaccharide from Codonopsis pilosula[J].Int J Biol Macromol,2012,50(4):891-894.
[10] 張振东,吴兰芳,景永帅,等.党参多糖对小鼠学习记忆作用研究[J].山地农业生物学报,2010,29(3):242-245.
[11] 许朋,余兰,冯昆.党参多糖的提取及体内外免疫作用的研究[J].哈尔滨医药,2018,38(4):301-303.
[12] 张雅君,梁忠岩,张丽霞.党参粗多糖的组成及其免疫活性研究[J].西北农林科技大学学报(自然科学版),2012,40(7):199-202,208.
[13] 秦楠,崔政,刘丽君,等.党参多糖提取工艺优化及其保健醋饮料的研制[J].食品工业科技,2018,39(12):210-215.
[14] 廖威,杨春城,钟华锋,等.芦荟中药复合保健饮料的研制[J].食品科学,2004,25(6):207-209.
[15] NG T B,LIU F,WANG H X.The antioxidant effects of aqueous and organic extracts of Panax quinquefolium,Panax notoginseng,Codonopsis pilosula,Pseudostellaria heterophylla and Glehnia littoralis[J].Journal of ethnopharmacology,2004,93(2/3):285-288.
[16] LIU C,CHEN J,LI E T,et al.The comparison of antioxidative and hepatoprotective activities of Codonopsis pilosula polysaccharide(CP)and sulfated CP[J].Int Immunopharmacol,2015,24(2):299-305.
[17] 李启艳,祝清芬,刘春霖,等.党参多糖分离纯化及抗氧化活性研究[J].中草药,2017,48(5):907-912.
[18] 覃海元,潘嫣丽,覃梅珍.热水与超声波提取鹿角灵芝多糖工艺比较研究[J].中国食品添加剂,2011(3):91-95.
[19] 范传颍,陶正明,吴志刚.苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J].浙江农业科学,2013(7):799-801.
[20] 朱志川,王晓琳,刘恩荔,等.党参均一多糖含量测定及安全性研究[J].中华中医药学刊,2018,36(4):927-931.
[21] ZHANG H,YANG Y F,ZHOU Z Q.Phenolic and flavonoid contents of mandarin(Citrus reticulata Blanco)fruit tissues and their antioxidant capacity as evaluated by DPPH and ABTS methods[J].Journal of integrative agriculture,2018,17(1):256-263.
[22] 杨永晶,索有瑞,韩丽娟,等.树莓果油脂肪酸成分分析及其抗氧化活性研究[J].食品工业,2017,37(4):127-131.
[23] 刘志庆,郭绍芬,孙清新,等.不同年份茶藨子叶状层菌多糖含量及抗氧化性比较研究[J].山东农业科学,2017,49(1):73-76.
[24] 韩洪坤,杨晓彤,杨庆尧,等.铁离子还原法(FRAP)测定中国被毛孢菌丝体提取物抗氧化活性[J].上海师范大学学报(自然科学版),2011,40(3):271-275.
