产ε-聚赖氨酸菌株的筛选、鉴定及发酵
2019-11-28王昭君赵志军孙俊松史吉平王绍明
王昭君 赵志军 孙俊松 史吉平 王绍明

摘要:分别在培养基中添加2 g/L ε-聚赖氨酸(ε-PL)和复合抗生素抑菌剂,结合ε-聚赖氨酸与亚甲基蓝形成透明圈的现象初筛产ε-PL的菌株,根据ε-聚赖氨酸与道夫根试剂的特殊沉淀反应现象复筛获得5株菌株,经生理生化试验和16S rDNA分析鉴定,5株菌株中包括1株解淀粉芽孢杆菌(Bacillus amyloliquefaciens),1株蜡样芽孢杆菌(Bacillus cereus),1株链霉菌属(Streptomyces sp.,未鉴定到种)菌株,1株糖多孢属(Saccharopolyspora sp)菌株,1株白色链霉菌(Streptomyces albulus),其摇瓶发酵ε-聚赖氨酸产量分别为0.06、0.08、0.70、0.82、1.56 g/L;采用2阶段法对wzj4、wzj5进行5 L发酵罐发酵,结果发现,其ε-聚赖氨酸最大产量分别为2.54、6.99 g/L。凝胶色谱分析表明wzj5发酵液中ε-聚赖氨酸分子量大小与对照品相近,最小抑菌浓度为250 μg/mL,对大肠杆菌的抑菌效果良好。
关键词:ε-聚赖氨酸;ε-PL生产菌株;不同类型;筛选;鉴定;发酵;性能分析
中图分类号: S182文献标志码: A
文章编号:1002-1302(2019)18-0291-06
收稿日期:2018-05-25
基金项目:国家自然科学基金青年科学基金(编号:31300048)。
作者简介:王昭君(1991—),女,新疆奎屯人,硕士研究生,研究方向为绿洲农业生态。E-mail:wzjshz@163.com。
通信作者:赵志军,博士,副研究员,研究方向为代谢工程,E-mail:zhaozj@sari.ac.cn;王绍明,教授,研究方向为生态学,E-mail:westwild@vip.sina.com。
ε-聚赖氨酸(ε-poly-L-lysine,简称ε-PL)是由25~35个L-赖氨酸单体通过α-COOH和ε-NH2脱水缩合而成的氨基酸同型聚合物,相对分子质量通常为3 500~4 500 Du[1]。ε-PL具有广泛的抑菌谱,并且稳定性强,安全高效,目前我国已经批准其作为食品防腐剂[2],在国外更是已被广泛应用。
近年来,我国研究人员对ε-PL产生菌的筛选[3]、发酵[4]、产物鉴定[5]、提取[6]、应用[7]等进行了大量研究。传统的筛选工作通过鉴定摇瓶发酵液中的产物来确定所筛菌株是否能够产生ε-聚赖氨酸,筛选过程费时费力,且效率极低。Nishikawa等采用一种含酸性染料polyR-478的培养基筛选ε-PL产生菌,获得了大量ε-PL产生菌,包括链霉菌属(Streptomyces)、北里胞菌属(Kitasatosporia)、香柱菌属(Epichloe)等[8];该方法大大提高了筛选效率,且可获得不同菌种的ε-PL产生菌,但因为所用染料试剂的停产,该方法未得到普及[9]。目前,我国研究人员多用亚甲基蓝平板筛选法分离筛选ε-PL产生菌,如黄莉等利用含K2Cr7O7和亚甲基蓝的平板筛选出一株Streptomyces griseolus,其ε-PL产量为0.808 g/L[10]。张波用同样的方法从四川省成都市郊区土壤中筛选获得一株ε-PL产量为1.893 g/L的不吸水链霉菌Streptomyces ahygroscopicus SAC23[11]。
江南大学[12]、天津科技大学[13]、南京工业大学[14]等单位在ε-PL菌种筛选与发酵优化方面做了大量的研究工作。张超等筛到一株Streptomyces sp. M-Z18,该菌的摇瓶ε-PL产量为0.2 g/L,其所在课题组以Streptomyces sp. M-Z18为出发菌株采用物理化学诱变、原生质体融合、基因组重排(genome shuffling)技术等一系列方法进行ε-PL高产菌株选育,2007年以该菌株为出发菌株进行紫外诱变得到一株高产ε-PL的菌株C-18,其摇瓶ε-PL产量为1.23 g/L[15]。任喜东等提出了一种酸性pH值冲击策略,先将pH值调至5.0,对pH值冲击阶段进行预适应,再调节pH值至3.0,以调控菌体代谢活力,最后调节pH值至4.0为ε-PL的积累提供最适条件,在此条件下,5 L发酵罐的发酵产量达54.70 g/L,不仅达到了商业生产要求,甚至高于日本工业生产用菌Streptomyces albulus stain 410的报道产量(48.3 g/L)[16-17]。
本研究在筛选培养基中添加ε-PL和复合抗生素抑菌剂,结合ε-PL与亚甲基蓝的静电作用形成透明圈的特性,筛选不同类型的ε-PL生产菌株,并在摇瓶及5 L发酵罐中进行发酵,对不同类型ε-PL生产菌株产ε-PL的性能进行考察。
1 材料与方法
1.1 材料
1.1.1 样品
2016年9月从上海市郊区采集土样,除去表层土,取距表层5~10 cm土壤100 g,装入已灭菌的牛皮纸袋中,于室温下自然风干3~10 d,碾碎过筛后,在50 ℃下烘1 h,取1 g土样加入10 mL灭过菌的0.005 mol/L磷酸缓冲液[pH值为7.0,其中含6.00%蛋白胨和0.05%十二烷基硫酸钠(SDS)]中,50 ℃下振荡10 min[18]。
1.1.2 試剂
ε-PL对照品购自郑州拜纳佛生物工程股份有限公司;酶及引物购自生工生物工程(上海)股份有限公司;DNA提取试剂盒购买自碧云天生物技术有限公司;其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.1.3 仪器
PCR仪(BIO-RAD),高压蒸汽灭菌锅(SANYO),电泳仪(BIO-RAD),SBA-40D生物传感分析仪(山东省科学院生物研究所),5 L发酵罐(Sartorius Stedim Biotech GmbH),高效液相色谱仪(岛津公司)等。
1.1.4 培养基及溶液
分离培养基(SG培养基):甘油1%,酵母膏0.01%,KH2PO4 0.025%,NaH2PO4·2H2O 0.088%,MgSO4·7H2O 0.025%,(NH4)2SO4 0.066%,ZnSO4·7H2O 0.005%,FeSO4·7H2O 0.001%,琼脂1.5%,pH值7.5。115 ℃,灭菌15 min。
链霉菌筛选(ISP2)培养基:酵母浸膏0.4%,麦芽浸膏1%,葡萄糖0.4%,琼脂1.5%,微量盐溶液1 mL,pH值7.2。115 ℃,灭菌15 min。
种子培养基及发酵培养基(M3G):葡萄糖5.000 0%,酵母粉0.500 0%,(NH4)2SO4 1.000 0%,K2HPO4·3H2O0.104 8%,KH2PO4 0.136 0%,10倍浓缩盐溶液(MgSO4·7H2O 0.0500%,FeSO4·7H2O 0.0030%,ZnSO4·7H2O0.004%)100 mL,pH值6.8。葡萄糖单独灭菌。
LB培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、琼脂2 g,用蒸馏水定容至1 000 mL。121 ℃,灭菌20 min。
微量盐溶液:FeSO4·7H2O 0.1 g,MnCl2·4H2O 0.1 g,ZnSO4·7H2O 0.1 g,加水定容至1 L。
复合抗生素抑菌剂:将10 mg放线菌酮、10 mg制霉菌素、20 mg萘啶酮酸钠分别平铺在三角瓶中,覆盖乙醚,使乙醚没过抗生素粉末,用培养基封口膜封口放入通风橱中待乙醚挥发干后,转至超净台上,加入定量无菌水,于45 ℃下水浴溶解后过0.2 μm滤膜。制霉菌素在pH值为7.2时溶解不完全,需用1 mol/L氢氧化钠溶液调pH值至11.0,完全溶解后用盐酸中和滴定,使pH值回复至7.2。
0.1 mol/L磷酸缓冲液:称取35.820 g Na2HPO4·12H2O,15.605 g NaH2PO4·2H2O,分别定容至1 L,相互滴定至pH值为6.6。
道夫根试剂(DR试剂):参照文献[19]配制。
1.2 方法
1.2.1 产ε-PL菌株初筛
1.2.1.1 ε-PL耐受菌株的筛选
首先对土样进行预处理,具体为大致去除土样中的杂物,风干后碾碎过筛,烘干。取1 g 预处理过的土样加入10 mL无菌水中,30 ℃、100 r/min振荡15 min后静置30 min,吸取上清液稀释适当倍数后涂布于含2 g/L ε-PL的LB分离培养基平板上。
1.2.1.2 复合抗生素抑菌剂平板筛选
据文献[20]报道,产ε-PL的菌种大多属于北里胞菌属、链霉菌属等,其中链霉菌属的菌种产量普遍较高。萘啶酮酸对细菌的抑制效果较好,制霉菌素能够抑制真菌,放线菌酮能够抑制霉菌和酵母等,因此添加抑制细菌、霉菌、酵母和真菌的抗生素于ISP2培养基平板上进行放线菌株的筛选。在已灭菌的ISP2平板中加入复合抗生素抑菌剂,倒板涂布,筛选产ε-PL的放線菌株。
1.2.1.3 透明圈筛选
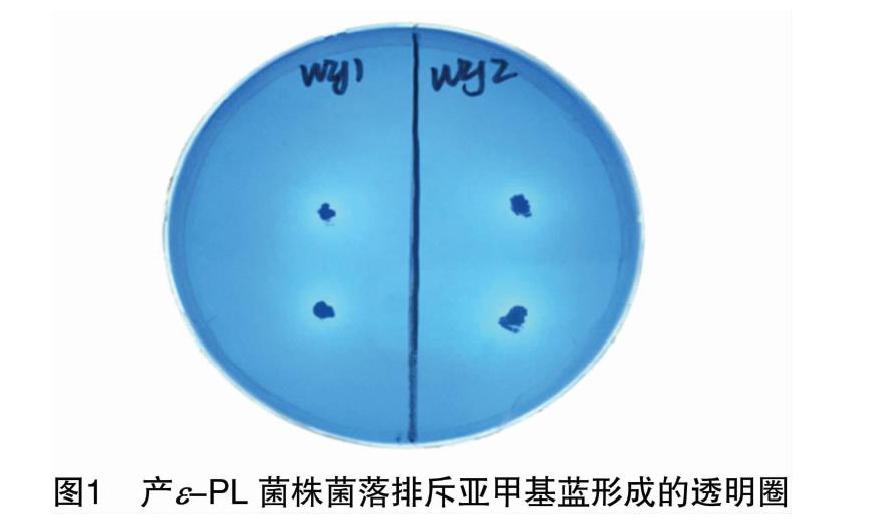
挑取ε-PL耐受平板和复合抗生素筛选平板上的菌落,接种至含0.003%亚甲基蓝的SG培养基平板上30 ℃培养7 d[8]。亚甲基蓝是一种碱性染料,菌落分泌的带正电荷的物质(ε-PL)会由于静电作用排斥亚甲基蓝,进而形成透明圈,且带正电荷物质的浓度越高,透明圈越大[21]。挑取有明显透明圈的单菌落进行保存,用于复筛。
1.2.2 复筛
将初筛得到的细菌接种至盛有30 mL LB液体培养基的250 mL摇瓶中,在30 ℃、200 r/min下发酵84 h;转接到盛有30 mL M3G培养基的250 mL摇瓶中,在30 ℃下发酵96 h,收集发酵液在7 000 r/min条件下离心10 min,用DR试剂检测发酵产物是否存在ε-PL。该反应很灵敏,可以有效检测出发酵液中的ε-PL[22]。
1.2.3 生理生化鉴定
参照《伯杰氏细菌鉴定手册》(第9版)、《放线菌分类基础》及《链霉菌鉴定手册》对复筛得到的菌株进行初步鉴定。
1.2.4 16S rDNA鉴定
取摇瓶培养7 d后的菌液,采用基因组提取试剂盒提取基因组DNA,并采用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1 492R:5′-GGTTACCTTGTTACGACTT-3′进行PCR扩增,引物由生工生物工程(上海)股份有限公司合成。将得到的16S rDNA序列与Gen Bank数据库中相关种属的序列进行比较,构建系统发育树。
1.2.5 高效液相色谱产量测定
高效液相色谱(HPLC)采用国标法(GB/T 5009.124)进行:C18柱,流动相为8%乙腈,流速为0.4 mL/min,检测波长为215 nm,进样体积 为20 μL,温度为40 ℃。
1.2.6 菌株生物量测定
采用干质量法测定菌株生物量(DCW)。每隔12 h取5 mL发酵液样品,在7 000 r/min转速下离心10 min,沉淀(即菌丝体)经蒸馏水洗涤3次后放入干燥清洁且已知质量的培养皿中,于60 ℃下烘干至恒质量,称质量得菌体干质量。重复测定3次,取平均值。
1.2.7 发酵产物的分子量分析
使用凝胶渗透色谱确定发酵液中ε-PL分子量大小。参考色谱条件:凝胶柱为TSK-gelG2000SWXL;检测温度为35 ℃,检测波长为210 nm,流速为1 mL/min,进样量为20 μL;流动相,乙腈 ∶水=20 ∶80(体积比),含三氟乙酸1 mL/L[15,23-24]。
1.2.8 最小抑制浓度的确定
以郑州拜纳佛生物工程股份有限公司生产的ε-PL为对照,从wzj5发酵液提取得到的ε-PL固体粉末作为试验样品,按0~250 μg/mL不同的9个浓度梯度添加到培养基中,将稀释了适当倍数的大肠杆菌BW25113菌液涂在平板上,验证ε-PL的抑菌效果。
2 结果与分析
2.1 产ε-PL菌株的初筛
2.1.1 ε-PL耐受菌株和产ε-PL菌株筛选
以往的研究经验表明,目标物的生产菌株通常对目标物具有一定的耐受性,依据这一特性,本研究尝试通过筛选ε-PL的耐受菌株来获得产ε-PL的菌株。将从ε-PL耐受平板上筛选出的菌落接种至含0.003%亚甲基蓝的SG平板上,筛选出wzj1、wzj2菌株。图1为通过该原理筛选出的2株在含亚甲基蓝的SG培养基上形成透明圈的菌株wzj1、wzj2,根据菌落长出的时间与其湿润、黏稠、易挑起的形态特征初步判断可能是细菌。
2.1.2 复合抗生素抑菌剂平板筛选
将从复合抗生素抑菌剂平板上筛选出的菌落接种至含0.003%亚甲基蓝的SG平板上,筛选出wzj3、wzj4、wzj5等3株透明圈较大的菌株(图2),其中wzj5菌株形成的透明圈明显大于其他2株菌株。从形态特征上看,这3株菌株不同于wzj1、wzj2菌株,其菌落干燥,质地紧密而不蔓延,不易挑起,初步判断可能是真菌或者放线菌。
2.2 产ε-PL菌株的复筛
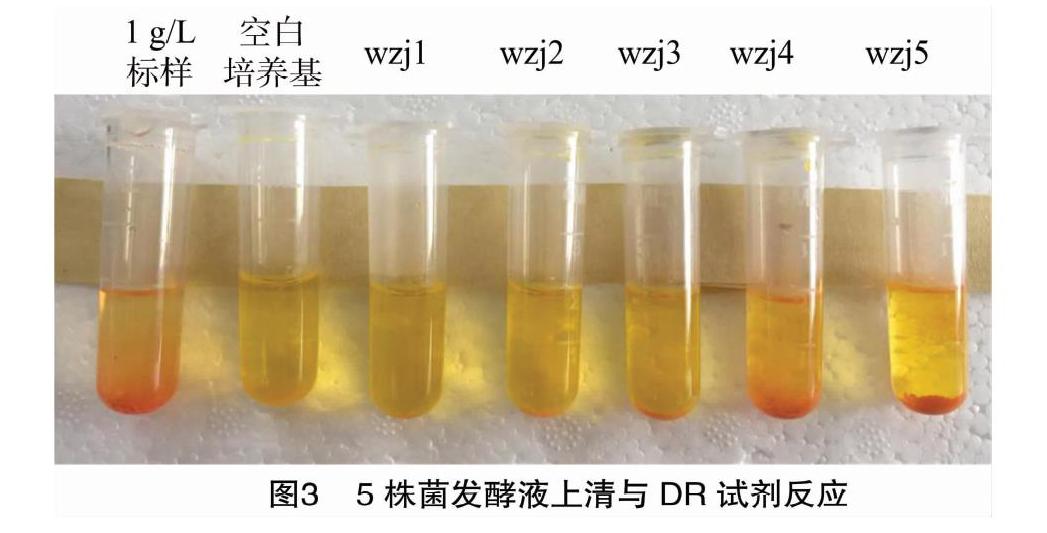
据文献报道,ε-PL在酸性(pH值为2~5)条件下能够与DR试剂发生特异性反应生成橘红色沉淀(BiI3)(ε-PL·HI)[25]。本试验结果(图3)表明,wzj1、wzj2、wzj3、wzj4、wzj5菌株的发酵液均能够与DR试剂发生反应生成橘红色沉淀。其中,wzj1、wzj2菌株的发酵液与DR试剂反应产生的沉淀偏少,而wzj3、wzj4、wzj5菌株的发酵液与DR试剂反应产生的沉淀较多。
2.3 ε-PL产生菌的鉴定
2.3.1 生理生化鉴定
传统微生物分类鉴定的主要依据是微生物的形态学特征、生理生化反应特征等,可初步判定其种属。5株菌株在LB固体培养基上的菌落形态见图4-a,它们在显微镜下的个体形态如图4-b所示,形态特征描述与生理生化试验结果见表1。根据试验结果推测,菌株wzj1、wzj2归属于芽孢杆菌属;wzj3、wzj4、wzj5归属于链霉菌属。
2.3.2 16S rDNA鉴定
从Gen Bank数据库中通过Blast查找与5株菌株相似的16S rDNA序列,并通过MEGA软件与菌株wzj1、wzj2、wzj3、wzj4、wzj5的16S rDNA序列进行比对,构建以16S rDNA全序列为基础的系统发育树。结果(图5)表明,菌株wzj1为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),wzj2为蜡样芽孢杆菌(Bacillus cereus),wzj3属于链霉菌(Streptomyces sp,未鑒定到种),wzj4为糖多孢菌(Saccharopolyspora sp),wzj5为白色链霉菌(Streptomyces albulus)。
2.4 ε-PL产量测定
2.4.1 摇瓶发酵
图6显示了5株菌株在摇瓶发酵过程中ε-PL浓度的变化,可以看出,wzj1、wzj2均在发酵42 h时达到其最高ε-PL产量,wzj1产量为0.06 g/L,wzj2产量为0.08 g/L,在发酵42 h后,ε-PL浓度缓慢递减;wzj3在摇瓶发酵108 h时,ε-PL浓度最高,为0.70 g/L;wzj4在发酵84~108 h时快速积累ε-PL,在108 h达到0.82 g/L;wzj5发酵产生的ε-PL含量明显高于其他4株菌株,且在摇瓶发酵96 h时ε-PL产量达到最大值,为1.56 g/L。
2.4.2 发酵罐发酵
选取摇瓶发酵中ε-PL产量较高的wzj4菌株和wzj5菌株进行发酵罐发酵。发酵调控采取2阶段法:第1阶段为菌体生长阶段,初始pH值为6.8;第2阶段为ε-PL合成阶段,pH值维持4.0不变。
图7-a是wzj4菌株发酵罐发酵过程的参数变化情况,可以看出,第1阶段(0~96 h)菌体浓度与条件呈负相关关系,菌体浓度大幅度增长,同时菌体吸收葡萄糖代谢产酸导致pH值不断下降。第2阶段(96~168 h),维持pH值为4.0。此时在酸性条件下菌体生长受到抑制,菌体浓度逐渐趋于稳定,胞内积累的ATP不再主要是用于菌体生长,而是被用于ε-PL 合成酶功能的发挥,有利于ε-PL的积累。从132 h开始,ε-PL产量增长速度变慢,在156 h时ε-PL产量达2.54 g/L。
图7-b给出了wzj5在发酵过程中各参数的变化趋势,其中0~60 h为菌体的生长阶段,在产ε-PL的第2阶段(60~168 h)中,在发酵96~120 h时ε-PL积累速率较高,并在发酵120 h时达到最大积累量6.99 g/L。
2.5 平均分子量大小的确定
参照韩岱等的ε-PL提取方法[26],对发酵液中的ε-PL进行提取。以郑州拜纳佛生物工程股份有限公司的ε-PL作为对照,对从wzj5菌株发酵液中提取的ε-PL样品进行凝胶渗透色谱比较分析。结果(图8)表明,对照在保留时间 为6.9 min 时有最大峰,且样品在此处也存在最大峰,因此确定发酵液中存在与对照分子量大小相近的ε-PL。
2.6 最小抑菌浓度
由图9可知,从wzj5发酵液中提取的ε-PL具备与对照品基本相近的抑菌能力,最小抑菌浓度为0.25 mg/mL。
3 结论与讨论
ε-PL是一种新型的天然高效生物防腐剂,其菌种选育一直受到研究者的广泛关注。本研究采用不同的方法筛选获得5株不同类型的产ε-PL菌株,其中2株芽孢杆菌分别是Bacillus amyloliquefaciens和Bacillus cereus,ε-PL产量分别是0.06 g/L和0.08 g/L。前期有文献报道,芽孢杆菌产ε-PL的摇瓶产量为0.036~0.083 g/L[5,27],且已有研究者对产ε-PL芽孢杆菌的发酵条件作了初步研究[28]。芽孢杆菌具有发酵周期短,易培养的优点,对于ε-PL生产来说,仍具有一定的开发潜力。此外,本研究还筛选到一株糖多孢菌属的菌株wzj4,其摇瓶最大产量为0.82 g/L,发酵罐发酵最大产量为2.54 g/L,该结果为本研究首次报道。
ε-PL产生菌主要集中在链霉菌属[5,29],包括灰橙链霉菌[30]、禾栗链霉菌[31]、稠李链霉菌[32]等。本研究筛选获得2株链霉菌属菌株,其中wzj3的摇瓶最大产量為0.70 g/L,wzj5的摇瓶最大产量为1.56 g/L,其发酵罐发酵最大产量为6.99 g/L,具有较好的产ε-PL潜力。菌株wzj5的ε-PL产量较高,因此提取其发酵液中ε-PL进行凝胶色谱分析,结果表明,ε-PL的分子量大小与郑州拜纳佛生物工程股份有限公司生产的ε-PL对照品一致,最小抑菌浓度为250 μg/mL。
ε-PL作为一种新型高效安全的天然防腐保鲜剂,具有广阔的应用前景,但与其他生物防腐剂相比,目前ε-PL的生产成本和市场价格仍然偏高,后期可采用分子生物学和发酵调控优化等手段,进一步提高ε-PL的产量和得率;另外,ε-PL是聚合度在25~30范围内的混合物,其提取与分离工艺比较复杂,仍有较大的技术提升空间。本研究聚焦在产聚赖氨酸菌株的筛选上,并在发酵、产物提取分离和产物性能检测方面进行了初步研究,可为后期进一步的菌株改良、发酵条件优化、提取工艺优化等研究奠定实践基础。
参考文献:
[1]Shima S,Sakai H. Poly-L-lysine produced by Streptomyces. Part Ⅲ. Chemical studies[J]. Agricultural & Biological Chemistry,1981,45(11):2503-2508.
[2]中华人民共和国国家卫生和计划生育委员会.关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告(2014年第5号)[J]. 中国食品添加剂,2014(3):213-221.
[3]黄 莉. ε-多聚赖氨酸高产菌的筛选、鉴定及发酵研究[D]. 成都:西华大学,2013.
[4]孙启星,陈旭升,任喜东,等. 基于pH调节和有机氮源流加调控补料分批发酵过程提高ε-聚赖氨酸产量[J]. 生物工程学报,2015,31(5):752-756.
[5]黄静敏,吴清平,刘盛荣,等. ε-聚赖氨酸产生菌新菌株的筛选和产物结构鉴定[J]. 微生物学通报,2011,38(6):871-877.
[6]刘延岭,邓 林. 发酵液中ε-聚L-赖氨酸提取工艺的研究[J]. 食品与发酵科技,2014,50(4):17-21.
[7]谭之磊. ε-聚赖氨酸及其复合材料的制备与抑菌活性研究[D]. 天津:天津大学,2014.
[8]Nishikawa M,Ogawa K. Distribution of microbes producing antimicrobial ε-poly-L-lysine polymers in soil microflora determined by a novel method[J]. Applied and Environmental Microbiology,2002,68(7):3575-3581.
[9]史应武,娄 恺,李 春. ε-聚赖氨酸的生物合成与降解及其应用研究进展[J]. 中国农业科学,2009,42(3):1009-1015.
[10]黄 莉,唐仁勇,张佳敏,等. ε-多聚赖氨酸产生菌的筛选及16S rDNA测序鉴定[J]. 食品工业科技,2013,34(17):163-167,172.
[11]张 波. 发酵法生产聚赖氨酸菌种选育研究[D]. 成都:西南交通大学,2014:1-72.
[12]曾 昕. 小白链霉菌同步代谢葡萄糖和甘油合成ε-聚赖氨酸的生理机制研究[D]. 无锡:江南大学,2016.
[13]王 静,谭之磊,毕德玺,等. 细菌基因组序列中ε-聚赖氨酸合成酶的生物信息学识别与分析[J]. 微生物学通报,2015,42(12):2495-2504.
[14]孙朱贞,冯小海,许召贤,等. 一株产ε-聚赖氨酸的白色链霉菌遗传转化体系[J]. 生物加工过程,2016,14(2):27-32.
[15]张 超,张东荣,贺 魏,等. 一种简便的ε-聚赖氨酸产生菌的筛选方法[J]. 山东大学学报(医学版),2006,44(11):1104-1107.
[16]任喜东. 小白链霉菌响应酸性pH高产ε-聚赖氨酸的生理解析[D]. 无锡:江南大学,2015.
[17]Kahar P,Iwata T,Hiraki J,et al. Enhancement of epsilon-polylysine production by Streptomyces albulus strain 410 using pH control[J]. Journal of Bioscience and Bioengineering,2001,91(2):190-194.
[18]朱宏陽,徐 虹,吴 群,等. ε-聚赖氨酸生产菌株的筛选和鉴定[J]. 微生物学通报,2005,32(5):127-130.
[19]李 树. ε-聚赖氨酸产生菌的筛选,育种及发酵研究[D]. 无锡:江南大学,2013.
[20]Chheda A H,Vernekar M R. Improved production of natural food preservative ε-poly-L-lysine using a novel producer Bacillus cereus[J]. Food Bioscience,2014,7:56-63.
[21]El-Sersy N A,Abdelwahab A E,Abouelkhiir S S,et al. Antibacterial and anticancer activity of ε-poly-L-lysine (ε-PL) produced by a marine Bacillus subtilis sp[J]. Journal of Basic Microbiology,2012,52(5):513-522.
[22]陈旭升. ε-聚赖氨酸高产菌株选育与发酵过程优化[D]. 无锡:江南大学,2008.
[23]孙湘婷,陈娇婷. ε-聚赖氨酸高产菌的新型筛选模型[J]. 食品工业科技,2013,34(2):202-203,209.
[24]张 超,张东荣,贺 魏,等. 一种简便的ε-聚赖氨酸产生菌的筛选方法[J]. 山东大学学报(医学版),2006,44(11):1104-1107.
[25]程传荣,田丰伟,张 灏,等. 一种快速测定发酵液中ε-聚赖氨酸的方法[J]. 食品与发酵工业,2009,35(11):133-136.
[26]韩 岱,陈旭升,甄 斌,等. 新型生物食品防腐剂ε-聚赖氨酸的提取[J]. 食品与发酵工业,2014,40(6):221-226.
[27]Shima S,Fukuhara Y,Sakai H. Inactivation of bacteriophages byε-poly-L-lysine produced by Streptomyces[J]. Agricultural and Biological Chemistry,1982,46(7):1917-1919.
[28]Shukla S C,Mishra A. ε-polylysine production from sugar cane molasses by a new isolates of Bacillus sp. and optimization of the fermentation condition[J]. Annals of Microbiology,2013,63(4):1513-1523.
[29]石 慧,李婵娟,张俊红. ε-聚赖氨酸产生菌及其应用研究概述[J]. 食品与发酵工业,2016,42(9):263-269.
[30]段 杉,朱伟珊. ε-聚赖氨酸产生菌的筛选[J]. 食品与发酵工业,2007,33(8):14-17.
[31]廖莉娟. ε-聚赖氨酸的菌种选育及合成过程强化[D]. 无锡:江南大学,2010.
[32]李 树,陈旭升,廖莉娟,等. ε-聚赖氨酸产生菌的筛选方法改进[J]. 食品与生物技术学报,2010,29(2):282-287.
