红花根际溶磷菌的筛选与培养条件优化
2019-11-28刘玉凤马丽娟张婷婷马磊
刘玉凤 马丽娟 张婷婷 马磊

摘要:土壤中的溶磷菌可增加难溶性磷酸盐的溶解性,提高植物对磷的吸收和利用。利用溶磷圈法,从红花根际土壤中,初步筛选出具有较高溶磷能力的菌株RC01,并对其培养条件进行优化。单因素试验结果表明,当葡萄糖为碳源、(NH4)2SO4为氮源,在30 ℃、0.3 g/L NaCl条件下,该菌的溶磷效果较好;正交试验结果表明,10 g/L葡萄糖、0.5 g/L (NH4)2SO4、30 ℃、0.35 g/L NaCl时,溶磷量最大。RC01经过16S rRNA測序鉴定为假单胞菌属(Pseudomonas),其良好的溶磷菌特性,可为促进红花生长的相关微生物研究奠定基础。
关键词:红花;根际;溶磷菌;分离;筛选;培养条件;优化
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2019)18-0287-04
收稿日期:2018-06-04
基金项目:国家自然科学基金(编号:31560310,31760302)。
作者简介:刘玉凤(1993—),女,新疆石河子人,硕士研究生,研究方向为生物信息学。E-mail:1029454784@qq.com。
通信作者:马 磊,博士,副教授,研究方向为生物信息学与分子遗传学,E-mail:malei1979@hotmail.com;张婷婷,硕士,讲师,研究方向为分子遗传学,E-mail:zting@shzu.edu.cn。
磷元素是植物生命活动所必需元素之一。植物吸收利用的磷元素主要源于土壤,而我国约有74%的耕地土壤缺磷,且土壤中95%的磷的存在形式难以被植物吸收[1]。然而,土壤中溶磷菌可将难溶性磷酸盐转化为植物可吸收磷酸盐,提高植物对磷肥的利用率,增加农作物的产量,减少土壤对磷酸盐的吸附性,避免过施磷肥环境污染[2]。溶磷菌广泛分布在根际、土壤及种子表面[3]。分离和利用土壤溶磷微生物,促进植物吸收磷元素,已成为生物肥料研究领域的热点之一,对于农业的可持续发展具有重大的意义。
红花(Carthamus tinctorius L.)是一种集药材、油料、燃料、饲料为一体的特种经济作物[4],在农业生产中具有重要的意义。目前,国内外有关植物根际溶磷菌的研究较多,已涉及玉米[5]、春小麦、苜蓿[6]、大豆[7]等多种植物,但关于红花根际溶磷菌的研究报道较少[8]。本试验从红花根际筛选出了溶磷菌株,并对其溶磷能力进行研究,为研发促进红花生长的生物菌肥的研究奠定了理论基础。
1 材料与方法
1.1 样品采集
供试土壤采自石河子大学实验场,在红花开花期选择无病虫害、长势良好的植株,根际土壤采集采取“抖根法”[9]进行,记录采集时间、地点、土壤性质和类型,各样品按常规方法分别混合后装入灭菌信封袋,带回实验室置于4 ℃的冰箱内保存备用。
1.2 培养基
实验用培养基为蒙金娜无机磷液体培养基、固体培养基和PDA培养基。
蒙金娜无机磷液体培养基(每1 000 mL):葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O0.03 g,MnSO4·4H2O 0.03 g,MgSO4·7H2O 0.3 g,磷矿粉10 g,酵母膏0.4 g,蒸馏水1 000 mL,pH值7.0~7.5。
蒙金娜无机磷固体培养基:在蒙金娜无机磷液体培养基的基础上加入1.5%~2.0%的琼脂制成蒙金娜无机磷固体培养基。
PDA培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL。
将马铃薯洗净去皮,切成小块后称取200 g,加水煮烂(煮沸20~30 min,能被玻璃棒戳破即可),然后用纱布过滤,将马铃薯汁滤出待用。如需制成固体培养基,可向其中加入1.5%~2.0%的琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖,搅拌均匀,稍冷却后,再补足水分至1 000 mL,分装试管或者锥形瓶,密封,高压灭菌(121 ℃、101 kPa),20 min后保藏待用。
1.3 溶磷菌的分离与纯化
溶磷菌的培养与收集:称取10 g根际土壤置于盛有90 mL 无菌水的三角瓶中,振荡15 min(160 r/min)使土样均匀分散在无菌水中成为土壤悬液,用加样器吸取1 mL土壤悬液至盛有9 mL无菌水中的试管中,吹吸3次使之充分混匀,依次配备浓度为10-3、10-4、10-5、10-6,再从10-3、10-4、10-5、10-6稀释液中取0.1 mL溶液,均匀涂布于蒙金娜无机磷固体培养基平板上。每个浓度重复3组,于20~30 min后倒置,并放于28 ℃的恒温箱中培养。
溶磷菌株初选:观察溶磷圈,将蒙金娜无机磷固体培养基制成平板、分区,每区点植1个菌株,28 ℃培养7 d,观察有无溶磷圈生成,测定溶磷圈直径(D,cm)、菌落直径(d,cm),根据能否产生溶磷圈初步判断菌株有无溶磷能力,根据D/d大小初步确定菌株的溶磷能力的大小。
摇瓶复选及定量测定:于150 mL三角瓶中盛入蒙金娜无机磷液体培养基50 mL,高压灭菌20 min(121 ℃、101 kPa)备用。分别接种每株溶磷菌的孢子悬液1 mL于灭菌的液体培养基中,以不接菌为对照,每个处理3次重复,摇床培养(30 ℃、160 r/min)7 d,4 ℃条件下离心,取适量的上清液,采用钼锑抗比色法测定其磷含量[10],并用酸度计测定其pH值。
1.4 培养条件的优化
采用单因素试验,分别改变培养基中碳源种类、氮源种类、温度、NaCl浓度,测量培养液中磷的含量,以确定较适宜的培养基组成。
碳源的筛选:选取溶磷效果最好的菌株进行碳源筛选试验。分别采用10 g/L葡萄糖、蔗糖、可溶性淀粉、麦芽糖取代蒙金娜无机磷液体培养基的碳源,其余培养条件不变,通过试验比较得出较适宜的碳源。
氮源的筛选:分别选取0.5 g/L(NH4)2SO4、KNO3、NH4NO3、尿素取代蒙金娜无机磷液体培养基的氮源,碳源采用已试验得出的较适宜的碳源,其余培养条件不变,得出较适宜的氮源。
温度的选择:在PDA液体培养基中将待测菌株活化24 h后,按照1%的接种量接种于蒙金娜无机磷液体培养基中,于各温度梯度(20、25、30、35、40 ℃)、160 r/min的条件下培养7 d,测定培养液中磷的含量,得出最适培养温度。
NaCl浓度的选择:于150 mL三角瓶中分别盛入按不同NaCl浓度(0.1、0.2、0.3、0.4、0.5 g/L)配置的蒙金娜无机磷液体培养基各50 mL并接入菌株,其他培养条件不变,得出较适宜的NaCl浓度。
1.5 正交试验
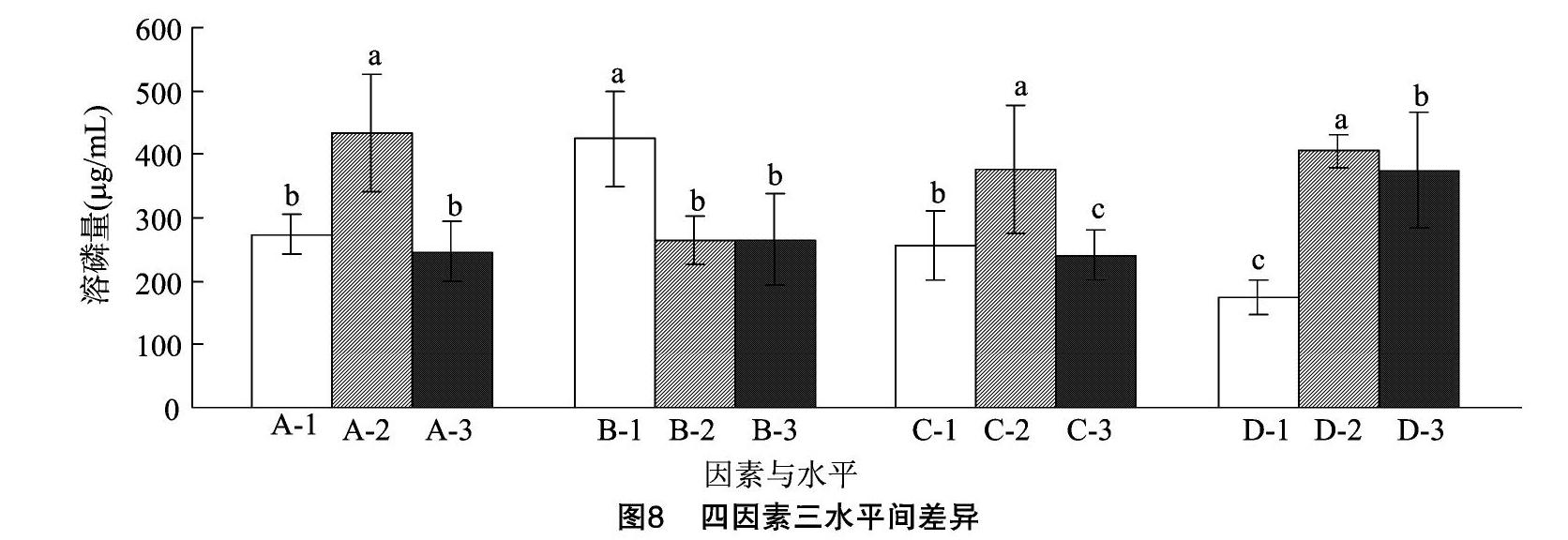
确定菌株生长的最适培养条件为碳源为葡萄糖,氮源为(NH4)2SO4后,以葡萄糖的浓度、(NH4)2SO4的浓度、温度、NaCl浓度为4个变化因素,每个因素取3个水平,采用L9(34)正交表2进行四因素三水平试验,供试因素及水平见表1,每组处理2个重复。在PDA液体培养基中将待测菌株活化24 h后,按照1%的接种量接种于各培养基中,于各温度、160 r/min的条件下培养7 d,测定培养液中磷的含量。
提取菌体DNA,采用16S rRNA(16S ribosomal RNA)通用引物8F(5′-AGAGTTTGATCCTGGCTCAG-3′),1 492R(5′-CGGTTACCTTGTTACGACTT-3′)对细菌进行PCR扩增。扩增程序:94 ℃变性5 min;然后94 ℃变性30 s、55 ℃退火30 s,72 ℃延伸1 min 30 s,35个循环;最后72 ℃延伸10 min,4 ℃保存。PCR产物送至上海生工生物技术有限公司进行16S rRNA测序,对测得序列在NCBI进行在线比对,下载相似性最高的已知菌序列,用Clustal X软件包程序对序列进行序列比对,再通过MEGA 5.05软件对所有序列构建系统发育树进行遗传鉴定。
2 结果与分析
2.1 菌株筛选
从蒙金娜无机磷固体培养基中筛选出3株菌,将其命名为RC01(菌落直径d=0.3 cm、溶磷圈直径D=0.4 cm)、45-3(d=0.2 cm、D=0.25 cm)、45-4(d=0.1 cm、D=0.13 cm),将具有溶磷能力的菌种RC01、45-3、45-4挑出,进行多次传代培养和纯化,淘汰掉失去溶磷能力的菌株45-4和溶磷能力比较差的菌株45-3,保存溶磷能力较强的的菌种RC01。RC01菌株在培养基上的溶磷圈如图1所示,菌株周围出现明显的透明圈,菌株呈淡黄色。
2.2 定量测定溶磷菌RC01的溶磷能力
以空白试验溶液为参照,用钼锑抗比色法定量测定溶磷菌RC01在720 nm波长的标准溶液吸光度,绘制磷标准曲线(图2)
在蒙金娜无机磷液体培养基中接种供试菌株RC01,24 h后开始测定菌液中的可溶性磷含量及菌液的pH值,然后每隔24 h测1次,其结果如图3所示。
由图3可知,随着接种时间的延长,菌株的溶磷量不断增加,120 h时菌株的溶磷量达到最大值,随后溶磷量开始下降,培养液的pH值随接种时间先不断降低,在120 h时pH值最低,随后逐渐回升至中性,结合溶磷菌的溶磷机制分析出现这一现象的原因,可能是溶磷菌RC01在生长过程中分泌了有机酸,酸性物质促进难溶性的磷矿粉释放出磷离子,在120 h 时溶磷量达到最大值(514.37 μg/mL),pH值达到最小值(5.2),说明溶磷菌RC01在培养120 h时的溶磷效果最好。
2.3 对溶磷菌RC01培养条件的优化试验
2.3.1 单因素试验
2.3.1.1 碳源的筛选
分别选取葡萄糖、蔗糖、可溶性淀粉、麦芽糖作为碳源对溶磷菌RC01进行培养条件优化试验,不同碳源对溶磷菌RC01的影响如图4所示。
由圖4可知,不同碳源对溶磷菌RC01溶磷量的影响由大到小为葡萄糖>蔗糖>可溶性淀粉>麦芽糖。碳源由葡萄糖提供时,溶磷菌RC01的溶磷量达到最大(501.32 μg/mL);碳源由麦芽糖提供时,溶磷量最小(51.73 μg/mL)。这个结果说明溶磷菌RC01对葡萄糖的利用率最大,其次依次是蔗糖、可溶性淀粉、麦芽糖,其中对麦芽糖的利用率最低。
2.3.1.2 氮源的筛选
分别选取(NH4)2SO4、KNO3、NH4NO3、尿素作为氮源对溶磷菌RC01进行培养条件优化实验,不同氮源对溶磷菌RC01的影响如图5所示。
由图5可知,不同氮源对溶磷菌RC01的溶磷量的影响由大到小为(NH4)2SO4>尿素>KNO3>NH4NO3,氮源由(NH4)2SO4提供时,溶磷菌RC01的溶磷量达到最大(475.36 μg/mL),氮源由NH4NO3提供时,溶磷量最小(93.80 μg/mL),说明溶磷菌RC01对(NH4)2SO4的利用率最大,其次依次是尿素、KNO3、NH4NO3,其中对NH4NO3的利用率最低。
2.3.1.3 温度的选择
在不同的温度(20、25、30、35、40 ℃)条件下,对溶磷菌RC01进行温度筛选试验,不同温度对溶磷菌RC01溶磷效果的影响如图6所示。
由图6可知,随着温度的增高,溶磷菌RC01的溶磷量先是不断升高,当温度为30 ℃时,溶磷菌RC01的溶磷量最大,随后溶磷量不断降低。
