甘薯抗病相关基因TAO1-like的TRAP分析
2019-11-12王崇王连军雷剑苏文瑾柴沙沙杨新笋张文英
王崇 王连军 雷剑 苏文瑾 柴沙沙 杨新笋 张文英

摘要:NBS-LRR是植物中已分离抗病基因最大的一类,Target of AvrB Operation(TAO1)属于NBS-LRR类基因。以甘薯[Ipomoea batatas(L.) Lam.]抗病相关的TAO1基因作为靶标基因,设计出1条固定引物,与11条随机引物组合成11对引物。利用这11对引物对甘薯品种鄂薯11、鄂紫薯13进行TRAP-PCR扩增,发现11个引物组合扩增出清晰条带,且表现出良好的多态性。该研究获得与TAO1-like基因相关联的TRAP标记,该标记可进行甘薯群体的遗传多样性分析,为甘薯的抗病育种奠定基础。
关键词:甘薯[Ipomoea batatas(L.) Lam.];抗病;NBS-LRR类基因;TAO1;TRAP标记
中图分类号:S531;Q78 文献标识码:A
文章编号:0439-8114(2019)18-0152-04
DOI:10.14088/j.cnki.issn0439-8114.2019.18.037 开放科学(资源服务)标识码(OSID):
TRAP analysis of disease resistance related gene TAO1-like in sweet potato
WANG Chong1,2,WANG Lian-jun2,LEI Jian2,SU Wen-jin2,CHAI Sha-sha2,YANG Xin-sun2,ZHANG Wen-ying1
(1.College of Agriculture, Yangtze University,Jingzhou 434025,Hubei,China;2.Hubei Academy of Agricultural Sciences,Institute of Food Corps/Hubei Sweet Potato Engineering and Technology Research Centre/Hubei Key Laboratory of Food Crops Germplasm and Genetic Improvement,Wuhan 430064,China)
Abstract: NBS-LRR is the largest class of isolated disease resistance genes in plants, Target of AvrB Operation(TAO1)belongs to NBS-LRR class genes. Using sweet potato disease resistance genes NBS-LRR as target gene to design one fixed primer,and for paring 11 pairs primers with 11 arbitrary primers. The 11 pairs of primers were used for TRAP-PCR amplification of sweet potato cultivars Eshu 11 and Ezishu 13. It was found that 11 primer combinations amplified clear bands and showed good polymorphism. The TRAP marker that associated with the TAO1-like gene were obtained, which could be used to analyze the genetic diversity of sweet potato population and provide a theoretical basis for disease resistance breeding of sweet potato.
Key words: sweet potato [Ipomoea batatas(L.) Lam.]; disease resistance; NBS-LRR gene; TAO1; TRAP marker
甘薯[Ipomoea batatas(L.) Lam.]是世界上重要的粮食、饲料、工业原料及新型能源用块根作物。中国是世界上最大的甘薯生产国,常年种植面积550万hm2,鲜薯产量1.2亿t,分别占世界甘薯种植总面积和总产量的60%和85%[1]。甘薯在遗传上高度杂合,种内、种间杂交不亲和以及遗传资源匮乏,遗传基础狭窄,病虫害、病毒病危害严重,制约了甘薯品种的遗传改良[2]。
很多甘薯近缘野生种具有抗病虫、抗逆等优良基因[3]。抗病基因同源序列(Resistance gene analog,RGA)是一种存在植物基因组中具有特定保守结构域的DNA区段,RGA还具有容易获得、扩增结果稳定和使用费用低廉等优点。因此以RGA区段的保守性为基础设计PCR特异兼并引物,扩增R基因同源序列,进行抗病基因的分离和克隆,已经成为当前比较流行的克隆植物抗病基因的策略之一[4]。NBS-LRR类基因根据表达出的蛋白质N端的不同,可以分为4类:TIR-NBS-LRR、LZ-NBS-LRR、CC-NBS-LRR和NBS-LRR等[5]。TAO1属于TIR-NBS-LRR类,主要功能是参与植物的防御反应[6]。目前在甘薯[7]、水稻[8]、小麦[9]、苹果[10]、棉花[11]等植物中已成功分离克隆出NBS-LRR类抗病基因同源序列。
TRAP技术[12]是由SRAP技术[13]发展而来,是一种基于已知的cDNA或EST序列信息的分子標记,固定引物长度为16~20 bp,随机引物长度18 bp,具有简单、高效、重复性好、效率高等优点,已在水稻[14]、小麦[15]、烟草[16]、棉花[17]等多种作物中得到了广泛应用。本研究基于植物NBS-LRR类抗病基因的保守区域,采用TRAP标记技术,旨在评价分析TRAP标记技术在甘薯研究中的利用价值,发掘出能有效与NBS-LRR类基因紧密连锁的TRAP标记,为筛选甘薯抗病品种提供一定的理论依据,为甘薯抗病性遗传改良奠定基础。
1 材料与方法
1.1 材料
供试材料为高抗蔓割病、抗根腐病、抗茎线虫病,感黑斑病的甘薯品种鄂薯11;感蔓割病、高感根腐病、中抗茎线虫病、高感黑斑病的甘薯品种鄂紫薯13,种植于湖北省农业科学院粮食作物研究所试验基地。
1.2 引物设计
利用Premier 5软件设计引物。根据NCBI登录号搜索到NBS-LRR类抗病基因序列,以TAO1-like基因为靶标基因设计1条固定引物,固定引物大小为18 bp,退火温度在50 ℃最为适宜,参考引用Li等[18]已发表的11条随机引物(表1),均委托天一辉远生物科技有限公司(武汉)合成。
1.3 DNA的提取
采取鄂薯11、鄂紫薯13的新鲜幼嫩叶片,采用改良CTAB法[19]提取甘薯总DNA。将DNA稀释到PCR反应所需的浓度(50~60 ng/μL),在-20 ℃保存,备用。
1.4 PCR扩增
使用S1000TM Thermal Cycler(BioRad)PCR扩增仪进行扩增,反应体系为:10×Buffer(Mg2+) 5.0 μL,dNTPs(10 mmol/L each)4.0 μL,固定引物1.0 μL,随机引物1.0 μL,基因组 DNA(50~60 ng/μL)1.0 μL,Easy-Taq DNA Polymerase 1.0 μL,ddH2O补至50 μL;TRAP反应的PCR扩增程序为94 ℃预变性4 min;94 ℃变性45 s,35 ℃退火45 s,72 ℃延伸1 min,5个循环;然后94 ℃变性1 min,52 ℃退火1 min,72 ℃ 延伸1 min,35个循环;72 ℃延伸7 min,冷却至10 ℃。PCR扩增产物在0.5%非变性聚丙烯酰胺凝胶(PAGE)上电泳,105 V电泳4 h后银染,通过凝胶成像系统观察并拍照。
2 结果与分析
2.1 TRAP标记多态性分析
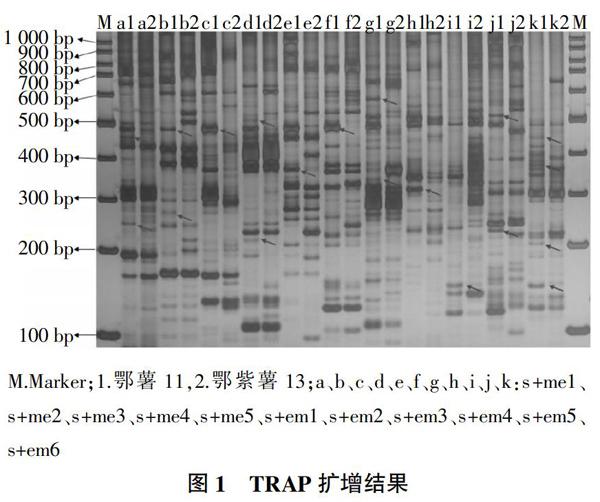
利用11对引物对2个试验材料进行TRAP标记分析,11对引物的扩增条带大小在100~800 bp,每对引物组合可产生8~17条清晰、稳定条带,且不同TRAP引物扩增带型、扩增数量和分布均匀程度具有较大差异(图1)。每个组合都扩增出多态性条带,每个组合扩增的多态性条带为5~12条,表明设计的引物具有良好的多态性,可用于进一步的分析研究。
2.2 TAO1-like的TRAP分析
对11对引物组合的多态性条带分析,多态性条带主要集中在200~500 bp。鄂薯11与鄂紫薯13的抗病性存在差异,发现某些扩增条带在鄂薯11中出现,而在鄂紫薯13中没有出现。如图1箭头所指,引物对s+em6在鄂薯11中扩增出4条特异性条带,在鄂紫薯13中不存在。在这些多态性条带中,可能存在NBS-LRR基因的特异扩增条带,这些片段可能与TAO1基因紧密相关。
3 讨论
同源序列克隆法具有过程相对简单、适用对象广泛等优点。采用同源序列克隆法在水稻、甘蔗、结球甘蓝、柚等多种植物上获得了抗病基因同源序列,显示了广泛的应用前景[20,21]。这些RGA有的定位在某些抗病基因附近,为分子标记辅助育种提供了可能。抗病基因同源序列在抗病基因的发掘中起着重要作用,也被广泛用于NBS-LRR类基因的发掘。陈观水等[22]利用同源序列克隆技术,在甘薯栽培品种青农2号中发现P-loop、Kinase-2、Kinase-3a、GLPL等4个与甘薯抗病相关的基因。屈满义等[23]对甘薯高抗茎线虫品种AB94078-1和感病品种徐18进行研究,发现与抗线虫病相关联的基因序列。Wang等[24]以甘薯品种Jewel为试验材料,在NBS-LRR类基因中发现与白细胞介素1受体相关的基因。目前, NBS profiling标记技术[26]也被广泛采用来寻找NBS-LRR类抗病基因。Calenge等[27]通过对产生的43个标记测序,发现25个与苹果抗疮病和霉病的重要基因相近的位点。Sayar等[28]利用NBS profiling技术将土耳其冬小麦栽培品种和哈萨克斯坦冬小麦栽培品种以及欧洲冬小麦栽培品种区分开来。
TRAP技术的固定引物是基于EST序列设计的,是表达基因的一部分,通过TRAP技术,能过开发出与表型或目标基因连锁的分子标记,被有效应用于特定基因定位。Miklas等[29]通過设计大豆的TRAP固定引物,在106个TRAP标记中有17个定位了与R基因相邻的基因,2个调节灰茎枯萎病抗性,1个具有大豆花叶病毒抗性和共同的细菌抗性,证明TRAP标记具有标记抗病性基因的潜力。任民等[30]直接利用EST序列设计TRAP引物,在普通烟草品种中发现1个TRAP标记特征带,通过克隆、测序和序列对比,推测该序列可能是一个未知的烟草高香气基因。Chen等[31]结合SSR和TRAP标记,通过构建F2群体,在向日葵中定位了与雄性核不育相关的基因。Saleh等[32]通过构建小麦Yecora Rojo和Pavon 76的F4群体,发现3个与叶绿素含量性状相关联的标记,4个与叶片衰老相关联的标记和3个与叶片细胞膜稳定性相关联的标记,表明TRAP标记可以用于小麦的抗干旱育种。Chen等[33]结合SSR、SRAP和TRAP标记,发现了3个与小麦抗条锈病相关联的标记,证实YrSph可能是一个新型的小麦抗条锈病基因。
本研究利用TRAP技术对鄂薯11和鄂紫薯13进行检测,发现某些条带在鄂薯11中出现,而在鄂紫薯13中无法检测到,这些条带可能与甘薯抗病基因有着紧密联系,表明TRAP标记可能在甘薯的抗病育种中有着应用价值。
参考文献:
[1] 王红意,翟 红,王玉萍,等.30个中国甘薯主栽品种的RAPD指纹图谱构建及遗传变异分析[J].分子植物育种,2009,7(5):879-884.
[2] 李 强,刘庆昌,马代夫.甘薯近缘野生种研究利用现状及展望[J].分子植物育种,2006,4(6):105-110.
[3] 曹清河,张 安,李 鹏,等.甘薯近缘野生种的抗病性鉴定与新型种间杂种的获得[J].植物遗传资源学报,2009,10(2),224-229.
[4] 阙友雄, 许莉萍,林剑伟,等.甘蔗NBS-LRR类抗病基因同源序列的分离与鉴定[J].作物学报,2009,35(4):631-639.
[5] 张盈玉,马荣才.参与植物防御反应的LRR型蛋白結构与功能[J].中国农业科技导报,2009(3):12-18.
[6] EiTAS T K,NIMCHUK Z L,DANGL J L. Arabidopsis TAO1 is a TIR-NB-LRR protein that contributes to disease resistance induced by the Pseudomonas syringae effector AvrB[J].Proceedings of the national academy of sciences,2008,105(17):6475-6480.
[7] 林巧玲,曾会才.甘薯中NBS-LRR类抗病基因同源序列的克隆及序列分析[J].西北农业学报,2007,16(2):65-69.
[8] 刘 浩,陈志强,王加峰.水稻NBS-LRR类抗稻瘟病基因研究进展[J].江苏农业学报,2014,30(3):664-670.
[9] 任晓娣,刘彦慧,李建嫄,等.小麦NBS-LRR类抗病基因同源cDNA序列的克隆与表达分析[J].河北农业大学学报,2013,36(2):69-74.
[10] 宋 霄,柏素花,戴洪义.苹果NBS-LRR1基因的鉴定与表达分析[J].园艺学报,2013,40(7):1233-1243.
[11] 简桂良,赵 磊,张文蔚,等.黄萎病不同抗性陆地棉品种抗病基因同源序列生物信息学分析[J].棉花学报,2015,23(6):490-499.
[12] HU J,VICK B A. Target region amplification polymorphism:A novel marker technique for plant genotyping[J].Plant molecular breeding reporter,2003,21(3):289-294.
[13] SUN S J,GAO W,LIN S Q,et al. Analysis of genetic diversity in Ganoderma population with a novel molecular marker SRAP[J].Applied microbiology and biotechnology,2006,72(3):537-543.
[14] 马忠友,苏京平,孙林静,等.微型反向重复转座元件(MITE)靶区域扩增多态性:一种基于MITE的分子标记方法在水稻及其他植物上的应用[J].中国水稻科学,2007,21(5):459-463.
[15] FENG J Y,CHEN G Y,WEI Y M,et al. Identification and genetic mapping of a recessive for resistance to stripe rust in wheat line LM168-1[J].Molecular breeding,2014,33(3):601-609.
[16] 冯俊彦,蒲志刚,李 明,等.9份烟草品种(系)及其航天诱变后代的TRAP分析[J].西南农业学报,2017,30(2):273-279.
[17] BLENDA A,FANG D D,RAMI J F,et al. A high density consensus genetic map of tetraploid cotton that integrates multiple component maps through molecular marker redundancy check[J].PLoS one,2012,7(9):e45739.
[18] LI G,QUIROS C F. Sequence related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:Its application to mapping and gene tagging in Brassica[J].Theoretical and applied genetics,2001,103:455-461.
[19] 张世安,邢智峰,刘永英,等,苔藓植物DNA不同提取方法的比较分析[J].河南科学,2009,27(5):559-562.
[20] 郑先武,翟文学,李晓兵,等.水稻NBS-LRR类R基因同源序列[J].中国科学,2001,31(1):43-51.
[21] 曹必好,雷建军,夏 勇,等.结球甘蓝NBS-LRR类R基因同源序列的分离[J].中国农业科学,2004,37(7):1081-1084.
[22] 陈观水,周以飞,林 生,等.甘薯 NBS 类抗病基因类似物的分离与序列分析[J].热带亚热带植物学报,2006,14(5):359-365.
[23] 屈满义,查向东,王 钰,等.甘薯NBS-LRR类抗病基因同源序列的克隆、分析及数目研究[J].热带作物学报,2008,29(5): 610-617.
[24] WANG Y,ROSEN B,SCOFFIELD J,et al. Isolation and analysis of resistance gene homologues in sweetpotato[J].Plant breeding,2010,129(5):519-525.
[25] 黄代青,王 平,吕柳新. 柚cDNA中NBS-LRR类R基因同源序列的分离[J].中国农业科学,2004,37(10):1580-1584.
[26] MEYERS B C,DICKERMAN A W,MICHELMORE R W,et al. Plant disease resistance genes encode members of an ancient and diverse protein family within the nucleotide-binding superfamily[J].The plant journal,1999,20(3):317-332.
[27] CALENGE F,VAN DER LINDEN C G,VAN DE WEG E,et al. Resistance gene analogues identified through the NBS-profiling method map close to major genes and QTL for disease resistance in apple[J].Theoretical and applied genetics,2005,110(4):660-668.
[28] SAYAR T M,DREISIGACKER S,BRAUN H J,et al. Genetic variation within and between winter wheat genotypes from Turkey,Kazakhstan,and Europe as determined by nucleotide-binding-site profiling[J].Genome,2011,54(5):419-430.
[29] MIKLAS P N,HU J,GR?譈NWALD N J,et al. Potential application of TRAP(targeted region amplified polymorphism) markers for mapping and tagging disease resistance traits in common bean[J].Crop science,2006,46(2):910-916.
[30] 任 民,王志德,賈兴华,等.开发TRAP标记的新策略[J].中国烟草科学,2009,30(增刊):25-31.
[31] CHEN J,HU J,VICK B A,et al. Molecular mapping of a nuclear male-sterility gene in sunflower(Helianthus annuus L.) using TRAP and SSR markers[J].Theoretical and applied genetics,2006,113(1):122-127.
[32] SALEH M S,AL-DOSS A A,ELSHAFEI A A,et al. Identification of new TRAP markers linked to chlorophyll content, leaf senescence,and cell membrane stability in water-stressed wheat[J].Biologia plantarum,2014,58(1):64-70.
[33] CHEN S S,CHEN G Y,CHEN H,et al. Mapping stripe rust resistance gene YrSph derived from Tritium sphaerococcum Perc. with SSR,SRAP,and TRAP markers[J].Euphytica,2012, 185(1):19-26.
