艾草水提取物对大肠杆菌的抑制机理初步研究
2019-11-12张赟张涛罗婷唐红枫
张赟 张涛 罗婷 唐红枫
摘要:以革兰氏阴性菌大肠杆菌(Escherichia coli)作为试验菌,通过测定艾草(Artemisia argyi Lévl. et Van.)水提物与大肠杆菌作用前后细菌培养液的电导率、总糖和总蛋白的变化,阐明艾草水提物对大肠杆菌的抑菌机理。结果表明,艾草水提物(3 g/mL)对大肠杆菌有较强的抑菌作用,其最低抑制浓度(MIC)为浓缩液的32倍稀释物。经艾草水提物处理后,大肠杆菌培养液电导率、总糖浓度、蛋白质浓度均增大,表明艾草水提物可破坏大肠杆菌细胞膜,导致细胞内容物流出,对培养液中相关生理生化指标造成影响。
关键词:艾草(Artemisia argyi Lévl. et Van.)水提物;大肠杆菌(Escherichia coli);电导率;抑菌机理
中图分类号:R285 文献标识码:A
文章编号:0439-8114(2019)18-0045-04
DOI:10.14088/j.cnki.issn0439-8114.2019.18.011 开放科学(资源服务)标识码(OSID):
Preliminary study on antimicrobial mechanism of Artemisia argyi
aqueous extract on Escherichia coli
ZHANG Yuna,ZHANG Taoa,LUO Tinga,TANG Hong-fenga,b
(a.College of Life Science and Chemistry;b.The Key Laboratory of Applied Biotechnology,Wuhan Donghu University,Wuhan 430212,China)
Abstract: Using Escherichia coli as test bacteria, change of Escherichia coli culture fluid conductivity, total sugar and soluble protein were determined in aqueous extract of Artemisia argyi. The results showed that Artemisia argyi aqueous extract (3 g/mL) had stronger inhibitory effect on Escherichia coli. The minimal inhibitory concentration (MIC) was 32 times the dilution of the Artemisia argyi aqueous extract (3 g/mL). Under Artemisia argyi aqueous extract, Escherichia coli culture solution conductivity increased, the total sugar concentration and protein concentration increased. These results showed that the Artemisia argyi aqueous extract can damage the cell membrane of Escherichia coli, caused the cells to flow out. Therefore, the related physiological and biochemical indexes in the culture medium were affected.
Key words: Artemisia argyi aqueous extract; Escherichia coli; conductivity; antimicrobial mechanism
艾草(Artemisia argyi Lévl. et Van.),别名萧茅、冰台、艾绒等,多年生草本或略成半灌木状,植株有浓烈香气。茎褐色或灰黄褐色,基部稍木质化,上部草质,并有少数短的分枝,叶厚纸质,上面被灰白色短柔毛,基部通常无假托叶或极小的假托叶;上部叶与苞片叶羽状半裂、头状花序椭圆形;花冠管状或高脚杯状,外面有腺点,花药狭线形,花柱与花冠近等长或略长于花冠;瘦果长卵形或长圆形,全草入药。药理研究表明,艾草有平喘止咳、止血凝血、抵抗病菌等作用[1,2]。中医理论认为艾叶具有理气,散寒,温经,止血等功效。艾草提取物已經被现代医学的药理研究证明其抗菌谱较宽,能够有效抑制甚至杀死很多细菌和病毒,能在一定程度上抵御呼吸系统疾病的发生[3,4]。艾草强大的杀菌能力来源于茎叶中含有丰富的挥发油等物质,其能强烈抑制大肠杆菌、白色念珠菌、绿脓杆菌、金黄色葡萄球菌等的生长繁殖[5-7]。
艾草作为绿色、纯天然、可食用的野生中草药,在中国分布广泛,开发其营养、药用和商用价值的前景十分广阔。本试验采用水提法提取艾草茎叶部分中具有抑菌杀菌的成分,对艾草水提物的抑菌机理进行研究,以对其十分敏感的大肠杆菌作为研究对象,为艾草的进一步开发利用提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料 艾草采自武汉东湖学院中草药试验大棚。试验菌种为大肠杆菌(Escherichia coli),由武汉大学生命科学学院微生物实验室提供。本试验所用试剂均为分析纯。
1.1.2 培养基 LB培养基(固体培养基加琼脂粉15~20 g):胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、去离子水1 000 mL、pH 7.0,121 ℃高压蒸气灭菌30 min,备用。
1.2 方法
1.2.1 原料预处理 采摘新鲜的艾草,要求艾草未开花、长势良好,未喷洒农药等,去除艾草的根、枯叶等杂质,将其置于鼓风干燥箱中60 ℃烘烤直至干燥(约48 h)。将干燥的艾草取出用剪刀处理成约2 cm长的小段并存放于自封袋中置于干燥通风处密封保存备用。
1.2.2 浓缩液的制备 准确称取预处理的艾草100 g于锥形瓶中,料液比(m∶v)为1∶20,浸提温度为50 ℃,浸提时间为8 h,使用双层滤纸抽滤后将滤液置于旋转蒸发仪浓缩获得3 g/mL艾草水提物浓缩液,将浓缩液置于-20 ℃冰箱保存备用。
1.2.3 最低抑制浓度(MIC)的测定 将实验室保藏的大肠杆菌接种到LB培养基上活化培养3次,获得活力较高的菌株后,接种到LB液体培养基中,置于摇床中,37 ℃、170 r/min培养至浓度为1×107 CFU/mL。
将3 g/mL艾草水提物用LB液体培养基,采用倍比稀释法依次稀释4、8、16、32、64、128倍,同时等量接种0.1 mL活化的大肠杆菌菌悬液,将其置于摇床中,37 ℃、170 r/min培养过夜,同时设置3组平行,观察各试管浑浊(表示显著长菌)或判定澄清(表示未长菌)程度,确定最低抑制浓度(Minimal inhibitory concentration,MIC)。
1.2.4 抑菌圈法测定抑菌效果 采用滤纸片法,在无菌操作台中吸取50 μL已活化的大肠杆菌菌悬液于LB固体平板中央,涂布。将平板正向置于无菌操作台中,待LB固体平板将菌液吸收至无流动液体存在后,取已灭菌的干燥滤纸片,将其分别置于稀释4、8、16、32、64倍的浓缩液中浸泡1 min后,分别贴于涂有大肠杆菌菌悬液的LB固体平板中,滤纸片边缘离平板边缘距离应大于1 cm,将用无菌水浸泡的滤纸片作为对照组,后将平板倒置于37 ℃恒温培养箱中培养过夜,每组设置3个平行。采用十字交叉法测定抑菌圈大小,求平均值,确定艾草水提物对大肠杆菌的抑菌能力。
2.2.5 艾草浓缩液对大肠杆菌生长曲线的影响 将活化后的大肠杆菌接种到不同浓度艾草浓缩液的LB液体培养基中,将其置于摇床中,在37 ℃、170 r/min的条件下培养,每隔一段时间使用分光光度计测定波长为600 nm时的吸光度(A600 nm),绘制生长曲线。对照组加等量无菌水,同时向空白培养基加入等量等浓度浓缩液以消除浓缩液对A600 nm的影响。
2.2.6 上清液电导率的测定 向对数生长期的菌悬液试验组加入0.5 mL浓缩液(浓度由“2.2.3”的结果确定),对照组加入等量无菌水,同时向空白培养基加入等量等浓度浓缩液以消除浓缩液对体系电导率的影响。每隔一段时间取菌液1 mL,于4 000 r/min离心2 min,取上清液,使用电导仪测定上清液的电导率。
2.2.7 上清液可溶性总糖的测定 向对数生长期的菌悬液试验组加入0.5 mL浓缩液(浓度由“2.2.3”的结果确定),对照组加等量无菌水,同时向空白培养基加入等量等浓度浓缩液以消除浓缩液对体系总糖的影响。每隔一段时间取0.2 mL菌悬液,于4 000 r/min离心2 min,取上清液,采用苯酚-硫酸法[8]测其上清液可溶性总糖浓度,平行测定3组求平均值,确定抑菌物质对菌液总糖含量的影响。
2.2.8 上清液总蛋白的测定 向对数生长期的菌悬液试验组加入0.5 mL浓缩液(浓度由“2.2.3”的结果确定),对照组加等量无菌水,同时向空白培养基加入等量等浓度浓缩液以消除浓缩液对体系蛋白质的影响,每隔一段时间取菌液1 mL,于4 000 r/min离心2 min,取上清液,采用考马斯亮蓝G-250法[9]测定抑菌物质对菌液上清液可溶性蛋白的影响。
2 结果与分析
2.1 最低抑制浓度(MIC)的确定
由表1可知,艾草水提物对大肠杆菌的最低抑制浓度(MIC)为32倍,表示当浓缩倍数在不高于32倍,即药物浓度为0.094 g/mL时,均有抑菌作用,且抑菌效果明显。此试验结果为后续测定培养液电导率、总糖、可溶性蛋白的艾草提取物胁迫浓度。
2.2 抑菌圈试验测定艾草水提物的抑菌能力
由表2可知,当艾草的水提物浓缩液稀释倍数在32倍及以内时出现了明显的抑菌圈,而在稀释64倍时,有两组试验中未出现抑菌圈,表明在此稀释倍数下滤纸片中的抑菌物质的含量不足以抑制大肠杆菌的生长和繁殖。同时稀释4、8、16倍时,抑菌圈直径呈直线下降,表明所形成的抑菌圈大小存在显著差异,此时滤纸片中的抑菌物質含量差别较大。此结果可与最低抑制浓度的测定试验相互印证。
2.3 浓缩液对大肠杆菌的抑菌活性
大肠杆菌在2 h后开始进入对数生长期,此时大肠杆菌生长活跃,代谢旺盛,菌体活性较高。较高的代谢水平也有利于抑菌物质及时作用于菌体(图1),所以在培养3 h后将LB液体培养基中艾草水提物浓度调整为32倍稀释液,以检测各项指标,研究艾草水提物对大肠杆菌的抑菌机理。由图1可知,当向菌悬液中加入浓缩液后(3 h),试验组大肠杆菌繁殖基本停止,在浓缩液加入后的2 h内有部分菌体死亡导致菌悬液浓度降低,所以这段时间菌悬液的各项指标受菌体死亡带来的影响最大,也是检测体系中生理生化指标进而确定艾草水提物抑菌机理的最佳时间段。据此,后续试验检测指标均在此基础上进行数据测定,以获得最准确的试验结果。未加抑菌物质的对照组大肠杆菌生长状态良好,在检测期内均处于快速繁殖阶段,进一步说明试验组大肠杆菌的生长停滞甚至死亡是由此试验的惟一变量因素导致的,即艾草水提物可影响大肠杆菌正常的生长繁殖。
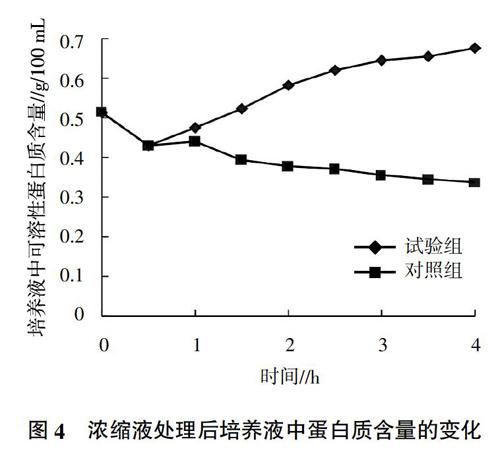
2.5 经浓缩液处理后上清液电导率的变化
细胞膜作为细菌的保护屏障,为细菌提供了一个相对稳定的内环境,保护细菌在外界环境发生变化时自身仍能进行生命活动。而当外界环境对细菌生长不利或者存在抑菌物质时,细菌细胞膜的完整性就会遭到破坏,丧失其选择透过性等功能,同时流动性降低,细胞质中所含的部分离子(如Na+、K+等)大量进入到液体培养基中,导致培养基的电导率上升,此时,通过离心获得培养物的上清液,细菌细胞膜通透性的变化情况可由其电导率的变化直接反映出来[10-12]。由图2可知,当向菌液中加入艾草水提取物后,LB液体培养基上清液电导率明显升高,且随着艾草水提取物对大肠杆菌作用时间的延长,培养液的电导率持续增加,在加入艾草水提液1 h后电导率变化速率明显升高,试验组上清液的电导率在加入抑菌物质2.5 h后电导率达到最大。说明经过艾草水提取物处理的大肠杆菌随着作用时间的延长均有胞质渗漏,且胞质渗漏速度不断加快,在加入艾草水提物2.5 h后导致大部分菌体细胞破损。试验结果说明艾草提取物的抑菌性能稳定,能在短时间内达到破坏大肠杆菌细胞壁、抑菌的目的。
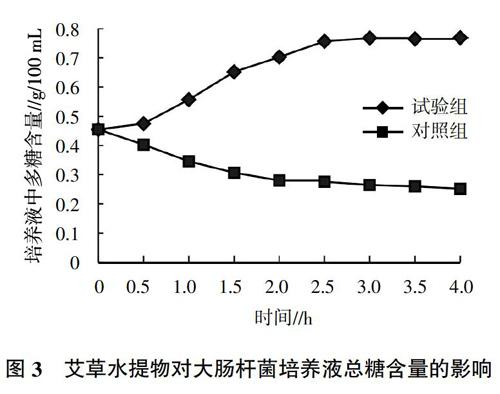
2.6 经浓缩液处理后上清液总糖含量的变化
糖类在微生物生长繁殖过程中发挥着无可替代的作用,它是微生物的能源储备物质和首要的碳源。当营养成分充足时,微生物会吸收利用外源的糖类等物质供自身生长繁殖的需要,而当外界环境的改变(如存在抑菌物质)使其膜结构遭到破坏时,细胞内(如糖类等)物质会发生外泄,导致细菌培养液中包括多糖在内的多种成分的浓度受到影响,通过测定大肠杆菌LB液体培养基上清液中总糖浓度的变化,可以间接确定细菌膜结构是否完整[13-15]。
由图3可知,在加入艾草水提物之后,大肠杆菌培养物中的总糖浓度随着作用时间的延长逐渐升高,在加入艾草水提物2.5 h之后大肠杆菌培养物总糖浓度达到最大值并基本维持稳定,表明艾草水提取物使大肠杆菌细胞膜遭到破坏,菌体内容物流出导致培养物中糖类含量升高。同时对照组培养物中总糖浓度随着时间的延长在逐渐降低,这说明大肠杆菌的生长繁殖正在不断消耗培养物中的糖类。此结果与“2.5”试验中电导率的结果一致。
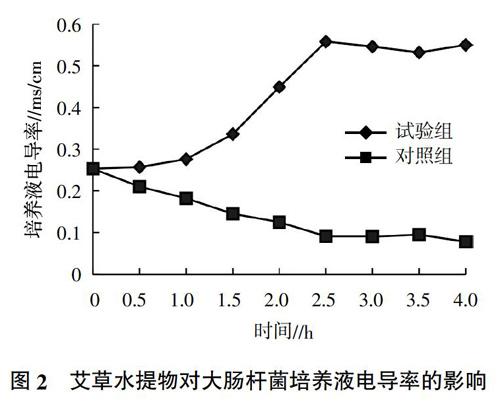
2.7 经浓缩液处理后上清液蛋白质含量的变化
由图4可知,当加入艾草水提物后,培养液中可溶性蛋白质含量有所升高,表明艾草水提物可使大肠杆菌中的蛋白质流出,综合前期试验可知由于艾草水提物的作用导致大肠杆菌细胞膜破损,细胞内容物流出导致培养物中蛋白质含量升高。同时对照组由于大肠杆菌的消耗导致培养物中蛋白质含量有所降低。
3 小结
通过检测艾草水提物加入大肠杆菌菌悬液后培养液电导率、总糖浓度、可溶性蛋白浓度的变化,得出以下结论:
1)艾草水提取物对大肠杆菌的生长繁殖有明显的抑制作用,且作用稳定,可长时间发挥作用,其最低抑制浓度为0.094 g/mL。
2)经过艾草水提取物处理的大肠杆菌随着作用时间的延长均有胞质渗漏,且胞质渗漏速度不断加快,在加入抑菌物质2.5 h后导致大部分菌体细胞破损。试验结果说明艾草水提取物的抑菌性能稳定,能在短时间内达到抑菌目的。艾草水提取物加入大肠杆菌菌悬液后可使其培养物净电导率(去除艾草水提取物本身对电导率的影响)上升,且在加入艾草水提取物2.5 h后电导率达到稳定状态,可见其发挥作用的速度较快。
3)艾草水提取物使大肠杆菌细胞膜遭到破坏,菌体内容物流出导致培养物中糖类、可溶性蛋白质含量升高;同时对照组培养物中总糖和蛋白质浓度随着时间的延长在逐渐降低,这说明大肠杆菌的生长繁殖正在不断消耗培养物中的糖类和蛋白质。同样在加入艾草水提取物2.5 h后总糖和可溶性蛋白质浓度达到稳定状态,此结果与培养液中电导率变化一致。
综合以上试验结论可知,艾草水提取物可导致大肠杆菌培养物的电导率、总糖浓度、总蛋白浓度上升,其主要机理为艾草水提取物可破坏大肠杆菌细胞膜,导致细胞内容物流出,从而影响培养物相关的生理生化指标。其中电导率和总糖浓度的变化在2.5 h内即达到稳定状态,其作用效率较高且性能稳定。因此,艾草作为一种常见的中草药,在抑菌方面有很大的开发应用价值。
参考文献:
[1] 姚勇芳,石 琳,谭才邓.艾草中抑菌物质的提取研究[J].食品科技,2011,36(11):212-214.
[2] 周 峰,秦路平,连佳芳,等.艾叶的化学成分、生物活性和植物资源[J].药学实践杂志,2000,18(2):96-98.
[3] 陈茂花.我国叶茎类食用野生植物资源简介[J].食品研究与开发,2002,23(3):17-21.
[4] 瞿 燕,秦旭华,潘晓丽.艾叶和醋艾叶炭止血、镇痛作用比较研究[J].中药药理与临床,2005,21(4):46-47.
[5] 吴士筠,洪宗國,刘峰成.艾露抑菌作用研究[J].中南民族大学学报(自然科学版),2002,21(4):17-18.
[6] 韩 轶,戴 璨,汤璐瑛.艾叶挥发油抗病毒作用的初步研究[J].氨基酸和生物资源,2005,27(2):14-16.
[7] 蒋 涵,侯安继,项志学,等.蕲艾挥发油的抗疲劳作用研究[J].武汉大学学报(医学版),2005,26(3):373-374,390.
[8] 张媛媛,张 彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[9] 王冬梅,吕淑霞,王金胜.生物化学实验指导[M].北京:科学出版社,2009.3.
[10] 昝 红,霍健聪,邓尚贵.乌梅提取液对大肠杆菌的抑菌特性研究[J].食品工业,2011(7):38-40.
[11] MA F,CHEN Y,LI J,et al. Screening test for anti-Helicobacter pylori activity of traditional Chinese herbal medicines[J].World journal of gastroenterology,2010,16(44):5629-5634.
[12] 曾 亮,黄建安,李赤翎,等.儿茶素的抑菌效果及机理研究[J].食品工业科技,2009,30(5):89-92.
[13] BAJPAI V K,AL-REZA S M,CHOI U K,et al. Chemical composition, antibacterial and antioxidant activities of leaf essential oil and extracts of Metasequioa glyptostroboides Miki ex Hu[J].Food and chemical toxicology,2009,47(8):1876-1883.
[14] 陈丽平.黄芩有效化学成分及抑菌作用的研究分析[J].中国实用医药,2011,6(10):167-168.
[15] 云宝仪,周 磊,谢鲲鹏,等.黄芩素抑菌活性及其机制的初步研究[J].药学学报,2012,47(12):1587-1592.
