学生“离子观”淡薄成因分析以及解决策略
2019-11-11张玮张军
张玮 张军
摘要:离子是构成物质的微粒之一,形成“离子观”是学生建立“微粒观”的重要辅助,学生“离子观”淡薄,难以以“离子”的视角去分析解决一些问题,所以很难将“离子反应”“化学键”等知识作为背景知识去解决化学中的其他一些问题。作者以“电离”“离子反应”“化学键”为知识栽体逐步建立学生的“离子观”。
关键词:离子观;宏微结合;证据推理;符号表征
文章编号:1008-0546(2019)10-0039-03 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.10.010
一、提出问题
在《必修二》教学化学键后,一次课上让学生判断构成物质的微粒类别,很多同学脱口而出NaCl分子,其判断的依据就是只要能写出化学式的物质就是分子,这说明学生“离子观”很淡薄。在后续教学中发现学生“离子观”淡薄还体现在:认为在CH3COOH溶液中,加入NaOH固体会使CH3COOH的电离平衡逆向移动,原因就是NaOH和CH3COOH反应,消耗CH3COOH使电离平衡逆向移动;对于多电解质溶液中,难以以电解质在溶液中反应的本质去分析反应过程,所以对一些基于真实情境的工艺流程、原电池相关的问题很难顺利解决。
多方求证,现总结原因如下:1.初中教学微粒时,更多关注的是分子、中性原子,中考中也更多考查由分子形成的物质,所以学生形成思维定势,看到化学式就认为是分子;一些化合物的导电性实验在大多数学校并没有做,没有抓住由宏观现象探析微观结构的契机,从而错过了形成“离子观”萌芽的良好时机;初中化学教学使学生形成一个深刻观念:分子是保持物质化学性质的最小粒子,但初中教学没有强化这应该是针对由分子构成的物质。2.高中阶段离子反应、化学键教学中没有将养成学生的“离子观”作为重点之一,而将教学重点更多放在离子方程式书写、正误判断、离子共存、化学键概念、电子式书写等应试内容上,没有形成相应观念,造成后续很多知识只能靠死记硬背。
二、“离子观”建立的条件
化学研究的对象是物质,是从微观的角度认识物质及其变化的科学,“微粒观”是中学化学的核心观念。离子是组成物质的微粒之一,与原子、分子同属于微观粒子,建立学生的“离子观”是形成学生“微粒观”的重要辅助,我认为学生只要能达到两点即可认为具备了“离子观”:1.理解电解质在溶液中的行为,包括认可部分溶液中存在离子、知道离子来源于哪里Ⅲ、理解电解质在溶液中反应的本质过程;2.能理解离子化合物的微观结构,且能以一些宏观现象作为证据推理该物质为离子化合物。“离子观”贯穿高中化学学习全过程,在高中教学中涉及到“离子观”的知识有:离子反应、化学键、弱电解质的电离平衡、电化学等,在必修阶段离子反应、化学键对离子观的建立起着承上启下的作用。
1.《离子反应》教学建立学生溶液中的离子观
《离子反应》教学是离子观建立的重中之重,《离子反应》教学如何来建立学生的离子观呢?教学中必须强化两点:①电离;②离子反应的本质。
(1)《电离》教学初步建立溶液中的“离子观”
[过程1]通过生活案例建立溶液中存在离子的初步印象
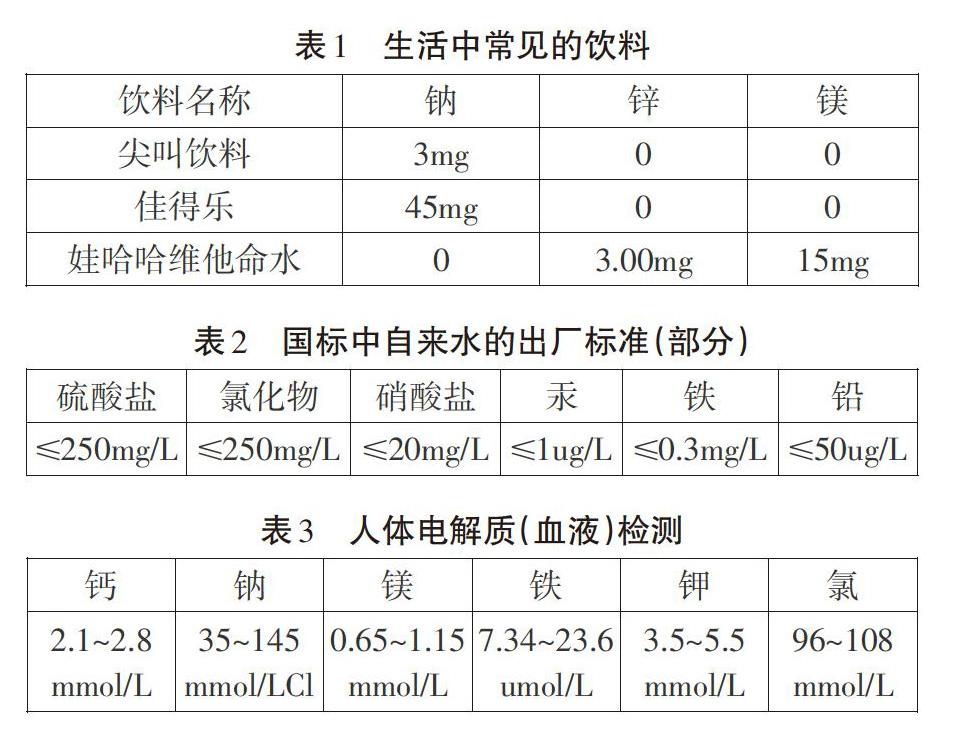
在《电离》教学中首先展示生活中的一些实际案例(表1-3)。
在离子反应教学前,学生对于“离子”的认识很少,主要来源于初中对部分化合物的机械记忆,如NaCl由Na+和C1-组成,但是换成KCl可能就行不通了,所以在教学中首先选择生活中真实存在的案例,多数学生能意识到表中元素以离子的形式存在于溶液中,这种“从生活中来”的“前知识”很容易被接受、被提取,便于与后续的教学内容建立有机的联系,通过对生活常见溶液中元素的存在形式的认识,无形地激发学生对于离子已有的意识,也能从宏观的世界肯定离子的存在。
[过程2]通过化学史带领学生重走“电离”路,感性认识电解质在溶液中的行为
[环节一]展示历史上不同阶段对电离的认识。
[环节二]展示法拉第的“电化学理论”在当时的影响。
[环节三]展示阿伦尼乌斯对电离的研究及“电离学说”的提出,并且体会该学说为什么能解释当时的一些科学事实。
[环节四]展示阿伦尼乌斯提出“电离学说”后遇到的阻力,及其最终取得胜利的故事,体会科学的精神。
重读化学史,让学生沿着科学的发展道路认识电离,感受科学的方法、感悟科学的精神、体会科学的态度,可以加深学生对电离的感性认识,能对溶液中离子哪里来、怎么来的问题有一个更深刻的印象。一个学说的建立必然推动社会的进步,化学史素材还可以激发学生的社会责任,所以教学中引入化学史素材是培养学生社会责任等学科核心素養的重要法宝之一。
[过程3]通过实验内化学生对“电离”的认识
通过上述两个教学步骤,使学生在感性上认识到电解质在溶液中的存在形式,初步领会了电解质在溶液中的电离过程,能感受到溶液中存在的离子。更进一步还应该让学生实实在在地“看到”离子,溶液导电性实验是经典的理陛认识溶液中存在离子的方式。
[演示实验1]用数字实验仪器检测纯净水、自来水、尖叫饮料的导电性。
[演示实验2]磁力搅拌下,在蒸馏水中逐渐加入NaCl固体测定溶液的导电性。
[演示实验3]磁力搅拌下在NH3水溶液中逐渐加入水,并测定导电性。
导电性是溶液性质的宏观展示,是溶液中存在阴阳离子的实证,所以通过不同溶液的“导电性”实验,不仅仅能让学生实实在在地体会到溶液中的阴阳离子,更能将前面两个教学环节中的外部实践活动转化为内部心理活动的过程,即内化,从而真正感受到溶液中“离子”的存在。
电离是电解质在溶液中行为的基础,所以学生理解了电离,当然也就理解了溶液中离子哪里来的问题。学习电离后,学生看到电解质溶液就清楚里面存在阴阳离子,这其实就已经初步具备“离子观”了。
(2)《离子反应》教学借用数字化技术巩固溶液中的“离子观”
电解质、电离是离子反应的知识铺垫,而离子反应的本质,是进一步巩固溶液中“离子观”的重要知识点。教学中进行如下实验:
[演示实验1]磁力搅拌下,一定浓度的HCl溶液中逐渐加入一定量的Na2CO3固体并实时测定溶液导电性、pH。
[演示实验2]磁力搅拌下,一定浓度的NaOH酚酞溶液,逐渐加入一定浓度的HCl。
[演示实验3]磁力搅拌下,一定浓度的H2S04溶液中缓慢加入Ba(OH)2溶液并实时测定电导率。
实验中既有沉淀、气体、指示剂颜色变化等宏观可见的实验现象,也有通过数字实验仪器展示出反应微观原理的实际证据,如pH的改变、电导率的变化。宏观现象说明溶液里微观粒子问相互作用,发生反应生成难溶、难电离、易挥发的物质,由此可以认识到水溶液中的反应是某些离子间相互作用,离子的结合和重组是构成物质及其变化的根本原因,从而形成离子反应概念,并总结出离子反应的本质:反应前后离子进行了重组、离子的种类和数量发生了变化。
教学中引导学生用离子符号表征离子反应的本质,即离子方程式,呈现出微粒相互作用的“本质过程”,通过离子方程式的书写,学生可以从微观角度表征物质在水溶液中的反应,辅助认识离子反应的实质,形成学生的“离子观”。学生在正确认识了溶液反应实质的基础上,不仅会用“写、改、删、查”来书写离子反应,更能为学生在面对多电解质溶液的复杂环境中,以“离子”的视角来分析、解决问题奠定坚实基础。
2.通过《化学键》教学进一步完善“离子观”
通过以上述方式对电离、离子反应的教学,学生能形成溶液中的“离子观”,但是仅仅如此学生可能形成迷思概念,HCl、H2SO4在溶液中电离产生H2、Cl-、SO42-,那么HCl、H2SO4也是阴阳离子形成的嗎?这就需要在离子键的教学中,进一步明确如何形成离子化合物、离子化合物的微观结构组成、离子化合物的宏观特征。
(1)感性认知
活泼金属原子与活泼的非金属原子易形成的化合物如NaCl、KCl、MgCl2、CaO等,都属于离子型化合物,则组成此类物质的微粒是阴阳离子,离子键存在于部分盐、强碱、活泼金属氧化物中。
(2)微观探析
查阅文献有很多优秀的关于“离子键”的教学案例,如林美凤老师在文章《基于“宏观一微观一符号”有机融合的离子键教学》中,设计采用“从宏观角度感受离子键的存在”“从微观角度进一步认识离子键”等方法来学习离子键及其离子化合物,采用这种宏微结合的方式从不同的角度去认识“离子键”,对形成“离子键”“离子化合物”观念的建构有着重要作用;杨莎老师在《情境教学在离子键教学中的应用》中设置游戏情境、实物情境、实验情境等,将离子键、离子化合物知识融入切实情境中,学生亲身体验来获得知识,从而突破概念教学中的抽象思维;孙安龙老师在《基于建构与表征打造概念教学的高效课堂——以“离子键”为例》一文中,从学生已有的知识经验出发,多角度帮助学生建构离子键、离子化合物特点并为学生提供表征离子键的多种方法,并且在教学中渗透类比、探究等方法,加深学生对观念的理解、建构。
以上老师的设计都值得在教学中借鉴,深究各位老师的设计,不论采用什么样教学策略,其目的都是为了让学生能有效地建构“离子键”“离子化合物”等微观观念。“化学键”是从微观的角度认识物质的组成,离子键和化学键的形成方式迥然不同,一个是得失电子、一个是电子共用,自然产生了形成物质的不同微粒。教学中为了能增进学生对离子键、共价键的认识,需要借助原子结构示意图、电子式等符号表征离子、原子间的相互作用,加深对离子键、离子化合物的理解。离子键教学补充强化学生的离子观,最终消除HCI、H2S04等物质也是离子形成的迷思概念。
(3)宏观辨识
在一般情况下离子化合物具有较高的熔点和沸点,教学中以表格的形式展示部分由分子形成的物质和离子化合物的熔点对比。离子键是一种强烈的静电作用,要破坏其作用力需要很高的能量,因此离子化合物通常具有高熔点、高沸点等宏观性质,所以可以初步地从熔点判断是否为离子化合物:通常情况下,熔点高于450℃的化合物,被视为离子化合物;熔点低于450℃的化合物被看作共价化合物。如NaCl的熔点为801℃,显著高于450℃,所以NaCl是典型的离子化合物。而A1C13的熔点为190℃(2.5个标准大气压下),沸点为178℃(升华),远远低于450℃,即通常认为A1C13为典型的共价化合物。诚然这种经验方法比较粗糙和局限,但在适宜的阶段是学生判断离子化合物的重要证据之一。
三、总结与反思
传统离子反应、化学键教学以离子方程式书写、离子方程式正误判断、离子共存、化学键概念、电子式书写、化合物种类等为知识重点,然后学生经过大量的练习可以解决相应的应试题目。但是从近些年高考试题发展趋势来看,越来越注重将知识融合在真实的情境中,越来越重视用知识解决实际的问题,非常注重考查学生的分析、评价、创新能力,与平时的练习题大相径庭,所以部分学生很难适应一些新型的题目,更重要的是学生很难养成证据推理、宏微结合、社会责任、科学态度等学科核心素养。
在学科核心素养视域下,通过教学要使学生能对学科知识从最基本的学习理解过渡到应用实践,最后能对知识迁移创新。以这个过程为指导进行教学,不仅仅可以让学生养成“离子观”,使学生用“离子观”作为工具去分析新情境、评价新过程、推测新问题,更可以在这个过程渗透学科核心素养,逐步使学生形成适应社会的必备品格和关键能力。
