基于圆周光强检测的血管OCT图像导管的去除方法
2019-11-05任鑫博李艳
任鑫博 李艳
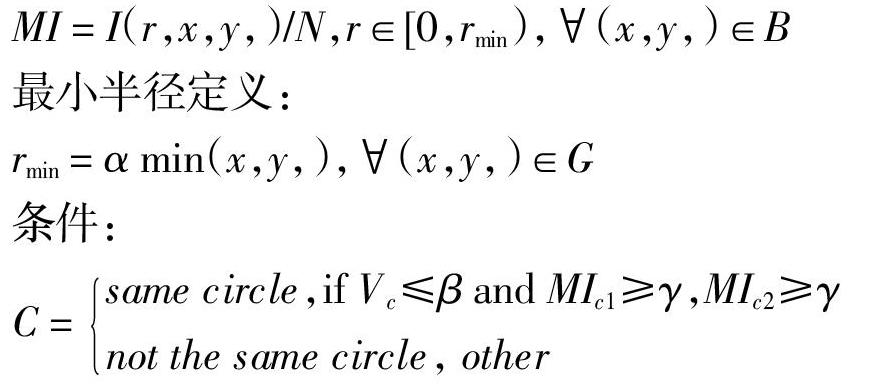
摘 要:在血管OCT(Optical Coherence Tomography)图像中,OCT图像中导管在不同位置的成像,很大程度上影响了血管内其他目标检测及识别的结果。为了减少图像中导管对上述研究结果的干扰,提出一种快速检测和识别导管区域的自动化方法。该方法先在图像中心处划分检测圆的圆心坐标变化区域,在极坐标下建立圆周光强检测模型。然后,利用每个检测圆上其半圆周的像素均值差构建描述当前检测圆的特征数据。针对导管成像失真问题,采取动态地变换检测圆的圆心坐标和半径的方法。对4组血管OCT图像(约300幅/组)进行实验,实验结果表明,导管检测的准确率达到97.35%,且平均每幅图像的检测时间约为0.7秒。
关键字:冠状动脉疾病;OCT图像;圆周光强检测;导管去除
中图分类号:TP391.9 文献标识码:A
Abstract: In the OCT image of coronary artery,the catheter imaging at different locations largely impacts the detection results of other objects inner the vessel. To decrease the effects of catheter and obtain an efficient and accurate image information,an automatic method of rapid detection and identification of catheter regions is proposed. Circle center coordinate transforming area is firstly defined and circumferential intensity detection model was built under polar coordinate. Then,the feature data describing the current detection circle are constructed,and the obtained feature data are statistically analyzed. To deal with the distortion problem of catheter imaging,dynamically transforming the center coordinate and radius of the detection circle is proposed. The method is applied to the detection of catheters in 4 groups of OCT images (about 300 per group). The accuracy was 97.35% with the situation of containing a small amount of residual blood,and the processing time was about 0.7 seconds.
Key words: coronary atherosclerosis diseases;OCT (Optical Coherence Tomography) image;circumferential intensity detection;catheter removing
冠狀动脉疾病是诱发患者死亡的一种常见疾病,全球每年因此类疾病导致死亡的大约有2百万人[1]。近些年来,临床上兴起的支架植入术是治疗或缓解该类病情的一个有效的方法。Instravascular Optical Coherence Tomography(即血管内OCT)是一种新式侵入式图像获取技术,它利用OCT仪器的探头,深入到人体体内的血管中,通过回退(pull-back)方式在血管内运动,同时由探头向血管壁方向发射光波,在回退的过程中旋转探头,由接收装置获取被反射的光波,进而形成血管横截面的扫描图像。通过OCT技术扫描血管图像的光束运动方式也被称为“螺旋式回退过程”,对于一个观察样本,所获取的扫描血管扫描图像是一组多帧的OCT图像集。相比于传统的Intravascular Ultrasound(即IVUS)图像扫描方式,OCT具有很高的分辨率(10-15 μm)[2],并且所获取的血管图像的尺度单位为1-2 mm[3][4],因此它对一些形如“薄帽”纤维块、脂质块和钙化块等冠状血管病变组织能够正确显示其形态结构。同时,与IVUS使用的仿射线扫描技术相比,OCT技术使用的是光学相干断层扫描技术,因此OCT技术对人体的放射性危害更小,目前已被广泛用于眼科、牙科和心血管的临床诊断中。
在大量的血管OCT图像分析中,研究者首要面临的问题是图像中导管成像的干扰。文献表明,导管是与血管腔内的残留血液、血管图像的噪声及导线阴影并列的干扰血管内组织结构量化分析的难题之一。Macedo等人[5]通过OCT设备,获得导管的区域和图像的成像尺度等参数信息,将导管内的强度值设置为零,避免导管图像对后期研究的干扰。文献[6]同样是利用设备获取导管成像中,具有最大半径的圆环的先验信息,进行导管去除。Celi等人[7]先找出包含导管在内的一个子区域,然后利用导管的圆形形状获得导管的成像范围。Ughi等人[8]对远离血管壁的导管,使用常量掩模法去除,且需要人工参与。Ughi等人在文献[9]中利用霍夫变换,将OCT图像变为极坐标下的图像,通过求取整个回退图像集中的最大半径值,进行导管检测。上述方法对于未变形的同心圆区域能够实现导管区域的检测和去除,但是对于成像变形的同心圆则检测效果差,同时需要人工参与较多。此外,在文献[10]中,Ughi等人使用Otsu方法对OCT图像进行二值化处理,根据经处理后的导线区域非连续的特点,定义的黑白最小区域(即BWMA),利用面积进行阈值判定,完成导管去除。但是,该方法易受管腔中的残留血液影响。Chiastra等人[11]利用整个OCT图像集的平均光强度近似地估计导管的光强值。Tsantis等人[12]根据导管成像失真且同心圆形状不标准的原因,利用已知导管中心点坐标的先验信息,定义两个同心圆,利用图像所有点到中心点的距离直方图计算两个同心圆的半径,在这两个同心圆之间寻找满足条件的导管像素点。上述血管OCT图像的导线去除方法中,要么利用已知的先验信息确定导管的半径,要么所处理的导管的位置远离血管管腔壁,没有涉及导管紧贴管腔壁的情况。同时,对于不同半径的导管区域,上述文献也没有进行量化分析。
针对上述问题,通过分析OCT图像中导管成像的原因、成像的形状和导管的位置信息,提出一种能够快速检测和识别导管区域的方法。该方法在极坐标下建立圆周光强检测模型,利用每个检测圆上其半圆周的像素均值差构建描述当前检测圆的特征数据,对所获得的数据进行统计分析,确定满足导管检测的阈值条件。针对导管成像失真问题,定义检测圆的圆心坐标变化区域,动态地改变检测圆的圆心坐标和半径,实现在各种导管成像条件下的导管区域检测。
1 图像预处理
对血管OCT图像进行灰度转换,将原始的RGB通道的图像转换为Gray通道的图像,然后使用3×3的高斯滤波器对待检测的血管OCT图像进行去噪处理。对OCT图像的尺寸进行同一化处理,将尺寸为M×N的图像处理为P×P的图像,其中,P = min(M,N)。
2 血管OCT导管检测方法
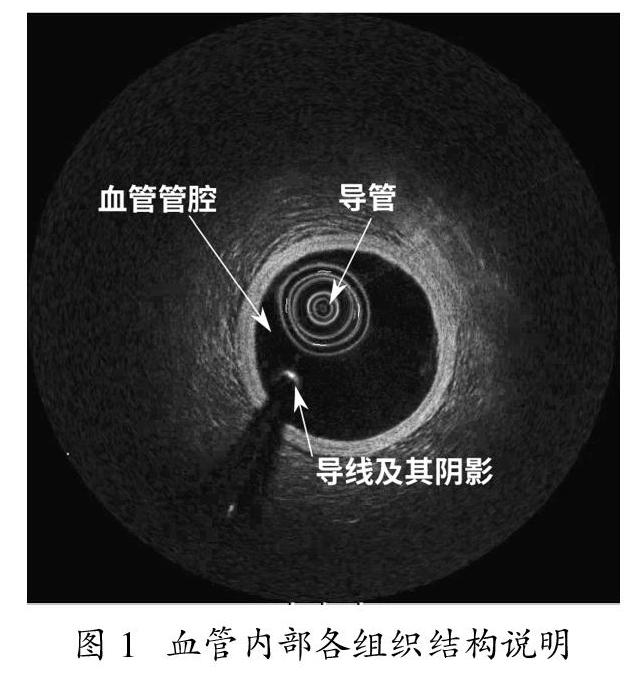
图1显示了使用OCT技术扫描血管所获得的图像,主要由位于中心位置的导管、导线(或称为导丝及其阴影、血管管腔区域、管腔壁以及血管管腔的外壁组织组成。从图1中可观察,由于导管内的金属结构对入射光的反射影响,导管的成像表现为一组形状失真的同心圆。
2.1 导管成像分析
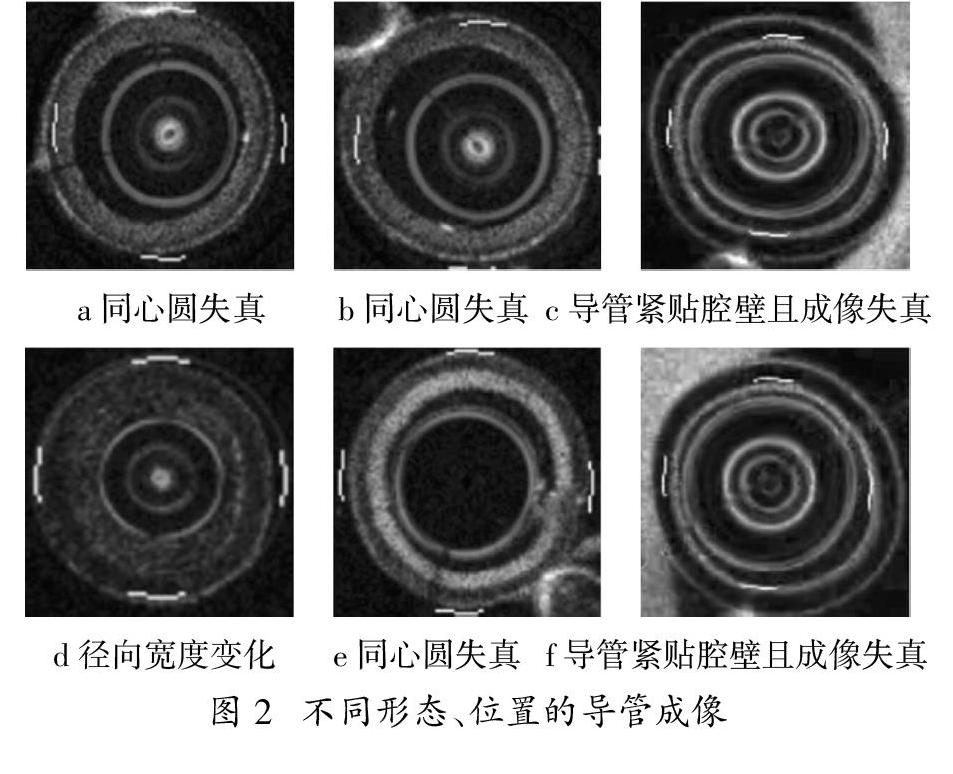
根据文献[9][10][11][12]中描述,导管在血管内整个回退过程中,与血管壁的相对位置变化不定,所成像的同心圆存在失真情况。具体表现在(1)导线的回退运动方式;(2)导管在人体内血管的位置移动变化;(3)不同的图像集,导管成像的半径大小不同;(4)血管内部组织结构的复杂性,探头发射的光波被这些组织吸收和散射,导致接收的信号不均匀等原因,使得导管的成像呈现失真的特点;(5)失真的同心圆周邻近范围内也伴随有图像的噪声出现。如下图2所示,子图a、b、c、d、e、f中的导管及导管金属壁的成像形状均出现失真,同时各自導管的半径大小也不统一。其中,子图a与b相似,c与f相似,d和e与其他都不相同。在子图中,a、b、d、e与血管壁的距离较远,c和f紧贴血管的管腔壁。
2.2 导管检测模型建立
假设在理想条件下,导管发射的光波被血管内各组织吸收和反射的情况相同,导管的成像为标准且不失真的同心圆,这些同心圆的圆周上的各像素点分布均匀,并且同一圆周上的各点的像素值大小相同。若将同一个圆的圆周等分为的两部分,则这两个半圆周上的平均像素值也必然相等。理想情况下,两个半圆周的像素均值差也应该为0。通过对OCT图像中的同心圆的形状测量,导管成像的每个同心圆的失真部位,为圆周上的某一小部分,各单一同心圆的形状近似满足圆形形状。由上图2可以看出,导管外壁在径向方向上的成像具有一定的径向宽度。根据同心圆环上点的像素值分布不均匀和其周围噪声影响的特点,在一组失真的同心圆区域建立一定半径大小的检测圆模型,计算该检测圆上两个半圆圆周部分的像素均值的差值,形成在相应圆心坐标和半径值下,该处的检测圆特征描述数据。通过移动圆心坐标和改变检测圆的半径大小,获取一系列特征值数据,利用统计方法进行分析,得出特征数据的临界值,实现导管区域的检测。最后,将满足检测条件的结果中的所有点都标记为导管区域。导管检测模型示意图如下图3所示。
面临导管成像的同心圆的形状和位置的变化,该模型还需要解决如下问题:
检测圆的圆心坐标范围;
检测圆的半径大小及其范围限制;
特征描述数据的归一化及数据分类。
解决上述问题,则需要(1)确定检测圆的圆心坐标范围;(2)考虑检测圆的最大可能半径,防止半径取值超出原始图像的边界;(3)对满足检测圆判定条件的非导管区域的圆,进行统计分析。
2.3 导管模型定义
令G表示血管OCT图像,定义检测圆的圆心坐标为(xc,yc),半径为rc。其中,检测圆的圆心坐标(xc,yc)取值范围为G。如果(xc,yc)遍历G中所有的点,会增加算法的计算量和计算时间,而且对导管区域外进行模型检测无意义,因此,定义局部区域B,B表示以OCT图像中心为其中心点所定义的局部区域,选取其周围4×4的区域作为所计算圆心的移动范围。其中(xc,yc)∈B?G。
3 实验数据及结果分析
的实验数据使用Fourier-Domain OCT(FD-OCT)系统收集,系统的空间分辨率为10×10 μm/pixel,轴向分辨率为12~15 μm,导线回退为20 mm/second。采集的图像数据共分4组,每组约300幅图像。本实验的测试方法的实现平台是Python语言编程环境,并应用Opencv、Numpy、Skimage等图像和数据处理基础库。
在实验过程中,rmin的取值大小决定了检测圆的检测范围。若α取值为1.0,实验结果如图4所示,实验结果会产生多余的满足判定条件的检测圆。解决方案:(1)通过统计分析,给α选取合适的值;(2)观察结果发现,图中两组区域之间距离明显,因此利用统计方法对数据进行分类,去除多余的检测圆,保留中心导管处的检测区域。通过实验分别对上述两种方案进行测试,方案(1)可以很好解决各类情况下的导管区域检测问题,但是在针对不同类的OCT图像处理时,需要少量的人工参与设置和调整参数。方案(2)可以实现算法的自动化,但是对于某些特殊情况下导管区域的检测,结果有误差。因此,本文选取方案(1)进行算法的最终测试。在本文算法的测试中,α=0.25±0.125,β=1.0±0.1,γ=20。每幅图像的平均处理时间约为0.7±0.1s。
其他参考文献中未对血管图像中导管检测和去除的方法进行更深一步的分析和处理,对导管的去除结果也未能与人工识别结果进行有效的对比,本文随机从4组实验数据中抽取80幅血管的样本图像进行导管检测方法测试,并将正确的检测结果与人工识别结果进行差异性对比。图5利用Bland-Altman方法对80幅图像的自动检测和人工分割的结果进行差异性统计分析,纵轴表示两类结果的差异程度。图6是本文自动检测结果与人工手动分割结果的相关性分析。表1是其中6幅图像分别在人工与自动化方法下的实际结果。针对4组数据测试集,应用本文方法进行导管区域检测,并通过专业医疗人员对检测结果进行判定,识别结果如表2所示。
4 結 论
利用计算机辅助手段进行血管OCT图像分析是近年来研究血管OCT图像的热门方向。许多研究人员针对血管OCT图像中血管的管腔边界(有无分支)、支架检测(植入初期、中期和后期)及动脉病变组织区域识别等内容进行了大量的研究。在血管OCT图像的预处理阶段,导管的去除是一项极具挑战的任务。本文研究了血管OCT图像中导管的成像特性,在极坐标下建立圆周光强检测模型,利用每个检测圆上其半圆周的像素均值差构建描述当前检测圆的特征数据,对检测结果进行统计分析和分类,给出最终的检测结果。与人工检测结果对比,本文方法的正确率达到了97.35%。实验研究的方法可以作为利用血管OCT图像进行病变组织研究的前期辅助手段。
参考文献
[1] ROGER V L,GO A S,LLOYD-JONES D M,et al. Heart disease and stroke statistics-2011 update: a report from the American Heart Association[J]. Circulation,2011,123(4): e18.
[2] CHAN P H,ALEGRIA-BARRERO E,MARIO C D. Tools & techniques: intravascular ultrasound and optical coherence tomography[J]. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology,2012,7(11):1343—1349.
[3] BEZERRA H G,COSTA M A,GUAGLIUMI G,et al. Intracoronary optical coherence tomography: a comprehensive review: clinical and research applications[J]. JACC: Cardiovascular Interventions,2009,2(11): 1035—1046.
[4] HUANG D,SWANSON E A,LIN C P,et al. Optical coherence tomography[J]. Science,1991,254(5035): 1178—1181.
[5] MACEDO M M G,GUIMARAES W V N,GALON M Z,et al. A bifurcation identifier for IV-OCT using orthogonal least squares and supervised machine learning[J]. Computerized Medical Imaging and Graphics,2015,46: 237—248.
[6] MORAES M C,CARDENAS D A C,FURUIE S S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction[J]. Biomedical Engineering Online,2013,12(1): 78.
[7] CELI S,BERTI S. In-vivo segmentation and quantification of coronary lesions by optical coherence tomography images for a lesion type definition and stenosis grading[J]. Medical Image Analysis,2014,18(7): 1157—1168.
[8] UGHI G J,ADRIAENSSENS T,ONSEA K,et al. Automatic segmentation of in-vivo intra-coronary optical coherence tomography images to assess stent strut apposition and coverage[J]. The international Journal of Cardiovascular Imaging,2012, 28(2): 229—241.
[9] UGHI G J, ADRIAENSSENS T, DESMET W,et al. Fully automatic three-dimensional visualization of intravascular optical coherence tomography images: methods and feasibility in vivo[J]. Biomedical Optics Express,2012,3(12): 3291—3303.
[10] UGHI G J,ADRIAENSSENS T,SINNAEVE P,et al. Automated tissue characterization of in vivo atherosclerotic plaques by intravascular optical coherence tomography images[J]. Biomedical Optics Express,2013,4(7): 1014—1030.
[11] CHIASTRA C,MONTIN E,BOLOGNA M,et al. Reconstruction of stented coronary arteries from optical coherence tomography images: Feasibility,validation,and repeatability of a segmentation method[J]. PloS One,2017,12(6): e0177495.
[12] TSANTIS S,KAGADIS G C, KATSANOS K, et al. Automatic vessel lumen segmentation and stent strut detection in intravascular optical coherence tomography[J]. Medical Physics,2012,39(1): 503—513.
