人脐带间充质干细胞移植修复大鼠的卵巢早衰
2019-11-04毛熙光
谭 丽,毛熙光,钟 影,刘 敬
(1.西南医科大学附属医院生殖中心,四川 泸州 646000; 2.成都西囡妇科医院生殖中心,成都 610000)
卵巢早衰(premature ovarian failure,POF) 是由于卵巢功能衰退而引起更年期综合症、性欲减退、不孕、月经失调等症状疾病[1]。引起POF发生的可能因素有自身免疫损伤、精神刺激、代谢异常、环境破坏、手术损伤及吸烟、饮酒等不良生活方式[2-3],但大部分POF患者的病因及发病机制尚未明确。目前POF的研究热点是如何有效恢复患者的卵巢功能和生育力,而干细胞是一类能自我更新的多潜能细胞,在一定条件下具有再生各种组织器官和人体的潜在功能。有研究表明,通过干细胞移植治疗POF,在一定程度上能恢复卵巢组织形态、弹性和韧性,减少卵巢组织纤维化[4-5]。hUCMSCs移植目前在临床上广泛应用于各种组织损伤的修复。本研究通过观察POF大鼠移植hUCMSCs后的卵泡情况、卵巢超微结构、血清中激素表达水平以及SOD1、UCP-2蛋白的变化,探讨hUCMSCs修复卵巢功能的作用机制,为临床应用提供理论依据。
1 材料和方法
1.1 实验动物
具有正常动情周期的SPF级SD雌性大鼠30只,购自北京维通利华实验动物公司[SCXK (京) 2018-0006],体重 (200±20)g。大鼠统一饲养在我院动物房[SCXK(川)2018-17],室温(22±2)℃,适应性喂养7 d,完全随机分为3组,即对照组、模型组及hUMSCs移植组,每组10只。本研究通过了我院伦理委员会审查,实验过程动物符合3R原则(伦理审批号:SLXD _201803170012)。
1.2 主要试剂与仪器
环磷酰胺(cyclophosphamide,CTX)购自浙江海正药业股份有限公司(批号:20180412);DMEM培养液、胎牛血清 (FBS)、青/链霉素混合液和胶原酶IV型 (collagenase IV)均购自中国北京索莱宝科技有限公司;二步法免疫组织化学试剂盒(北京中杉金桥生物技术有限公司,批号AH03014880);全蛋白提取试剂盒和BCA蛋白定量试剂盒购自美国Bio-Rad公司;ELISA检测试剂盒(上海通蔚生物科技有限公司,批号CSB-E08008r);SOD1、UCP-2和GAPDH抗体均购自北京博奥森生物技术有限公司;山羊抗兔二抗购自广州展晨生物科技有限公司。美国Bio-Rad蛋白电泳仪和Western曝光仪;日本电子TECNA I型透射电镜。
1.3 实验方法
1.3.1 动物模型的构建
模型大鼠第1天腹腔注射负荷剂量的CTX溶液,即50 mg/kg溶于1 mL生理盐水中,之后2~15 d连续每日以10 mg/kg CTX溶于1 mL生理盐水腹腔注射;造模成功后,将模型大鼠随机分为模型组和hUMSCs移植组,hUMSCs移植组在成功建模后1 d通过尾静脉注射1 mL hUMSCs单细胞混悬液,移植细胞量约为1×106个,模型组注射等剂量的生理盐水。
1.3.2 hUMSCs培养与鉴定
取正常足月产妇新生儿脐带,PBS冲洗后,除去脐动、静脉残留血,剔除血管。将脐带剪碎至1.0~2.0 mm3大小,按胰蛋白酶消化法进行培养[6]。取第3代hUCMSCs,采用流式细胞仪对其表面标记物进行鉴定。试验方案经我院伦理委员会批准,并与供者签订知情同意书。
1.3.3 标本的采集
hUMSCs移植后17 d,对照组、模型组及hUCMSCs移植组大鼠主动脉采血后,麻醉后,取仰卧位,迅速剖开腹腔,摘取双侧卵巢组织,将一侧卵巢组织以4% 多聚甲醛液固定24 h,脱水后石蜡包埋,用于HE染色及免疫组化检测;另一侧卵巢组织迅速切取一部分组织块用于超微结构观察,剩余部分立即置于液氮中过夜,并在第二天转移至-80℃冰箱中保存,备用。
1.3.4 大鼠卵泡情况
取石蜡包埋的卵巢组织,行6 μm厚连续切片,每隔10张取1张,进行HE染色,光学显微镜下观察卵泡的生长情况和闭锁情况,并对各组大鼠卵泡进行计数[7]。
1.3.5 大鼠卵巢组织超微结构
取新鲜卵巢组织的切片,4℃下置3%戊二醛固定液固定24 h后,洗去固定液,置1%锇酸固定液固定90 min,脱水、包埋、修块,在超薄切片机上进行切片,厚50 nm,采用醋酸铀和枸橼酸铅对切片双重染色,自然晾干后,置扫描电镜下观察。
1.3.6 血清E2、FSH、AMH、ROS、8-OHdG水平检测
将采集的血样室温静置,离心,分离血清,采用ELISA法检测血清中E2、FSH、AMH、ROS、8-OHdG含量,操作严格按照试剂盒说明书进行,用酶标仪在532 nm波长处测定,计算即得。
1.3.7 卵巢组织免疫组织化学染色检测
石蜡切片常规脱蜡、水化,置于修复液中微波加热修复,置于H2O2封闭,分别加入UCP-2及SOD1一抗4℃ 孵育过夜,PBS冲洗8 min ×3次,加入二抗,37℃孵育2 h,PBS漂洗8 min ×3次,苏木素复染,脱水,透明,封片,显微镜观察。
1.3.8 Western blot检测
在卵巢组织(50 mg)中加1 mL裂解液,冰上均浆,4℃离心10 min,经BCA法蛋白定量后上样,SDS-PAGE凝胶电泳分离、电泳、转膜,采用含5%脱脂奶粉的TBST封闭2 h。加一抗,4℃冰箱过夜。加二抗37℃ 2 h,漂洗后显影。对蛋白质条带进行分析,测定其吸光度值。目的蛋白的相对表达强度=目的蛋白的吸光度值/β-actin的吸光度值。
1.4 统计学方法

2 结果
2.1 hUMSCs鉴定定结果
流式细胞仪检测细胞表面抗原的结果显示,hUMSCs高表达CD105、CD73,低表达CD34、CD45,证实为脐带间充质干细胞,细胞纯度较好,见图1。
2.2 病理学观察结果
由图2可知,对照组大鼠卵巢中各级卵泡均明显可见,组织结构正常。而与对照组相比,模型组卵巢体积变小,闭锁卵泡数量增多、生长卵泡减少。hUMSCs移植组与模型组比较闭锁卵泡减少、生长卵泡增多;各组大鼠卵泡计数结果中,模型组与对照组比较闭锁卵泡数量上升,而生长卵泡数量下降(均P<0.05)。 hUMSCs移植组与模型组比较闭锁卵泡数量下降,而生长卵泡数量上升(均P<0.05)。各组大鼠黄体数量未见明显变化(P>0.05),见表1。
2.3 卵巢超微结构变化
大鼠卵巢电镜观察结果,对照组颗粒细胞无水肿,可见正常的细胞膜、核仁,内质网及线粒体分布均匀、清晰可见,细胞核内染色质均匀;模型组颗粒细胞染色质固缩,核溶解,核膜消失,线粒体空泡化,细胞器数量减少,同时还出现有凋亡小体;移植组细胞核出现,核膜逐渐恢复,出现少量细胞器,详见图3。
2.4 血清检测结果
ELISA检测各组大鼠血清激素水平变化,模型组血清LH、FSH水平较对照组明显升高 (均P<0.05),而E2水平明显降低 (P<0.05);hUCMSCs移植组血清LH、FSH水平较模型组明显下降 (均P<0.05),而与对照组、模型组比较,hUCMSCs移植组E2水平明显上升 (P<0.05),见表2。
ELISA检测ROS和8-OHdG结果,模型组、hUCMSCs移植组中ROS和8-OHdG生成量较对照组明显增加 (均P<0.05),而hUCMSCs移植组中ROS和8-OHdG生成量较模型组明显下降 (P<0.05),见图4。
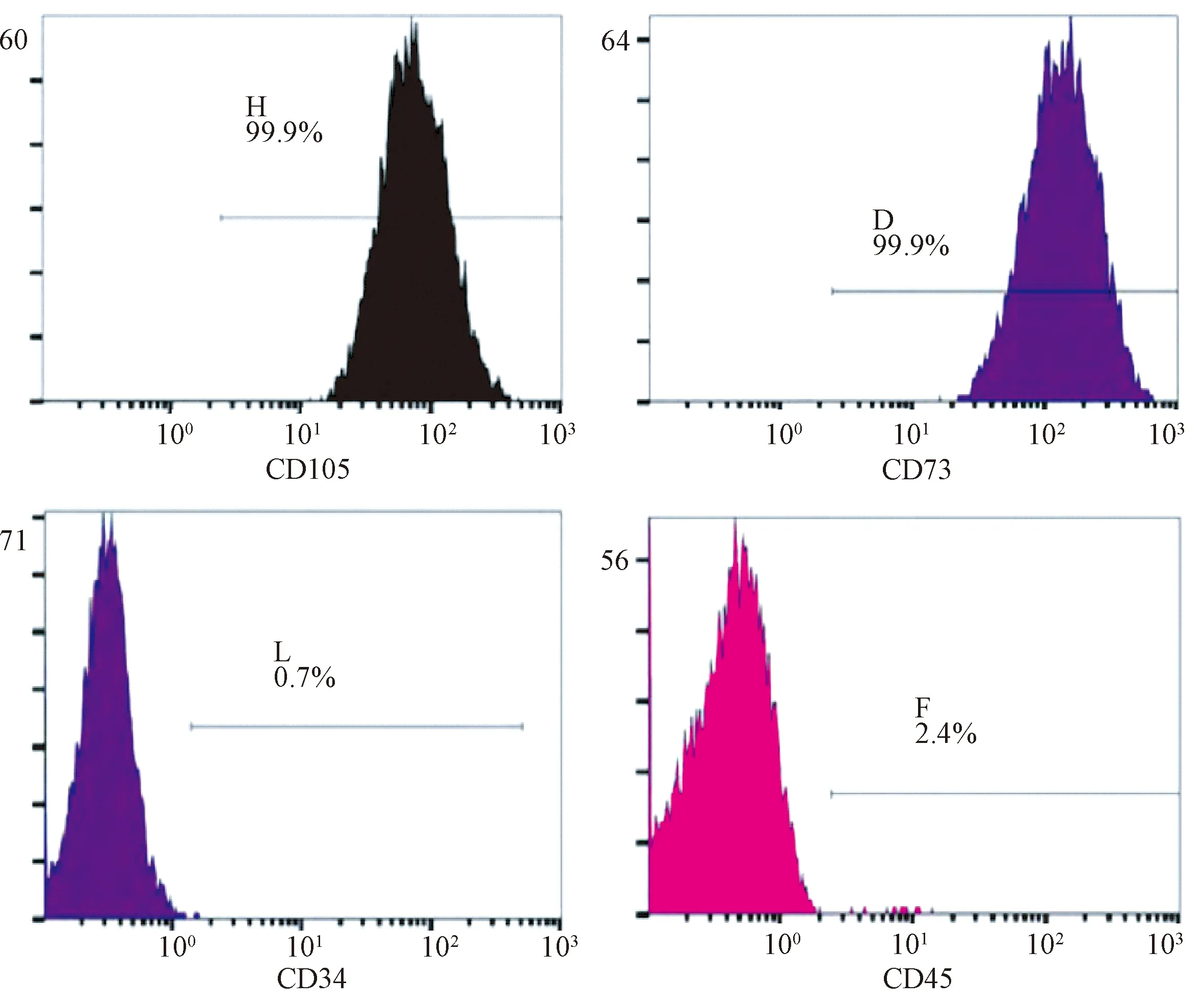
图1 hUMSCs流式细胞仪检测结果Figure 1 Changes of hUMSCs detected by flow cytometry
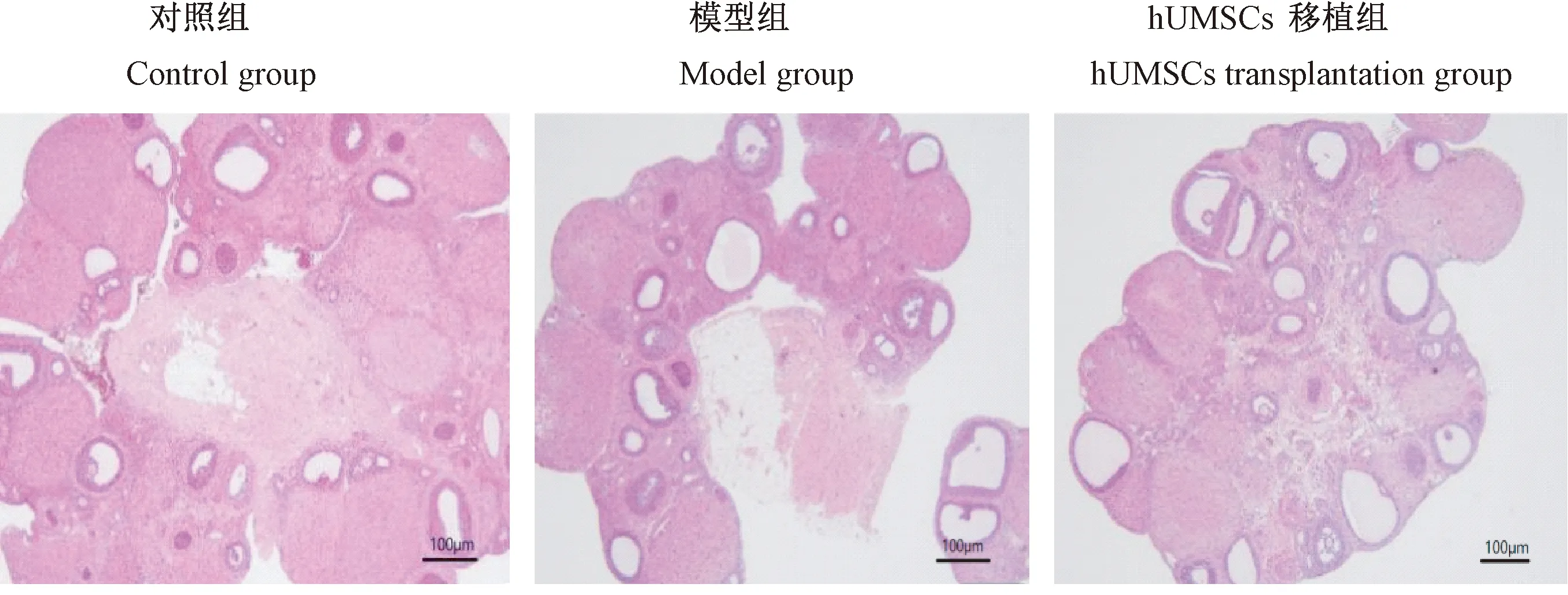
注:与对照组相比,*P<0.05。图2 各组大鼠卵巢组织HE染色Note. Compared with the control group, *P<0.05.Figure 2 Pathological changes in the ovarian tissues of rats in each group. HE staining
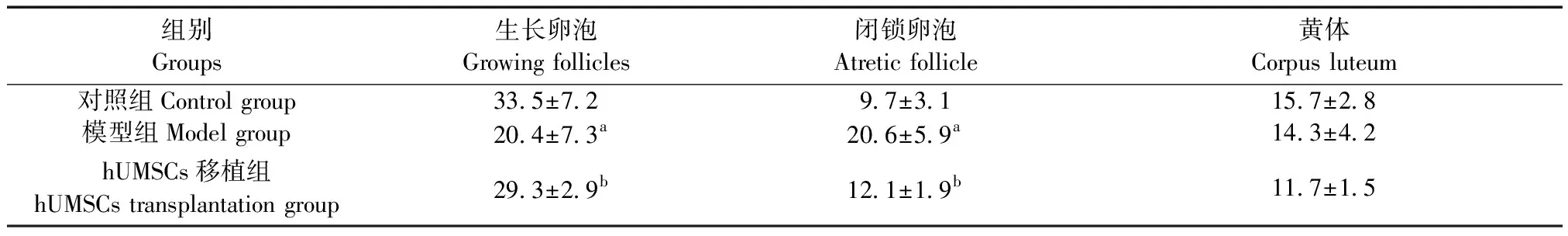
组别Groups生长卵泡Growing follicles闭锁卵泡Atretic follicle黄体Corpus luteum对照组Control group33.5±7.29.7±3.115.7±2.8模型组Model group20.4±7.3a20.6±5.9 a14.3±4.2hUMSCs移植组hUMSCs transplantation group29.3±2.9b12.1±1.9 b11.7±1.5
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05。
Note. Compared with the control group,aP< 0.05. Compared with the model group,bP< 0.05.
表2 各组大鼠血清激素水平变化
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05。
Note. Compared with the control group,aP< 0.05. Compared with the model group,bP< 0.05.
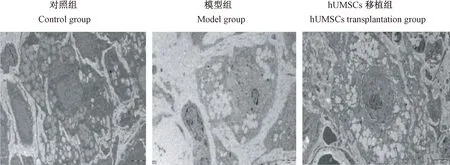
图3 各组大鼠卵巢超微结构(×8000)Figure 3 Ultrastructural changes of the ovary tissues of rats in each group

注:与对照组相比,aP<0.05;与模型组相比,bP<0.05。图4 各组大鼠血清中8-OhdG和ROS含量变化(n=10)Note. Compared with the control group, aP < 0.05. Compared with the model group, bP < 0.05.Figure 4 Changes of serum 8-OhdG and ROS in the rats of each group
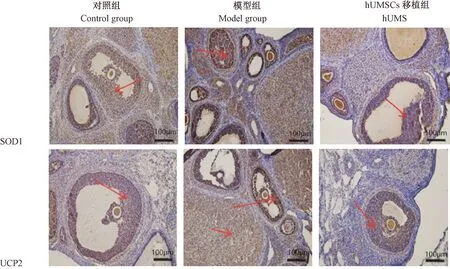
注:箭头指阳性细胞。图5 免疫组化检测各组大鼠卵巢中SOD1及UCP2蛋白表达Note. The arrow points to the positive cells.Figure 5 Expressions of SOD1 and UCP2 proteins in the rat ovarian tissues
2.5 各组大鼠卵巢免疫组化检测
UCP-2蛋白主要位于黄体细胞、颗粒细胞核和胞质,而SOD1蛋白主要位于黄体细胞、颗粒细胞胞质。与对照组比较,模型组免疫组化UCP-2、SOD1阳性细胞数增加,而hUCMSCs移植组UCP-2、SOD1阳性细胞数较模型组减少,见图5。
2.6 Western blot检测各组大鼠卵巢中SOD1及UCP2蛋白表达
模型组大鼠卵巢组织中SOD1、UCP-2蛋白表达较对照组显著增加 (P<0.05),经过hUCMSCs移植治疗后,SOD1、UCP-2蛋白水平较模型组明显下降(P<0.05),见图6。
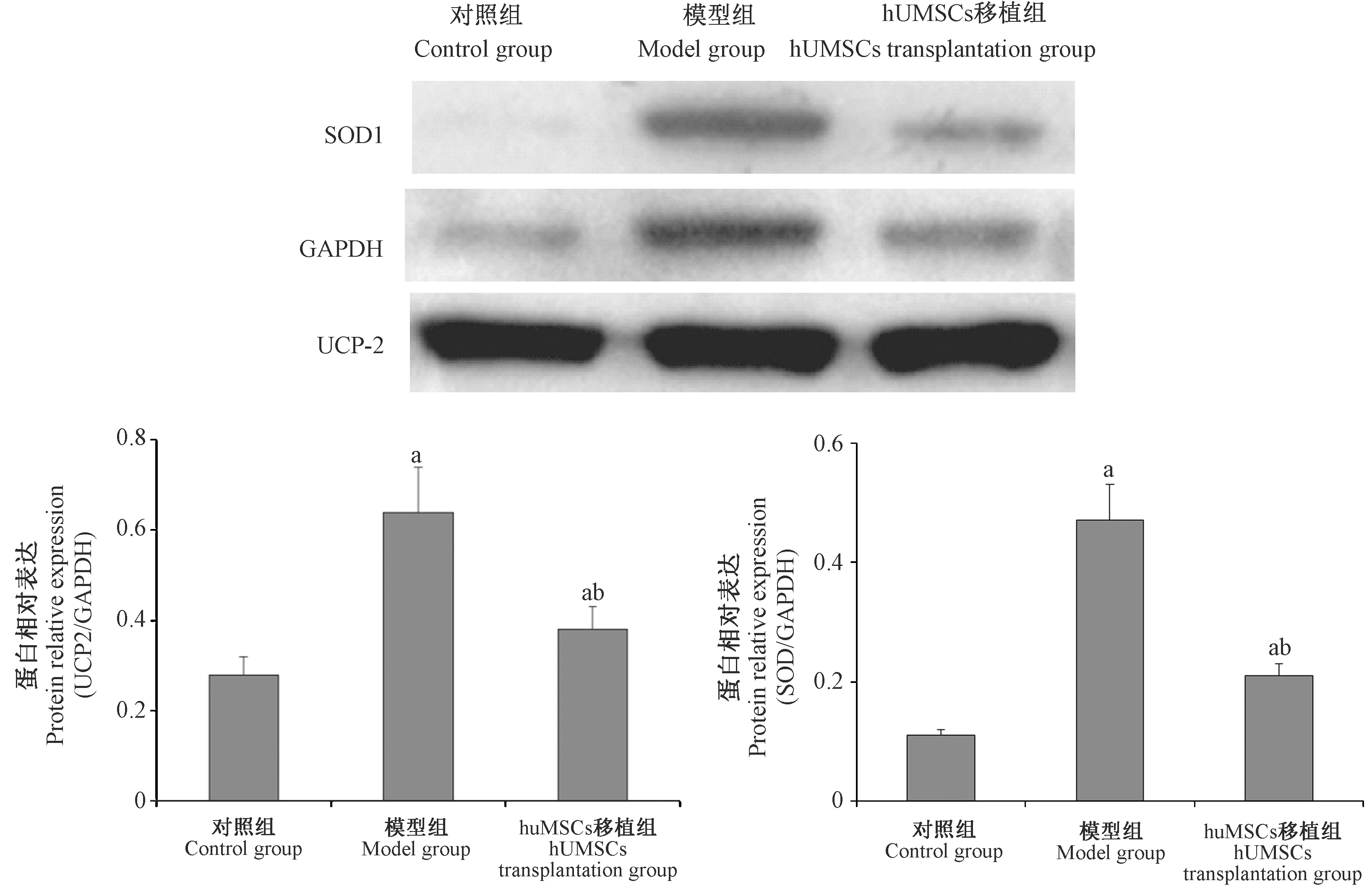
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05。图6 大鼠卵巢组织中SOD1及UCP2蛋白表达(n=10)Note. Compared with the control group, aP < 0.05. Compared with the model group, bP < 0.05.Figure 6 Expression of SOD1 and UCP2 in the rat ovarian tissues
3 讨论
POF致病因素较多,发病率也逐渐升高,但目前尚无有效的恢复卵巢功能的治疗方法,如何有效地治疗是当前亟需解决的难题之一。干细胞在医学界被称之为“万用细胞”,有研究表明,它们可能对卵巢功能有一定的修复作用[8]。hUCMSCs源于胎儿分娩后的废弃物,来源丰富,体外培养及移植技术成熟,研究治疗卵巢早衰方法已经成为国内外热点。CTX是一种临床常用于非特异性细胞周期的抗癌药物,对卵巢会产生不可逆性的损伤[9],进而引发卵巢功能障碍,目前常用于POF造模。
本研究中,检测卵巢生殖激素水平的结果显示,hUCMSCs移植组中血清LH、FSH水平较模型组明显下降,而与对照组、模型组比较,hUCMSCs移植组E2水平明显上升,从而看出hUCMSCs移植后可以一定程度的改善卵巢功能。HE染色结果显示,与对照组比较,模型组闭锁卵泡数量上升,生长卵泡数量下降,而hUMSCs移植组闭锁卵泡数量下降,生长卵泡数量上升,这提示hUCMSCs移植后能够通过减轻生长卵泡的损伤发挥作用;大鼠卵巢电镜观察结果显示,与对照组比较,模型组颗粒细胞水肿,细胞核溶解,线粒体减少,出现凋亡小体等情况,而hUCMSCs移植后颗粒细胞出现细胞核,核膜逐渐恢复,出现少量细胞器,这说明研究中模型大鼠采用的给药方法和用药剂量能产生卵巢损伤,而hUCMSCs对颗粒细胞有修复作用,研究人员推测hUCMSCs移植修复大鼠卵巢早衰机制可能是通过对颗粒细胞修复从而抑制卵泡凋亡。
活性氧(reactive oxygen species,ROS)是生物体内的自由基,具有很强的化学活性,线粒体是其来源和靶点,作为细胞内和细胞间的第二信使,ROS可调节许多信号分子,在维持机体氧化/抗氧化平衡方面起着重要作用[10-11]。本研究中大鼠经CTX处理后,体内会产生大量ROS,引起氧化应激反应,导致大鼠线粒体受损,并可能诱发DNA/RNA氧化损伤,其中以8-OHdG最为常见。ELISA检测结果显示,模型组中ROS和8-OHdG生成量较对照组明显增加 (P<0.05),推测原因是环磷酰胺处理后mtDNA改变和氧化应激增加会引起线粒体功能降低,进一步导致各种能量代谢的下降。
解偶联蛋白2(uncoupling protein 2,UCP2)属于线粒体阴离子转运体蛋白超家族的一员,能够介导线粒体的质子漏[12]。有研究表明,UCP2在体内可能参与了ROS生成的调控,并提出UCP2负调控的假设模型[13],这一假说表明UCP2可能在氧化应激反应中降低ROS水平,从而起到保护机体的过氧化损伤。超氧化物歧化酶(superoxide dismutase,SOD)是一种源于生命体的活性物质,是机体氧自由基的头号杀手,作为有害物质的超氧阴离子在SOD的作用下和氢离子反应生成H2O2,H2O2又在过氧化氢酶的作用下和氢反应生成H2O,因此具有防止细胞和组织受到氧化性损伤的作用[14-15]。本研究中免疫组化结果显示,与对照组比较,模型组UCP-2、SOD1阳性细胞数明显增加,而hUCMSCs移植组UCP-2、SOD1阳性细胞数较模型组减少。同时Western blot检测结果也显示,模型组大鼠卵巢组织中SOD1、UCP-2蛋白表达较对照组明显增加,经过hUCMSCs移植治疗后,SOD1、UCP-2蛋白水平较模型组明显下降,推测可能机制是UCP2通过解耦联作用改变线粒体ROS合成,从而维持线粒体生物修复及ATP合成功能,同时hUCMSCs细胞移植后能改善氧化酶系统紊乱状态,抗氧化酶SOD1使体内的ROS变为活性较低的物质,从而降低氧化应激反应,最终保护卵巢线粒体形态结构及功能的作用。
本研究结果显示,hUCMSCs治疗后,能明显修复卵巢的颗粒细胞,且SOD1和UCP-2表达水平以及ROS和8-OHDG生产量均有明显降低,因此推测hUCMSCs移植修复POF大鼠卵巢功能的作用机制可能是hUCMSCs能够降低氧化应激反应,提高体内卵巢线粒体功能,从而减轻CTX引起的卵巢损伤。
