精神分裂症模型大鼠前额叶皮质PKA和内皮细胞趋化因子-5的表达变化
2019-11-01万争艳向玲玲梅红彬董红霞
万争艳,李 宁,向玲玲,陈 莹,梅红彬,董红霞
(武汉市优抚医院,武汉 430023)
精神分裂症是一种复杂的精神病,在精神分裂症中,前额叶皮质区域中功能和结构受损,在背外侧前额叶皮层最常见[1-2]。血脑屏障高度限制血液循环和中枢神经系统之间的分子、离子和细胞的运动,以保护大脑[3]。据报道,各种神经系统疾病,包括脑缺血性中风、水肿、感染、癫痫、多发性硬化症、阿尔茨海默病和帕金森病都与血脑屏障的分解有关[4-6]。环磷酸腺苷依赖蛋白激酶(cyclic adenosine monophosphate dependent protein kinase,PKA)依赖的方式激活内皮细胞趋化因子-5(C-C motif ligand 5,CCL5)基因表达[7]。人和小鼠细胞质末端结构域中CCL5的磷酸化位点负责内皮屏障对小分子的选择性通透性增加[8]。与脑炎性病变相关的药剂阵列表明,大量的效应和反应组合可能参与调节炎症反应[9]。趋化因子是一组调节细胞结构和功能的相关的分子,参与炎症期间各种炎性细胞的表达,趋化因子通过与G蛋白偶联受体的相互作用发出信号[10]。趋化因子活化正常T细胞表达和分泌,能够诱导神经细胞中促炎介质的合成,趋化因子刺激后,调节神经细胞启动肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白细胞介素(interleukin,IL)-1,IL-17,巨噬细胞炎症蛋白(macrophage inflammatory protein,MIP)-1α,MIP-1β,MIP-2的转录[11]。因此,在本研究中,笔者建立了精神分裂症大鼠模型,观察病理损伤和前额叶皮质PKA和内皮细胞趋化因子-5表达变化,阐明其神经损伤机制,为指导临床治疗提供参考依据。
1 材料和方法
1.1 实验动物
筛选30只6~8周龄的SPF 级250 g雄性SD大鼠(购自军事医学科学院实验动物中心[SCXK-(军)2017-0004][SYXK-(军)2017-0004])饲养在带有过滤器的笼子中,实验前进行无差别饲养一周,动物设施和饲养符合动物保护原则。诱导7 d后麻醉舌下取血,处死后对脑部前额叶皮质进行病理组织镜检。注:动物使用的伦理审批号IACUC为2017-0015;实验过程中遵循3R原则。
1.2 实验方法
1.2.1 精神分裂症模型构建
为了诱导精神分裂症实验大鼠,对诱导组大鼠每日腹腔注射苯丙胺0.5 mg/kg(浓度为0.1 mg/mL,给药容量为5 uL/g),连续7 d。对照组皮下注射生理盐水。其他环境相同,建模时间持续7 d,期间记录两组大鼠的异常情况和死亡情况,本研究期间无大鼠自然死亡发生。
1.2.2 实验分组
30只实验大鼠随机分为2组:对照组(为正常饲养大鼠,皮下注射生理盐水,n=15)诱导组(每天皮下注射苯丙胺诱导脑部损伤建立精神分裂模型,n=15)[12],两组大鼠在37℃下笼中饲养。7 d后对实验大鼠进行手术处理实验。
1.2.3 通过行为学实验检测大鼠精神分裂模型的认知情况
首先对实验中的两组大鼠进行精神分裂模型检测,确保后续实验的准确性。采用Sams-Dodd刻板行为评分系统对两组大鼠进行行为学评分,根据大鼠的好动性和动态幅度大小在1~5分之间对大鼠行为进行打分计算;另外再用旷场实检验实验大鼠精神分裂模型建模成功与否,在诱导组给药7 d后,将诱导组和对照组放入约10 mm2的房间,地板划分40个等大方格,在封闭无其他因素影响的条件下记录两组大鼠的活动情况,并记录大鼠的活动的方格数,用大鼠穿越方格的数量来反映活动情况。两个实验分别单独进行,且条件相同。
1.2.4 苏木精-伊红染色病理学观察两组大鼠前额叶皮质区神经细胞核固缩阳性率[13]
麻醉处死大鼠后解剖取样,将前额叶组织置于10%的福尔马林溶液中,保持细胞原有形态。将修剪后的样本置于包埋盒中冲洗0.5 h后用一定浓度梯度的酒精进行脱水处理,然后用石蜡包埋,切成5 μm厚度的切片,烘干后进行HE染色。使用明视场显微镜(Olympus BX61,日本Olympus公司)和扫描共聚焦激光显微镜(FV1000;日本Olympus公司)检查所有样品并拍照。通过待分析区域的组织切片的z轴收集10堆0.5 μm厚的光学切片显微镜下进行镜检观察大鼠前额叶皮质区神经细胞核固缩阳性率情况,比对两组大鼠细胞受损度。
1.2.5 酶联免疫吸附试验测定大鼠血液中的蛋白激酶A的含量
使用小鼠PKA酶联免疫吸附试验试剂盒测定大鼠血液中的蛋白激酶A的含量。两组实验大鼠在空腹12个小时后进行麻醉舌下静脉取血,处死后对大鼠脑补进行解剖留样,用于后面病理切片观察。应根据试剂盒的要求选择EDTA、柠檬酸钠或作为抗凝剂,然后加入10%(v/v)抗凝剂(0.1 mol/L柠檬酸钠或1% heparin 或2.0% EDTA-Na2)混合大约15 min后,在(3000 r/min)离心机下离心20 min,收集样本上清液。然后将样品加于酶标板底部,尽量不触及孔壁,轻轻晃动混匀,加如样品时时间控制在15 min内。然后进行室温温育、洗涤。加入底物后定时观察反应孔的颜色变化,避免反应过强从而影响酶标仪光密度读数。利用小鼠(趋化因子/CCL5)试剂盒检测两组实验大鼠中的CCL5水平含量。同检测蛋白激酶A方法类似,静脉舌下取血液样本,经过离心取样、稀释、加样、温育、洗涤等步骤,通过标准曲线的回归分析计算浓度。
1.2.6 凝胶电泳和Western印迹分析
同样静脉抽取两组大鼠舌下血液样本,然后离心稀释,将离心样本放置于100 μL缓冲液(50 mmol/L HEPES,pH 7.5,150 mmol/L NaCl,2 mmol/L EDTA,2 mmol/L EGTA, 1% Triton X-100,50 mmol/L氟化钠,5 mmol/L焦磷酸钠)中。 β-甘油磷酸钠,1 mmol/L邻钒酸钠,1 mmol/L二硫苏糖醇,1 mmol/L苯基甲磺酰氟,10 μg/ mL亮抑酶肽,10 μg/ mL抑肽酶)。通过BCA蛋白质测定试剂盒(Pierce,Rockford,IL)测定全细胞提取物的含量。加入10μg样品并在10% SDS-聚丙烯酰胺凝胶上分离。转移后对于Hybond ECL,硝酸纤维素膜(Amersham Pharmacia生物技术公司,美国)在4℃下用5%牛血清白蛋白封闭过夜处理,然后用指示的抗体探测。使用适当的免疫球蛋白试剂通过增强化学发光(Amersham Pharmacia生物技术公司,美国)观察印迹。
1.2.7 逆转录反应
将1 μg经DNA酶处理的RNA等分试样与1 μL oligo dT引物(0.5 mg/mL),1 μL 10 mm dNTP和ddH2O混合以均衡所有体积样品浓度为12 μL。将混合物在65℃加热5 min,在冰上淬灭并短暂旋转,然后加入8 μL由4 μL 5×第一链缓冲液(Invitrogen),2 μL 0.1 mol/L DTT组成的Master Mix,1 μL RNase抑制剂(Invitrogen公司,美国)和1 μL Superscript II(200 μL/μL,Invitrogen)。将反应在42℃下孵育60 min,然后在70℃下孵育15 min,然后进行4℃浸泡。向每个样品(在20 μL总体积中)中加入80 μL ddH2O。将5 μL稀释的cDNA用于25 μL体积的每个PCR反应,以下引物用于小鼠CCL5 cDNA和PKA的PCR扩增。

表1 RT-PCR引物序列
1.2.8 RT-qPCR分析mRNA的表达
为了通过定量实时PCR(RT-qPCR)确定mRNA表达水平,根据制造商的方案,稀释并以几种不同浓度研究1 μg总RNA转化的cDNA样品。将稀释的cDNA与靶向小鼠CCL5、PKA或GAPDHcDNA序列的一对引物(10 μmol/L)混合,如上所述,并与15 μL体积的SYBR green PCR master mix(Applied Biosystems,CA)混合。 PCR循环如下:在50℃下2 min,在95℃下10 min进行1个循环,然后在15℃下在95℃下进行40个循环,在60℃下进行1 min进行定量实时PCR。
1.3 统计学方法

2 结果
2.1 大鼠刻板行为评分和旷场实验评分
诱导组与对照组大鼠相比刻板行为评分和旷场实验均升高,差异有统计学意义(P<0.05)。表明用苯丙胺诱导的大鼠精神分裂模型建模成功。(表2)
2.2 前额叶皮质苏木精-伊红染色
诱导组较对照组细胞阳性率占比高,两组比较差异有统计学意义(P<0.05)。诱导组前额叶椎体细胞大量核固缩,箭头指向代表固缩现象。胞浆嗜伊红染色增强,胞膜与周围分界清楚,对照组未发现诱导组此现象。(图1,表3)
2.3 PKA和CCL5 mRNA表达
与对照组相比,诱导组大鼠PKA和CCL5 mRNA表达量升高,差异有统计学意义(P<0.05)。(图2,表4)
2.4 PKA和CCL5蛋白含量检测
诱导组大鼠体内PKA和CCL5含量与对照组相比升高,差异有统计学意义(P<0.05)。(表5)
2.5 白细胞介素(IL-1α、IL-1β和IL-17)的蛋白表达检测
诱导组与对照组相比IL-1α、IL-1β和IL-17的蛋白表达均增加,促炎反应加强,两组比较差异有统计学意义(P<0.05)。(图3,表6)
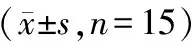
表2 大鼠刻板行为评分和旷场试验评分

图1 前额皮质的病理学改变(苏木精-伊红染色)(×200)Figure 1 Pathological changes of the rat prefrontal cortex tissues. Hematoxylin-eosin staining

表3 核固缩细胞阳性率占比

表4 PKA和CCL5基因mRNA表达量

图2 RT-qPCR检测PKA和CCL5 mRNA表达Figure 2 RT-q PCR for detection of PKA and CCL5 gene expressions

组别GroupsPKA(mmol/g)CCL5(mmol/g)对照组Control group2.46±0.671.35±0.24诱导组Induced group4.21±1.053.76±0.51t5.2213.268P0.0050.021

图3 蛋白质免疫印迹检测白细胞介素相关蛋白Figure 3 Detection of interleukin-related proteins by Western blotting

组别GroupsIL-1αIL-1βIL-17对照组Control group1.02±0.170.94±0.131.05±0.25诱导组Induced group2.85±0.352.15±0.272.16±0.32t6.7618.6435.238P0.0260.0150.003
3 讨论
精神疾病是全球最普遍和最致残的疾病之一。世界卫生组织预测,到2030年,精神疾病将成为全球疾病负担的主要原因。近年来,这些病症的临床管理几乎没有改善,因为临床医生受到当前药物制剂的次优效果和主观现象学诊断范例的阻碍,对这些疾病的发病机制和病理生理学机制的深入理解有可能为这些疾病的治疗提供改进的治疗和诊断工具[14]。细胞因子和这种神经免疫轴的炎症方面已经得到了最深入的研究,然而调节这些方面的转化和临床应用迄今还没有取得很大进展[15-16]。其他研究途径也开始探索适应性免疫细胞及其相关细胞因子在其中的作用。目前,在这些研究中相对忽略了被称为趋化因子的免疫蛋白,最近有证据表明这些蛋白质可能在与精神疾病相关的神经免疫过程中起关键作用[17]。包括以前未被认识的神经调节剂效应,直接神经递质样作用,神经内分泌轴的调节,血脑屏障渗透性的控制,神经发生的调节,神经保护作用以及轴突传递和伸长的调节[18]。
本研究通过大鼠刻板行为评分为和旷场实验发现,诱导组与对照组大鼠相比刻板行为评分和旷场实验均升高,这表明用苯丙胺诱导的大鼠精神分裂模型建模成功。本实验目的是评估前额叶皮质区PKA和CCL5在精神分裂症疾病中表达变化情况。早期证据表明趋化因子可能在精神分裂样本中被上调。该研究发现血浆CCL5在精神分裂疾病中增加,CCL5 mRNA和蛋白质在精神分裂模型前额叶组织的脑微血管系统中以更高水平表达,这可能与作为支持渗透的趋化因子相关。大多数已发表的研究,包括测量这些精神疾病中的趋化因子,都涉及到炎症性趋化因子CCL5[19]。因此,未来的工作应该考虑除炎症过程中涉及的其他趋化因子的测量。本研究发现,诱导组前额叶椎体细胞大量核固缩,箭头指向代表固缩现象。胞浆嗜伊红染色增强,胞膜与周围分界清楚,对照组未发现诱导组此现象。本研究的行为和病理反映损伤反映大鼠精神分裂模型认知功能发生障碍,其原因与前额叶椎体细胞大量核固缩死亡有关。
本研究生化研究的结果显示,与对照组相比,诱导组大鼠PKA和CCL5 mRNA表达量升高;诱导组大鼠体内PKA和CCL5含量与对照组相比升高;诱导组与对照组相比IL-1α、IL-1β和IL-17的蛋白表达均增加,促炎反应加强;诱导组较对照组细胞阳性率占比高。这说明,趋化因子在中枢神经系统的许多炎症或感染性疾病中高度表达,包括多发性硬化,实验性过敏脑脊髓炎,阿尔茨海默病,精神分裂性疾病病等[20]。尽管在这些病变中检测到几种促炎介质,但已显示趋化因子可刺激神经细胞产生这些其他介质。趋化因子降低神经性细胞内cAMP水平和PKA活性通过腺苷酸环化酶从细胞内ATP产生环状AMP,腺苷酸环化酶是一种膜结合酶,其对G蛋白活化的敏感性不同。本研究中发现诱导精神分裂症实验大鼠中的PKA和CCL5含量水平、蛋白表达都比正常组大鼠的高,说明精神分裂症状的前额叶神经细胞受到里不同程度的损伤。其中检测到白细胞介素(IL-1α、IL-1β和IL-17)的表达升高进一步表明诱导组的炎症反应加重。
综上所述,精神分裂症大鼠模型中前额叶椎体细胞大量核固缩,胞浆嗜伊红染色增强,前额叶皮质PKA和CCL5都有相应的高表达,增加炎症反应发生,在药物处理上可针对这两个指标进行靶向治疗。
