固定化Acinetobacter sp.T1细菌处理河道氨氮污染的研究
2019-10-31吴晨捷蒋庆肯蓝际荣邬建勋杜冬云
肖 尧,吴晨捷,蒋庆肯,蓝际荣,邬建勋,孙 燕,杜冬云
(中南民族大学资源与环境学院,湖北 武汉 430074)
城市生活污水中大量有机物、氨氮、硝酸盐等营养物质的长期汇入是导致我国城市河道水质恶化的主要原因[1]。进入水体的有机物和氨氮等营养物质大部分会经过一系列物理、化学和生物作用富集于底泥中,成为内源污染物[2],因此,对城市河道及底泥中氨氮的控制与去除受到广泛关注。微生物法被认为是高效且最经济的处理方法,部分学者利用固定化微生物法取得了较好的修复效果[3-4],但部分固定化方法较为复杂[5],或需要用特制的装置来达到修复目的[6],所以开发具有经济性、生物负载量高、稳定性高、保存和使用方便的固定化微生物方法具有重要的实际意义。
异养硝化-好氧反硝化(HN-AD)细菌生长快速,能将NH4+-N直接转化为N的气态产物排出[7],极具应用前景。吸附固定化微生物法过程简单经济,反应温和,不会破坏微生物的细胞结构[8]。吸附法固定微生物细胞时pH值、载体的性质等均影响细胞与载体之间的相互作用。只有当载体的特征、细胞的性质及细胞与载体间的相互作用等参数配合恰当时才能形成稳定的固定化微生物[9]。目前部分学者使用吸附法对生物量进行固定化时先将菌悬液离心,去其培养基,用蒸馏水再悬浮后,加入载体进行吸附。该方法仅研究了载体对微生物的吸附作用,并未考虑微生物的繁殖生长过程,鲜有固定化过程中环境因素对固定化效果影响的报道。
从经济、环保的角度考虑,通过优化吸附法,对1株已经筛选分离出的具有高效异养硝化和好氧反硝化(HN-AD)能力的细菌Acinetobactersp. T1进行固定化,该细菌能以铵、硝酸盐或亚硝酸盐为唯一氮源,具有高效的异养硝化和好氧反硝化能力。优化吸附法考虑了微生物吸附在载体后生长繁殖的过程以及环境因素对于此微生物固定化效果的影响,从活性炭、硅藻土、沸石中筛选出合适的固定化载体,探究最优的微生物固定工艺参数(温度、摇床转速、pH值、固定时间),提高载体上固定的细菌数量。并利用固定化细菌T1进行模拟修复实验,探究固定化细菌T1对受污染的城市河道及底泥的修复效果,为HN-AD细菌Acinetobactersp. T1在环境污染治理中的应用提供新的途径和技术支持。
1 材料与方法
1.1 培养基
1.1.1富集培养基
用于富集细菌的培养基包含以下部分:2.042 g·L-1二水合柠檬酸三钠,0.236 g·L-1硫酸铵,1 g·L-1磷酸二氢钾,1.31 g·L-1三水合磷酸氢二钾,0.2 g·L-1无水硫酸镁,0.043 6 g·L-1七水合硫酸亚铁,pH=7.5,高温高压灭菌后用于培养细菌。
1.1.2固定化培养基
用于固定细菌的培养基包含以下部分:4.084 g·L-1二水合柠檬酸三钠,0.472 g·L-1硫酸铵,1 g·L-1磷酸二氢钾,1.31 g·L-1三水合磷酸氢二钾,0.2 g·L-1无水硫酸镁,0.043 6 g·L-1七水合硫酸亚铁。根据后续需要调节pH值及灭菌。
1.2 实验分析仪器及方法
固定化载体比表面积、孔径、孔容采用比表面积与孔径分布测试仪(精微高博JW-BK132F)测定;载体表面Zeta电位采用纳米粒度及电位分析仪(马尔文ZEN3690)测定。固定化载体的生物量是评价固定化微生物最直接、有效的指标,一般以1 g载体中所附着的细胞个数来表示。该研究中载体上的生物量根据文献[10](磷脂法)测定,结果以nmol·g-1(以P计)载体材料表示,1 nmol P相当于108个大肠杆菌(Escherichiacoli)大小的细胞。
1.3 固定化细菌的制备
1.3.1最适载体的选择
将硅藻土、沸石、活性炭用蒸馏水浸泡洗去杂质,风干后研磨过425 μm孔径筛,灭菌后加入固定化培养基待用,筛选出最合适的固定化载体。将冻存管中细菌T1以φ=1%的接种量接种于富集培养基,放置于35 ℃、120 r·min-1的恒温振荡器,24 h后细菌生长至对数期,再以φ=10%的接种量接种于加有10 g载体的100 mL固定化培养基,调节pH值为7后进行固定化。固定化结束后,抽滤使载体与培养基固液分离,取固体风干后置于4 ℃条件下存放,即为固定化细菌。
分别取活化菌悬液和以硅藻土、活性炭、沸石为载体制备的固定化细菌以及未进行固定化的硅藻土、活性炭、沸石各0.1 g用以测得初始生物量;同时再各取1 g加入100 mL固定化培养基,于35 ℃、120 r·min-1条件下反应24 h,反应结束后取液体离心测量计算各材料对固定化培养基中氨氮的去除率,实验重复3次。
1.3.2固定条件的优化
通过单因素实验,探究不同温度(20、25、30、35、40 ℃)、pH值(5、6、7、8、9)、摇床转速(60、90、120、150、180 r·min-1)、固定化时间(6、12、18、24、30 h)对固定化效果的影响。
取0.1 g固定化细菌测其单位质量上固定的生物量;取1 g固定化细菌加入100 mL固定化培养基,于35 ℃、120 r·min-1条件下反应24 h,将液体于7 060 r·min-1(离心半径为10 cm)离心15 min后计算氨氮去除率,实验重复3次。
1.4 固定化细菌T1的循环使用实验
取1 g最佳条件下制备的固定化细菌T1加入100 mL固定化培养基,于35 ℃、120 r·min-1的条件下反应24 h,反应结束后将固定化细菌与培养基分离,再次加入新的100 mL固定化培养基,以相同的条件重复5次。氨氮去除率计算方法同上,设置3组平行实验同时进行。
1.5 去除城市河道及底泥中氨氮的模拟实验
水样和底泥取自郑州市如意湖(位于河南省郑州市郑东新区如意湖景区文化广场),采样方法按照HJ 474—2009《水质采样技术指导》,选取湖面以及河道共8个具有代表性的取样点。水样使用有机玻璃采样器于水深1.5 m处采集,泥样采用柱状取泥器于水深3 m处采集,分别混合均匀后用聚四氟乙烯瓶避光冷藏。
由于河道上游排污的间歇性和不确定性以及降水因素的影响,导致水体污染物浓度波动较大。调查发现河道水体的主要污染物来自于城市生活污水,为了保证实验结果的可重复性,采用人工配置污水代替实际污水进行实验。根据文献[6,11-12],微污染的城市水体COD约为42~58 mg·L-1,ρ(氨氮)约为8~20 mg·L-1,而生活污水COD约为125~280 mg·L-1,ρ(氨氮)约为52~79 mg·L-1。为了应对生活污水大量排入城市河道,导致河道内水质进一步恶化等情况,向实际水体中加入葡萄糖、氯化铵、硝酸钾、亚硝酸钠,将水体COD、ρ(NH4+-N)、ρ(NO3--N)、ρ(NO2--N)分别调节至100、40、10 和0.5 mg·L-1,将底泥加入实验装置,再缓缓加入上覆水体,静置后采用分光光度法测得水体COD、ρ(NH4+-N)、ρ(NO3--N)、ρ(NO2--N)、ρ(TN)的初始值分别为100.92、36.78、12.30、0.53和55.34 mg·L-1,采用燃烧氧化-非分散红外吸收法测得底泥初始w(TOC)为21.94 g·kg-1,采用凯氏法测得底泥初始w(TN)为3.30 g·kg-1。
采用室内模拟方法,设置3组平行实验同时进行。实验装置参照文献[13],为高0.15 m、半径0.06 m的圆柱形玻璃缸,有效体积为1 L。装置表面具有刻度标记,底部装填0.2 L底泥及0.6 L上覆水,控制气泵曝气流量为0.28 L·min-1以避免底泥扰动,实验期间水温保持在24~26 ℃。
装置放于靠窗位置,保证通风、光照等,实验开始后用黑色塑料袋包裹在装置底部,尽可能模拟城市河道的自然条件。实验组分为空白组、曝气组、曝气辅助菌悬液组、曝气辅助固定化细菌组。实验开始后投加相同质量(5 g)的固定化细菌及菌悬液,间隔1 d测上覆水体各项指标,共取8次;间隔3 d取底泥测量TOC、TN含量等指标,共取4次,16 d后测量底泥体积的变化。
2 结果与讨论
2.1 载体的物理性质
一般来说,吸附法固定细菌主要是载体与细菌间产生物理吸附的结果,主要受到载体比表面积、孔径、孔容、表面电位等因素的影响[14]。仪器测得活性炭、硅藻土和沸石的比表面积、平均孔径及总孔体积数据(表1)。
表1 载体的比表面积、平均孔径和总孔体积
Table 1 Carrier specific surface area, average pore size and total pore volume
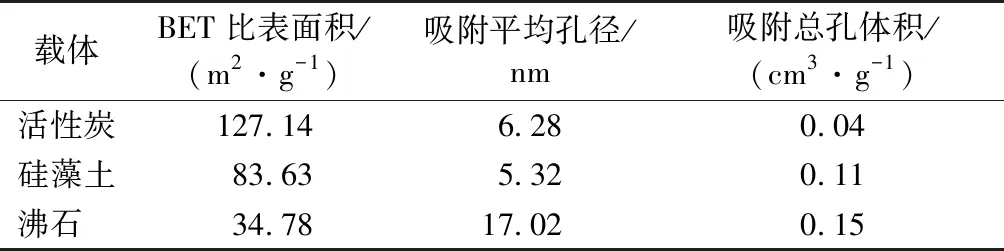
载体BET比表面积/(m2·g-1)吸附平均孔径/nm吸附总孔体积/(cm3·g-1) 活性炭127.146.280.04 硅藻土83.635.320.11 沸石 34.7817.020.15
一般来说,载体比表面积越大,越有利于微生物的附着。硅藻土、沸石、活性炭在比表面积、孔径、孔体积等方面差异较大,硅藻土和活性炭的比表面积明显大于沸石。沸石和硅藻土的总孔体积相差不大,分别为0.15和0.11 cm3·g-1;活性炭总孔体积最小,仅为0.04 cm3·g-1。沸石的平均孔径为17.02 nm,大于活性炭与硅藻土。载体材料表面的细孔可分为3类:微孔(<2 nm)、介孔(2~50 nm)、大孔(>50 nm),3种载体材料的平均孔径均在2~50 nm之间,其表面均以介孔结构为主。孔隙结构有助于细菌附着,一般细菌的长度为1~5 μm,虽无法进入载体的介孔,但细菌分泌的酶能进入载体材料的孔隙结构。
从图1可以看出,3种载体材料表面都呈负电性。由于一般细菌表面也呈负电荷,载体与细菌间的静电力作用呈相互排斥的效果;3种材料的表面电荷随着pH值的升高而降低,当固定化培养基的pH值调为8时最适于细菌T1的生长,此时硅藻土表面电位为-26.80 mV,大于活性炭和沸石的表面电位。由于pH=8时硅藻土的表面电位负值较小,细菌与载体间的静电排斥力较低,更容易使细菌附着。
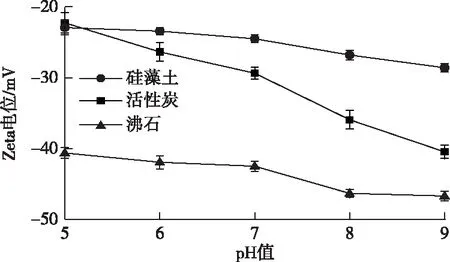
图1 不同pH值条件下各载体的Zeta电位Fig.1 Zeta potential of different carriers under different pH values
2.2 最佳载体的选择
不同载体固定化实验结果见图2。未检测到活性炭、硅藻土、沸石的初始生物量,但活性炭、硅藻土、沸石均对氨氮有一定的吸附作用,其氨氮去除率分别为1.83%、73.92%和31.72%,经固定化后活性炭、硅藻土、沸石的初始生物量分别为1.47×109、1.93×109和4.00×105g-1,氨氮去除率提高至84.31%、98.17%和33.10%。菌悬液的初始生物量为1.72×109g-1,氨氮去除率为86.52%。以硅藻土为载体的固定化细菌与菌悬液相比,前者生物量更大,处理24 h后氨氮去除率增加了11.65%;以硅藻土为载体的固定化细菌与未经过固定化的硅藻土相比,处理24 h后氨氮去除率增加了24.25%。以活性炭为载体的固定化细菌生物量和氨氮去除率与投加菌悬液相比差别不大,但与未经过固定化的活性炭相比有较大提升。以沸石作为载体的固定化细菌生物量较小,且固定化后氨氮去除率仅为33.10%,与未固定化的沸石相比去除率变化不大。这是由于硅藻土具有较大的比表面积和较高的Zeta电位,有利于细菌的吸附固定。以硅藻土为载体的固定化细菌具有较高的生物量与氨氮去除率,由此可见硅藻土是最适合细菌T1的固定化载体。
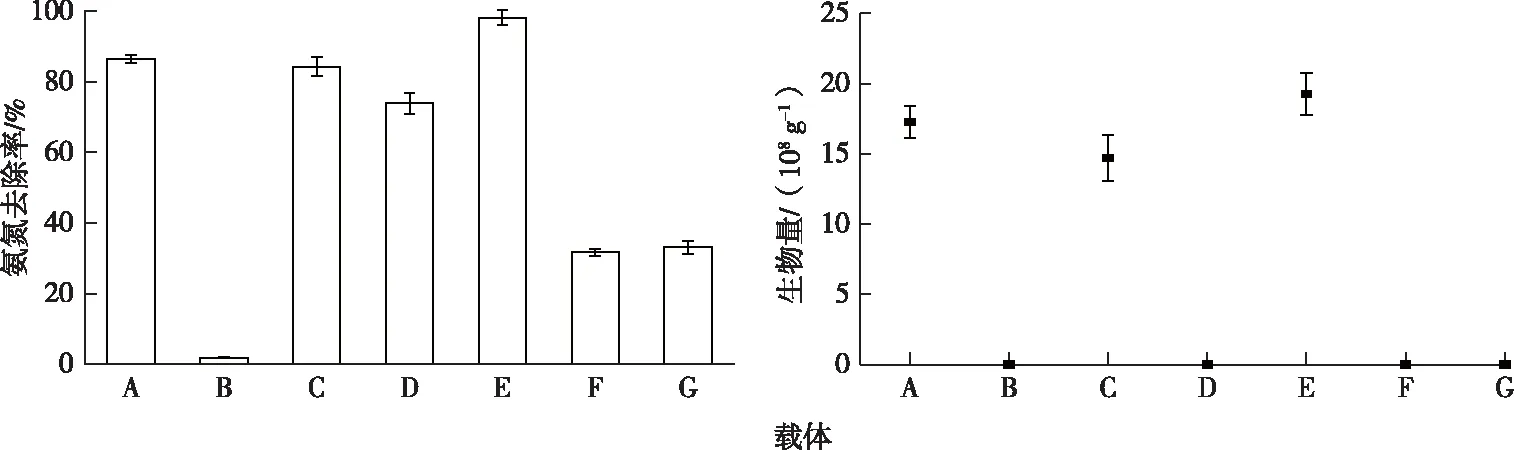
A—菌液;B—活性炭;C—以活性炭为载体的固定化细菌T1;D—硅藻土; E—以硅藻土为载体的固定化细菌T1;F—沸石;G—以沸石为载体的固定化细菌T1。图2 不同载体对固定化的影响Fig.2 Effect of different carriers on immobilization
2.3 最佳固定化条件
2.3.1温度对固定化的影响
固定化过程中温度对固定化的影响如图3所示。可以看出温度对固定化效果的影响很大,当温度为35 ℃时载体上固定的细菌数量最多,达到1.93×109g-1,是20 ℃时的13.40倍;35 ℃时所制备的固定化细菌的氨氮去除效率为94.60%,是20 ℃时的1.76倍。这是因为在最适温度下细菌的生长速率最高,代谢稳定,活力较好,更容易附着在载体上。因此,固定化过程中最佳的温度为35 ℃。
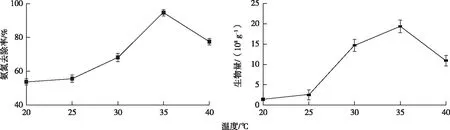
图3 温度对固定化的影响Fig.3 Effect of temperature on immobilization
2.3.2pH值对固定化的影响
固定化培养基的初始pH值对固定化的影响如图4所示。pH值对固定化有较大影响,碱性环境下载体上固定的细菌数量较多,所制备的固定化细菌对氨氮的去除率较高。当pH值为8时载体所固定的细菌数量最多,为1.86×109g-1,是pH值为5时的5.54倍,且该条件下制备的固定化细菌的氨氮去除率最高,是pH为5时的1.81倍。这是因为pH值影响细菌的酶促反应、代谢速率和生长速率,且环境pH值的改变也会影响载体表面Zeta电位(图1)。随着pH值升高,固定化环境逐渐变为碱性,更适合T1细菌生长。此时细菌的活性较高,代谢较旺盛,有利于吸附固定于载体上。但pH值过高时又会对固定化产生负面作用。因此固定化过程中最佳的pH值为8。
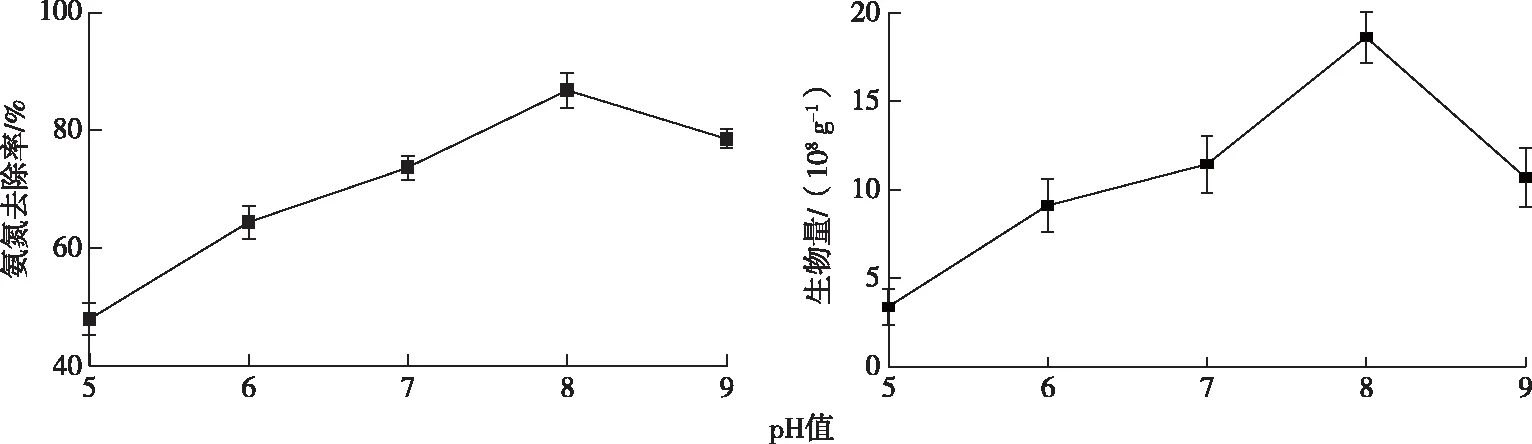
图4 pH值对固定化的影响Fig.4 Effect of pH value on immobilization
2.3.3摇床转速对固定化的影响
固定化过程中,摇床转速对固定化的影响如图5所示。当摇床转速为90 r·min-1时载体固定的细菌数量较多,为1.74×109g-1;且制备出的固定化细菌对氨氮的去除率较高,为82.47%。摇床转速太低,溶解氧不足,影响细菌的生长发育,固定化微生物量也较低;摇床转速太高,虽有充足的溶解氧,但加大了细菌与载体间的摩擦,不利于固定,因此固定化过程中最佳的摇床转速为90 r·min-1。
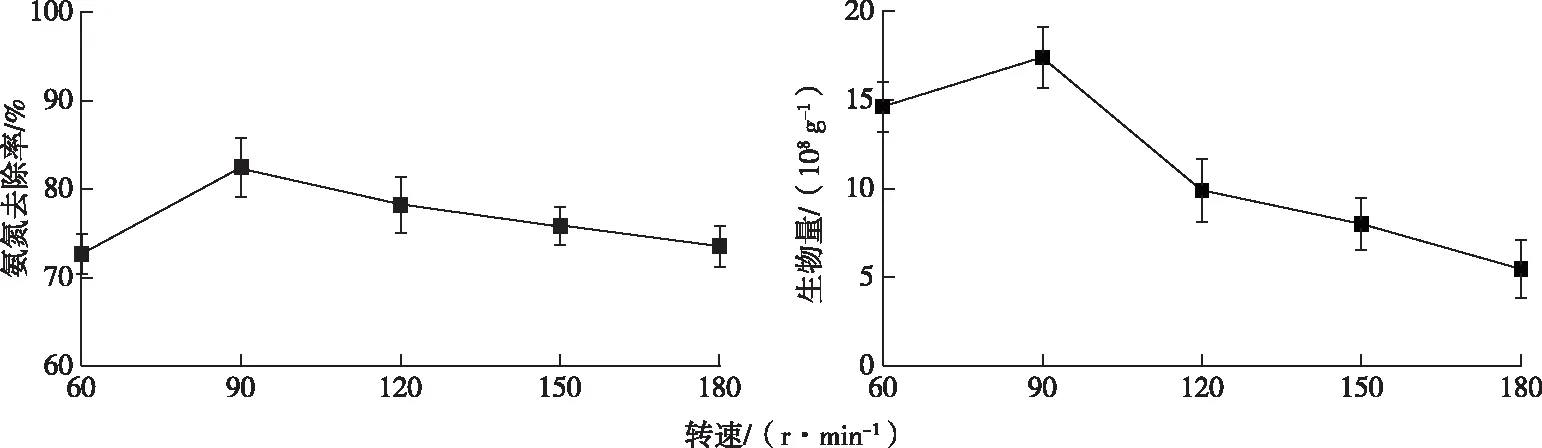
图5 摇床转速对固定化的影响Fig.5 Effect of rotation speed on immobilization
2.3.4时间对固定化的影响
固定化时间对固定化的影响如图6所示。固定化时间较短时只有接种时吸附的细菌,随着时间的增加细菌开始大量繁殖,达到对数期时载体固定的细菌数量与所制备的固定化细菌对氨氮的去除率均达到较高水平。当固定化时间为24 h,固定细菌数量为1.90×109g-1时氨氮去除率为92.41%。
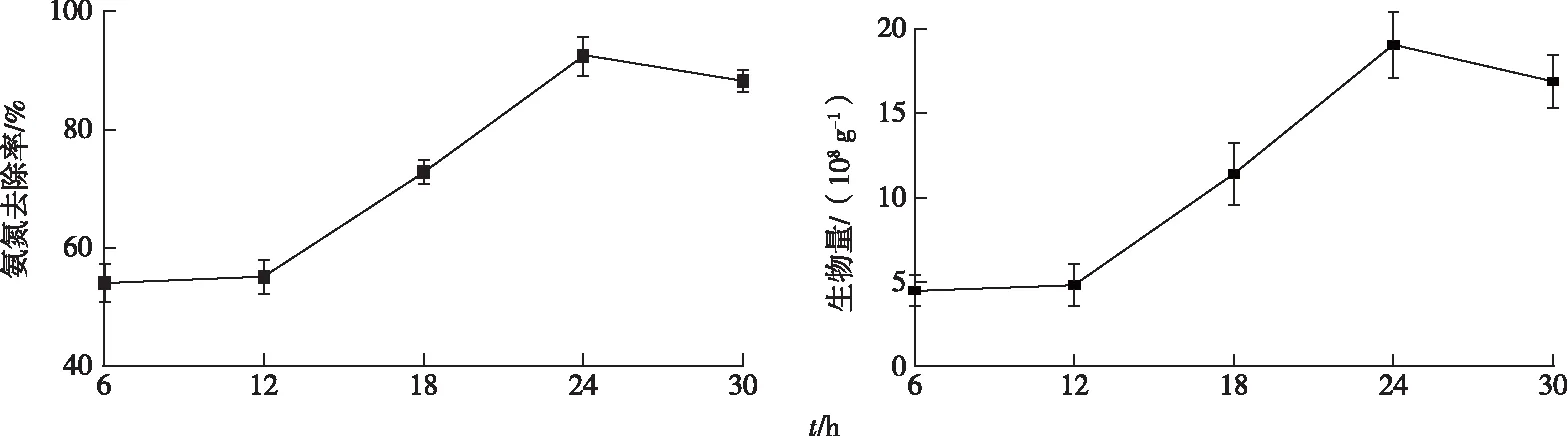
图6 时间对固定化的影响Fig.6 Effect of time on immobilization
当固定化时间超过24 h,细菌进入衰亡期,活性较差,不利于固定,细菌数量与固定化细菌的氨氮去除率有所减少。因此,固定化过程中最佳的时间为24 h。
由此可见,固定化细菌制备过程中温度、pH值等环境的变化影响着载体上固定细菌的数量,进而影响所制备出的固定化细菌对模拟废水中氨氮的去除效果。当细菌处于最适易生长条件时大量繁殖,代谢旺盛,分泌大量胞外物质,有利于粘附在载体表面[15],此时载体上固定的细菌数量最多,所制备出的固定化细菌对氨氮的去除率最大。最佳条件下制备出的固定化细菌T1循环使用5次后仍具有较高的氨氮去除率(93.46%),初步表明该固定化细菌稳定性较好,使用寿命较长。
2.4 模拟实验中的氨氮去除效果
为模拟固定化细菌T1去除河道及底泥中氨氮的效果,对比了空白组(A)、曝气组(B)、曝气辅助菌悬液组(C)和曝气辅助固定化细菌组(D)的修复效果,所用的固定化细菌为以下条件制得:硅藻土为载体,温度为35 ℃,pH=8,转速为90 r·min-1,时间为24 h。
2.4.1模拟实验中水体的变化情况
图7为上覆水体COD、NH4+-N、NO2--N、NO3--N、TN浓度的变化情况。
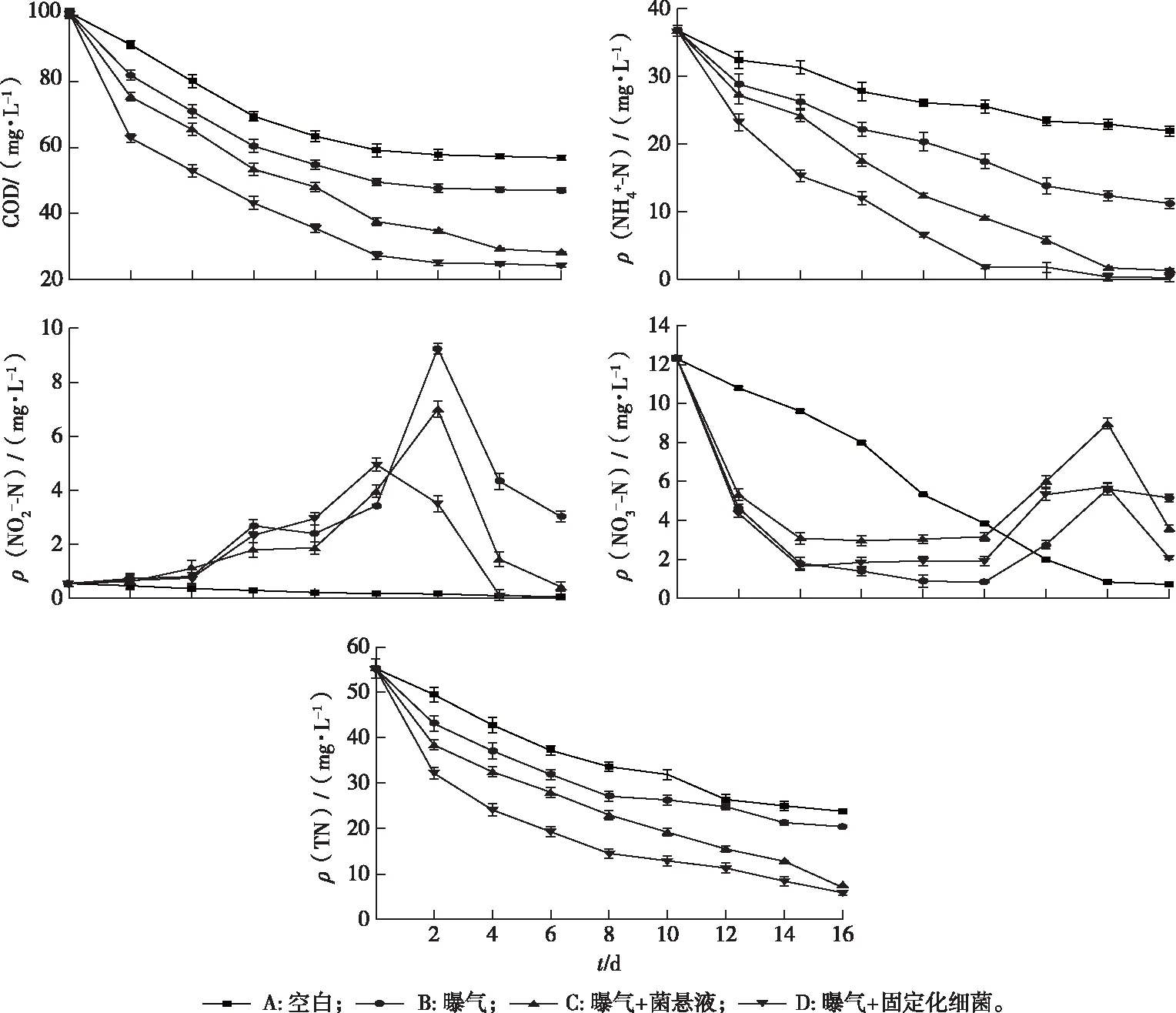
图7 上覆水中COD、NH4+-N、NO2--N、NO3--N和TN浓度的变化情况Fig.7 Changes of COD, NH4+-N, NO2--N, NO3--N and TN concentrations in overlying water
4组COD、NH4+-N、TN浓度均呈现下降趋势。不同的是进行曝气的B、C、D组均出现了NO2--N和NO3--N的积累。随着反应的进行,水体中的NO2--N逐渐增加,而NO3--N则呈现先下降后增加的变化,NO2--N和NO3--N的增加是由于曝气激活了底泥中的土著微生物,加强了硝化过程,NH4+-N被氧化为NO2--N或NO3--N。投加细菌T1的C、D组NO2--N、NO3--N少量积累后快速下降,推测发生了反硝化反应。而B组中NO2--N、NO3--N的量变化较小,表明曝气可能抑制了土著微生物的厌氧反硝化作用。C、D组观察到的反硝化现象是由于TI菌株具有好氧反硝化的能力,而土著微生物没有好氧反硝化的能力。从TN的变化也可以看出,投加细菌T1的C、D组的TN去除率远远高于A、B组,细菌T1可以将NH4+-N转化为N的气态产物排出,且根据细菌T1的特性推测其脱氮途径为NH3→NH2OH→N2。相比较而言,虽然C组和D组各指标总体去除效果相差不大,但D组的去除效率明显较快,且D组在去除COD、NH4+-N、NO2--N、NO3--N、TN方面均具有显著的修复效果,反应16 d后D组上覆水体中COD由100.92 mg·L-1下降至24.24 mg·L-1,去除率为75.98%;ρ(NH4+-N)由36.78 mg·L-1下降至0.25 mg·L-1,去除率为99.32%;ρ(TN)由55.24 mg·L-1降至5.87 mg·L-1,去除率为89.36%。
2.4.2模拟实验中底泥的变化情况
图8为底泥TOC和TN含量的变化情况,B、C、D组对上覆水体和底泥均具有较好的修复效果。D组对底泥TOC、TN以及底泥体积的修复均较为显著,16 d底泥中w(TOC)由21.94降为9.97 g·kg-1,去除率为54.56%;w(TN)由3.30降为1.82 g·kg-1,去除率为44.84%。投加固定化细菌 T1的D组在底泥TOC、TN的去除方面均表现为8 d前去除效果比8 d后慢,这可能是由于8 d前上覆水体中碳源、氮源较为丰富,且细菌会优先利用结构简单的物质。此阶段细菌生长代谢所需要的营养物质大部分来源于上覆水体,少部分来源于底泥。随着上覆水体中营养物质的消耗,细菌生长代谢所需要的营养物质开始转变为以底泥中的营养物质为主。第12天C组也观察到类似的现象,表明投加相同质量的固定化细菌比菌悬液能更快达到修复目的。
随着反应的进行,底泥上部分出现浅色氧化层且总体积减少,为了便于读数和减少多次取样造成的误差,仅考查了初始和末尾的变化情况,16 d后统计各点刻度以计算平均数的方式记录(表3)。
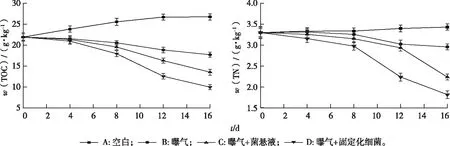
图8 底泥中TOC和TN含量的变化情况Fig.8 Changes of TOC and TN contents in the sediment
表3 底泥体积的变化情况
Table 3 Changes in sediment volume

组别初始总体积/cm3氧化层体积增加量/cm3总体积减少量/cm3总体积去除率/% 空白200 曝气辅助菌20039.56±1.0524.87±0.7512.43 曝气20042.50±1.2128.26±0.5614.13 曝气辅助固定化细菌20043.75±1.1229.86±0.6314.93
A组底泥总体积与氧化层体积均无明显变化,氧化层增加表明底泥中有机物质逐渐减少,底泥逐渐无机化。从底泥氧化层变化的情况可以看出,D组氧化层增加43.75 cm3,与C组相差不大,但均大于B组。对底泥总体积的去除显示出类似的规律,C、D组相差不大,总体积去除率分别为14.13%和14.93%,均大于B组,表明投加细菌T1对底泥的减量化有积极作用。
对照图7和图8可以看出, A组水体中的COD、NH4+-N、NO2--N、NO3--N、TN浓度的下降导致底泥中TOC、TN含量增加,表明在一定限度内底泥可以对上覆水体富营养物质的污染起到缓冲作用,但会加剧底泥自身的污染,可以推测也是由于此原因各组上覆水体中NO3--N浓度在0~4 d呈下降趋势。对比未做处理的空白组,曝气激活土著微生物产生硝化作用,对上覆水体COD、NH4+-N和底泥中TOC、TN有较良好的去除效果,但由于缺乏反硝化作用,上覆水体中会产生NO2--N和NO3--N的积累,NO2--N和NO3--N又会转移到底泥中,使得上覆水体和底泥中TN去除效果并不明显,而投加细菌T1可以弥补这一不足,使上覆水体中COD、NH4+-N、NO2--N、NO3--N、TN浓度及底泥中TOC、TN含量显著下降,固定化细菌则可以更快达到修复目的。
3 结论
(1)硅藻土因比表面积较大、空隙结构丰富,Zeta电位较高,有利于细菌T1的附着;同时硅藻土本身对氨氮具有一定吸附作用,经过固定化细菌T1后,构成细菌与载体的协同作用,加强了对氨氮的去除能力。
(2)细菌T1固定化的最佳条件:温度为35 ℃、pH值为8、摇床转速为90 r·min-1、固定时间为24 h;此时载体上吸附固定的细菌数量最多,所制备的固定化细菌对氨氮的去除率最高,且稳定性好,使用寿命长。
(3)模拟实验结果表明曝气辅助固定化细菌T1对水体及底泥中氨氮具有最好的去除效果:对水体COD去除率为75.98%、NH4+-N去除率为99.32%、TN去除率为89.36%;对底泥TOC去除率为54.56%、TN去除率为44.84%,底泥体积减少14.93%。
