中央型小细胞肺癌与鳞癌CT纹理分析参数特征比较
2019-09-29龚恩惠周永进李露曹卓
龚恩惠 周永进 李露 曹卓
[摘要] 目的 運用基于CT图像的纹理分析方法比较中央型小细胞肺癌和鳞癌量化参数特征。 方法 回顾性分析64例经病理证实的中央型肺癌(鳞癌49例,小细胞肺癌15例)患者资料,将所有患者分为小细胞肺癌组(SCLC组)、中高分化鳞癌组(SCC-A组)和低分化鳞癌组(SCC-B组)。患者均于治疗前行常规CT平扫和增强扫描,对肿瘤实质部分勾画感兴趣区域(ROI),利用后处理软件分别计算相应的纹理参数平均值、峰度值、偏度值及不均质度值。采用单因素方差分析(one-way ANOVA)或Kruskall-Wallis H检验比较三组肺癌平扫和增强CT纹理参数的差异,并对有统计学差异的参数值绘制受试者操作曲线(ROC),计算相应临界值的敏感度、特异度及曲线下面积(AUC)。 结果 平扫和增强SCC-A组不均质度值明显高于SCLC组和SCC-B组,峰度值明显低于SCLC组和SCC-B组,差异有统计学意义(P<0.05)。ROC结果显示,平扫图像:鉴别SCC-A组与SCLC组和SCC-A组与SCC-B组,不均质度值和峰度值的AUC分别为0.851(95%CI:0.711~0.940)、0.786(95%CI:0.646~0.890)、0.772(95%CI:0.621~0.885)、0.703(95%CI:0.556~0.825);增强图像:鉴别SCC-A组与SCLC组和SCC-A组与SCC-B组,不均质度值和峰度值的AUC分别0.906(95%CI:0.779~0.973)、0.831(95%CI:0.697~0.923)、0.862(95%CI:0.725~0.947)、0.745(95%CI:0.600~0.859)。 结论 平扫和增强CT纹理参数峰度值和不均质度值可有效鉴别小细胞肺癌与中高分化鳞癌以及中高分化鳞癌与低分化鳞癌,可以提供比平均CT值更多的量化信息,有助于为临床提供更多鉴别二者的定量信息。
[关键词] 计算机断层影像;纹理分析方法;小细胞肺癌;鳞癌
[中图分类号] R730.44;R734.2 [文献标识码] A [文章编号] 1673-9701(2019)21-0013-04
Comparison of parameters of CT texture analysis between central small cell lung cancer and squamous cell carcinoma
GONG Enhui1 ZHOU Yongjin2 LI Lu1 CAO Zhuo1
1.Department of Respiratory, Lishui People's Hospital in Zhejiang Province, Lishui 323000, China; 2.Department of Radiology, Lishui Central Hospital in Zhejiang Province, Lishui 323000, China
[Abstract] Objective To compare the quantitative parameters of central small cell lung cancer and squamous cell carcinoma using CT image-based texture analysis. Methods The data of 64 patients with pathologically confirmed central lung cancer(49 cases of squamous cell carcinoma, 15 cases of small cell lung cancer) were retrospectively analyzed. All the patients were divided into small cell lung cancer group(SCLC group), moderately and highly differentiated squamous cell carcinoma group(SCC-A group) and poorly differentiated squamous cell carcinoma(SCC-B group). All patients underwent routine CT scan and enhanced scan before treatment, and the region of interest(ROI) was delineated in the parenchyma of the tumor. The post-processing software was used to calculate the mean, kurtosis, skewness and inhomogeneity of the corresponding texture parameters. One-way ANOVA or Kruskall-Wallis H test was used to compare the differences between the routine CT scan and enhanced CT texture parameters of the three groups of lung cancer. And the receiver operating curve(ROC) was plotted against the statistically significant parameter values. The sensitivity, specificity, and area under the curve(AUC) of the corresponding threshold were calculated. Results The level of heterogeneity in the routine CT scan and enhanced CT SCC-A group was significantly higher than that in the SCLC group and the SCC-B group. The kurtosis value of SCC-A group was significantly lower than that in the SCLC group and the SCC-B group(P<0.05). The ROC results showed that the in the routine CT scan image, the AUC of the heterogeneity value and the kurtosis value of identifying SCC-A group and SCLC group and SCC-A group and SCC-B group was 0.851(95%CI:0.711-0.940),0.786(95%CI:0.646-0.890)、0.772(95%CI:0.621-0.885),0.703(95%CI:0.556-0.825)respectively. In enhanced CT image, the AUC of the heterogeneity value and the kurtosis value of identifying SCC-A group and SCLC group and SCC-A group and SCC-B group, were 0.906(95%CI: 0.779-0.973), 0.831(95%CI: 0.697-0.923), 0.862(95%CI: 0.725-0.947), 0.745(95%CI: 0.600-0.859), respectively. Conclusion The results show that the routine and enhanced CT texture parameters kurtosis and heterogeneity values can effectively identify small cell lung cancer and moderately, well differentiated squamous cell carcinoma as well as moderately well differentiated squamous cell carcinoma and poorly differentiated squamous cell carcinoma, which can provide more quantifying information than the average CT value. And it helps to provide more quantitative information about the two methods.
[Key words] Computed tomography; Texture analysis; Small cell lung cancer; Squamous cell carcinoma
肺癌已成为临床上最常见的恶性肿瘤之一,严重危及人类生命。中央型肺癌(central lung cancer,CLC)是起自三级支气管以内的肺癌,病理类型尤以鳞癌(squamous cell carcinoma,SCC)和小细胞癌(small cell lung cancer,SCLC)居多[1]。目前临床上主要以螺旋CT作为筛查和诊断中央型肺癌的首选检查方法,而中央型SCC与SCLC两者在影像学鉴别诊断上存在一定的困难。既往多项研究已从形态学上对二者的鉴别进行定性分析。而采用CT纹理分析方法进行定量分析的研究尚少。CT纹理分析可以通过计算病灶范围内的CT值分布特征及图像灰度纹理特征来描述肿瘤异质性,由此可以对不同的肿瘤组织及同一肿瘤的分化程度进行区分。目前已有较多研究用于肺癌的分化程度的评估[2,3],而对不同类型的中央型肺癌中小细胞肺癌与鳞癌的定量评估的研究尚少。因此,本研究的目的旨在通过回顾性分析经病理证实的中央型小细胞肺癌与鳞癌,比较二者的CT纹理参数特征,以期为临床提供更多定性分析之外的定量信息。
1 资料与方法
1.1 一般资料
回顾性分析我院2015年1月~2018年1月间64例中央型肺癌患者。包括鳞癌和小细胞型肺癌,其中鳞癌分为中高分化鳞癌组(SCC-A)和低分化鳞癌组(SCC-B),SCC-A组29例,平均年龄(63.62±7.18)岁,SCC-B组20例,平均年龄(64.45±6.04)岁;小细胞肺癌组(SCLC)15例,平均年龄(54.27±8.87)岁。鳞癌的分期依据AJCC癌症分期标准[4],小细胞肺癌以临床上最常用的美国退伍军人医院分期系统为标准[5],鳞癌患者为ⅡA~ⅢB期,小细胞肺癌患者为局限期。纳入标准:①所有患者均行胸部增强CT检查;②患者经病理诊断(穿刺活检、支气管镜或手术)证实为鳞癌或小细胞肺癌;③所有患者检查前均未接受过任何放疗、化疗、免疫治疗及介入治疗。排除标准:①肺癌所致明显阻塞性肺炎遮盖原发肿块者;②远处转移者。
1.2 检查方法
采用 Philips 256层螺旋 CT行胸部平扫和增强扫描,患者取仰卧位,双手上举,深吸气后摒气扫描,扫描范围包括整个肺部,扫描参数:管电压为120 kV,管电流为250 mAs,螺距为1.0,矩阵512×512,视野 280×400 mm,重建层厚5 mm。采用非离子碘对比剂碘海醇(每毫升含碘 300 mg)80~100 mL经肘静脉注射,速率 3.5 mL/s,追加生理盐水 30 mL。行动脉期及静脉期扫描,动脉期为注射造影剂后25 s开始扫描,静脉期为动脉期完成后30 s开始扫描。所有扫描图像自动传入PACS系统。
1.3 图像分析
选择平扫和增强Ⅱ期图像进行数据分析,使用FireVoxel(http://cai2r.net/)后处理软件获取纹理分析参数,包括平均图像灰度值、偏度值(Skewness)、峰度值(Kurtosis)、不均质度值(Inhomogeneity),将平均灰度值通过公式HU(Hounsfield Unit)=pixel value×slope+intercept转换成平均CT值[6]。由2名具有肺癌诊断经验的医生独立勾画感兴趣区域(region of interest,ROI),于纵隔窗选择病灶横断面最大层面,沿病灶轮廓边缘勾画ROI,平扫和增强Ⅱ期图像ROI尽可能置于相同区域,最后将所得结果以Excel形式导出进行分析。见封三图1。
1.4 统计学方法
采用SPSS 23.0软件进行统计学处理,利用Shapiro-Wilk对各组纹理参数值进行正态性检验。符合正态分布的参数以(x±s)形式表示,不符合正态分布的参数以M(P25,P75)形式表示。运用单因素方差分析(one-way ANOVA)或Kruskall-Wallis H检验,LSD(Least-significant difference)或Nemenyi法进行参数间两两比较。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)确定小细胞肺癌与中高分化鳞癌、中高分化鳞癌与低分化鳞癌间的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 三组平扫及增强Ⅱ期各参数比较
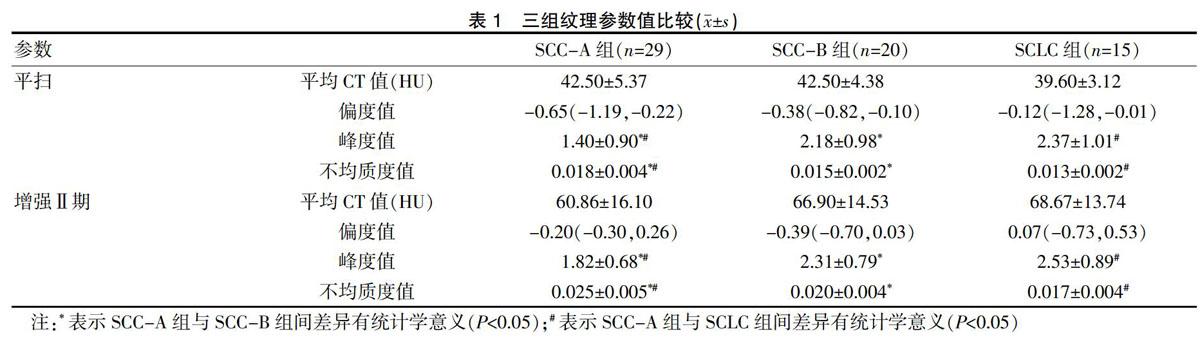
平扫、增强Ⅱ期SCLC组与SCC-B组的峰度值大于SCC-A组,不均质度值小于SCC-A组,差异有统计学意义(P<0.05);SCC-B组与SCLC组间参数无明显统计学差异(P>0.05);平均CT值、偏度值参数在三组间差异无统计学意义(P>0.05)。见表1。
2.2 三组纹理参数ROC曲线分析
平扫CT 图像不均质度值、峰度值能鉴别SCC-A组与SCLC组的敏感度为96.6%、71.7%,特异度为73.3%、100.0%,曲线下面积分别为0.851(95%CI:0.711~0.940)、0.772(95%CI:0.621~0.885);鉴别SCC-A组与SCC-B组敏感度为93.1%、61.4%,特异度为60.0%、95.0%,曲线下面积分别为0.786(95%CI:0.646~0.890)、0.703(95%CI:0.556~0.825)。增強Ⅱ期图像不均质度值、峰度值能鉴别SCC-A组与SCLC组的敏感度为96.6%、79.3%,特异度为90.0%、86.7%,曲线下面积分别为0.906(95%CI:0.779~0.973)、0.862(95%CI:0.725~0.947);鉴别SCC-A组与SCC-B组参数不均质度值、峰度值敏感度为96.6%、89.7%,特异度为60.0%、55.0%,曲线下面积分别为0.831(95%CI:0.697~0.923)、0.745(95%CI:0.600~0.859)。见封三图2。
3讨论
中央型肺癌在临床上以鳞癌与小细胞肺癌居多[1]。中央型SCC早期局限性于支气管黏膜,随病变进展形成肿块,导致支气管部分或完全阻塞[7,8]。中央型SCLC为大支气管壁黏膜下肿瘤浸润生长,支气管壁受压,形成包绕支气管壁的管外型肿块[9]。由于二者易发生于肺门周围且存在相似特征,二者的辨别仍存在一定的困难。虽然较多研究者对中央型鳞癌与小细胞肺癌的形态学特征等方面进行了定性分析,认为二者在一定的程度上可以进行区分[9-11]。本研究中,通过对鳞癌与小细胞肺癌的平扫和增强CT图像提取纹理特征,以定量的方式来区分二者的差异。
CT纹理分析获得的多个参数可以定量评估肿瘤的异质性,多项研究表明基于纹理分析方法在量化评估肿瘤组织特征特征方面较传统平均CT值能获得更多的信息[12,13]。峰度值参数可以用来量化评估感兴趣区域内CT值频数分布的陡缓程度。当为正值时,随值增大逐渐陡峭;而为负值时,随值负向增大分布越来越平坦。偏度值是用来量化数值分布形态的,描述数值分布的对称性形态的参数。当值为负时,称左偏态,此时数据位于均值左边的较位于右边的少;当值为正值时,称右偏态,此时数据位于均值右边的较位于左边的少。不均质度反映的是感兴趣区域内提取的图像灰度值的离散程度,可以反映肿瘤不均质性。
本研究中,平扫和增强Ⅱ期图像获得的参数中,小细胞肺癌组的不均质度值均小于中高分化鳞癌组,峰度值均高于中高分化鳞癌组,差异有统计学意义(P<0.05)。从病理学特征方面来看,低分化鳞癌细胞核高度多形性,细胞有丝分裂活跃,癌细胞角蛋白和细胞间桥缺乏[14]。同样,小细胞肺癌亦为低分化癌[15]、癌细胞小而致密的小圆细胞、细胞核高度多形性以及细胞有丝分裂计数很高[16],这些低分化特征使二者的峰度值明显高于中高分化鳞癌,这与彭晓容等[2]的研究结果一致。
肺鳞癌易形成液化坏死、空洞和钙化,中高分化鳞癌尤为明显[17],这些混杂成分使肿瘤不均质度性增加,而小细胞肺癌由致密的小圆细胞构成,癌细胞成分单一,不易形成坏死、钙化[18],因而小细胞肺癌的不均质度较中高分化鳞癌低。研究表明增强扫描可以更好地反映肿瘤的异质性,由于增强的强化程度是反映肿瘤内血管化的重要指标,增强图像显示肿瘤的异质性主要与非均质血管形成相关,同时对比度增强亦与缺氧之间存在联系[19],而鳞癌血供相对不丰富,肿瘤在增强后易形成不均匀强化[11,17],这是增强图像鳞癌不均质度比小细胞肺癌要高的原因。小细胞肺癌与低分化鳞癌相比,平扫和增强二者参数间均无显著差异,这与二者均为低分化程度肿瘤有关,使量化信息特征差异不大。
平扫和增强扫描均可以获得较平均CT值更多的量化信息,不均质度值和峰度值均能较好的鉴别中高分化鳞癌组与小细胞肺癌组,而不均匀度值和峰度值鉴别中高分化鳞癌组与低分化鳞癌组的结果稍差于前者。ROC曲线对两组肿瘤的诊断鉴别价值进行分析评估,AUC越靠近1.0说明诊断价值越大,越靠近0.5时诊断价值越低,平扫和增强扫描图像的不均匀度值和峰度值诊断两组肿瘤的AUC均大于0.7,当鉴别中高分化鳞癌与小细胞肺癌时,增强扫描图像的不均匀度值的AUC最大达0.906,并且敏感度和特异度均大于90.0%,表明不均匀值在鉴别中高分化鳞癌与小细胞肺癌的诊断价值最高,这与两组肿瘤中不同病理类型及分化程度的肿瘤组织成分存在差异相关[10,11]。当对不同组的肿瘤组织的不均匀度值和峰度值的ROC曲线进行比较时,发现增强Ⅱ期的不均匀度值和峰度值曲线下面积均大于平扫,表明增强扫描可能较平扫更为敏感。鳞癌血供相对不丰富,组织成分混杂多样,增强后呈不均匀强化[11,17];而小细胞肺癌的肿瘤成分单一,血供相对丰富,增强后肿瘤易倾向于均匀强化[16,20],因而增强扫描较平扫更能反映组织的血管化情况,对组织血供特征能较好显示。
本研究存在以下局限性,第一,研究所纳入的病例数相对较少,亦未纳入其他病理类型的肺癌,需进一步扩大样本证实不同类型肺癌的纹理分析参数的差异。第二,本研究中纹理分析量化参数较少,后续可提取更多的纹理分析参数来量化二者的差异。
综上所述,CT纹理分析方法获取的量化参数可在形态学及常规平均CT值之外对中央型鳞癌与小细胞肺癌的区分提供一些额外的定量信息,对临床的诊断和及时干预治疗有一定的指导意义。
[参考文献]
[1] Liu D,Guo Y,Shi B,et al. Tracheal carinal reconstruction and bronchovasculoplasty in central type bronchogenic carcinoma[J]. Zhongguo Fei Ai Za Zhi,2010,13(4):352-356.
[2] 彭晓容,马春浓,陈恩炎. 增强CT直方图分析与肺癌组织分化程度的相关性研究[J]. 医学影像学杂志,2017, 27(9):1698-1700.
[3] 张娜,武志峰. CT纹理分析在肺癌诊断中的应用研究进展[J]. 中国现代医药杂志,2018,56(2):95-98.
[4] Cuccurullo V,Mansi L. AJCC cancer staging handbook: From the AJCC cancer staging manual(7th edition)[J]. European Journal of Nuclear Medicine & Molecular Imaging,2011,38(2):408.
[5] 陳克能. 小细胞肺癌与TNM分期[J]. 中国肺癌杂志,2016,(6):409-412.
[6] 庄天戈. CT 原理与算法[M]. 上海:上海交通大学出版社,1992:9-10.
[7] Chiles C. Imaging features of thoracic sarcoidosis[J]. Semin Roentgenol,2002,37(1):82-93.
[8] 孫惠玉,朴相茂,李相国,等. CT引导下经皮肺穿刺活检在中央型肺癌诊断中的应用[J]. 中国现代医生,2014, 52(16):87-89.
[9] 韦文桦,何启辉,陈乾. 小细胞肺癌的CT征象、诊断和鉴别诊断[J]. 中国现代医生,2013,51(4):86,88.
[10] 李小会,刘国艳,刘雪梅. 中央型小细胞肺癌与鳞癌的多层螺旋CT比较研究[J]. 数理医药学杂志,2017,30(6):825-826.
[11] 管恒星,周永,阿里甫,等. 中央型小细胞肺癌与鳞癌的多层螺旋CT比较研究[J]. 中国医学影像学杂志,2015, 23(9):686-690.
[12] 胡征宇,沈起钧,冯湛,等. CT纹理分析在量化胰腺囊腺瘤影像表型中的诊断价值[J]. 中华胰腺病杂志,2017, 17(5):330-334.
[13] Andersen MB,Harders SW,Ganeshan B,et al. CT texture analysis can help differentiate between malignant and benign lymph nodes in the mediastinum in patients suspected for lung cancer[J]. Acta Radiol,2016,57(6):669-676.
[14] Matoba M,Tonami H,Kondou T,et al. Lung carcinoma: diffusion-weighted mr imaging-preliminary evaluation with apparent diffusion coefficient[J]. Radiology,2007,243(2):570-577.
[15] Fukushima T,Tateishi K,Yamamoto H,et al. Clinical characteristics and outcomes of patients with small cell lung cancer detected by CT screening[J]. Med Oncol,2013, 30(3):623.
[16] Junker K,Wiethege T,Müller KM. Pathology of small-cell lung cancer[J]. J Cancer Res Clin Oncol,2000,126(7):361-368.
[17] Oliver TG,Patel J,Akerley W. Squamous non-small cell lung cancer as a distinct clinical entity[J]. Am J Clin Oncol,2015,38(2):220-226.
[18] Lee D,Rho JY,Kang S,et al. CT findings of small cell lung carcinoma: Can recognizable features be found?[J]. Medicine(Baltimore),2016,95(47):e5426.
[19] Ganeshan B,Goh V,Mandeville HC,et al. Non-small cell lung cancer: histopathologic correlates for texture parameters at CT[J]. Radiology,2013,266(1):326-336.
[20] 江海涛,阮磊,杨建涛,等. 小细胞肺癌的CT表现与肿瘤标志物NSE、CYF21-1、CEA的相关性研究[J]. 中国现代医生,2018,56(12):16-19.
