miR-34a靶向调控Wnt/β-catenin信号对小儿淋巴癌细胞凋亡的机制研究*
2019-09-26黄晓燕
曹 祥 韦 伟 黄晓燕 羊 玲
弥漫性大B细胞淋巴癌(diffuse large B-cell lymphoma,DLBCL)是源于在淋巴造血系统的恶性肿瘤的总称.淋巴癌是一种高度异质性疾病,患者初期表现为无痛性淋巴肿大,并累及多个器官[1-2].当前,我国青少年DLBCI发病率不断上升,探索新的预后分层方法和个体化差异对于治疗淋巴癌是一种新的尝试,其目的在于增加淋巴癌临床疗效,对于淋巴癌患者的生存具有重要意义.Wnt信号是由多个Wnt配体、多个跨膜受体(Frizzled,FZD)组成,而β-连环蛋白(β-catenin)是其中主要效应因子,当Wnt蛋白与受体结合时可以加强β-catenin(Wnt/β-catenin)的稳定性.在淋巴癌细胞组织中,Wnt/β-catenin因子的活性比在正常人群的淋巴细胞中含量明显增多,其在淋巴细胞发育及多种恶性血液病中也具有重要作用[4-6].微小RNA-34a(microRNA-34a,miR-34a)是一大类miRNA肿瘤抑制基因,其作用在于能够缩短肿瘤细胞的存活和周期,目前已在临床试验中作为抗癌治疗药物之一[7-8].miR-34广泛存在多种生物体内,可以靶向调节淋巴癌细胞凋亡和周期阻滞,还可以抑制上皮间质转化,导致淋巴癌细胞周期缩短、衰老及死亡.本研究通过观察miR-34a靶向调控Wnt/β-catenin信号对小儿淋巴癌细胞凋亡的机制研究.
1 材料与方法
1.1 材料、试剂和仪器
淋巴癌细胞株A554和正常淋巴细胞株11-ZAD[美国模式培养物集存库(American type culture collection,ATCC)];Wnt/β-catenin培养基和胎牛血清(上海优予生物科技有限公司);miR-34a、miR-34a抑制物(miR-34a inhibito)(北京孚博生物科技有限公司);RNA-iMAX(上海斯信生物科技有限公司);免疫组化试剂盒(赫澎上海生物科技有限公司);Wnt/β-catenin抑制基因试剂(美国BD公司);BD FACSCanto Ⅱ型流式细胞仪(北京安麦格贸易有限公司);Getein1100型免疫荧光检测仪(南京基蛋生物科技股份有限公司);Western blot ZY5型电泳仪(北京君意东方电泳设备有限公司).
1.2 淋巴细胞培养与实验分组
将淋巴癌细胞株A554和正常淋巴细胞株11-ZAD分别进行溶液配置,对淋巴癌株A554细胞和正常淋巴11-ZAD加入浓度为80 mol/L的红霉素和青霉素(100 U/m),放入12%胎牛血清的完全培养基(25 mmol/L).在37.5 ℃条件下培养24 h,更换培养基24 h一次,当淋巴癌株A554和正常淋巴细胞株11-ZAD融合度达到90%时取生长期细胞进行实验.
将淋巴癌细胞株A554实验分为3组:①淋巴癌细胞转染miR-34a模拟物(mimics)组(miR-34a mimics组);②淋巴癌细胞组;③淋巴癌细胞转染miR-34a抑制物(inhibitor)组(miR-34a inhibitor组).
1.3 淋巴癌细胞株A554转染
采用转染试剂RNAiMAX试剂盒,按照说明书所述方法将miR-34a mimics和miR-34a inhibitor各30 pmol/ml,分别与RNAiMAX转染试剂混合制备复合物,置于室温放置5 min.将有机复合物加入细胞中转染48 h,每组设置复孔2个以上,更换正常培养基进行后续分析,当淋巴癌细胞株A554浓度达到40%~50%时,利用miR-34a mimics、miR-34a inhibitor和阴性对照(negative control,NC)转染到A549细胞株中,4 h后将培养液换为含有8%血清的高糖培养基(dulbecco's modified eagle medium,DMEM)培养48 h,随后按照RNAiMA操作说明配制样品,收集实验后的淋巴癌细胞.
1.4 免疫组化检测
将各组淋巴癌细胞株中的分泌型糖蛋白(Dickkopf-1,DKK1)和Wnt抑制因子1(wnt inhibitory factor-1,WIF-1)蛋白进行检测,注入2%甲醛中固定过24 h,脱水且涂上石蜡连续切片,切成长宽高为(1.5X1.5X1.5)μm块状.诱导24 h、48 h作为实验组,采用Masson法观察miR-34a细胞株中的胶原进行沉积,采用苏木精-伊红(hematoxylin eosin,HE)染色法检测3组DKK1、WIF-1和miR-34a活性.
1.5 流式细胞仪检测
将各组淋巴癌细胞以2X106个/ml浓度置于6孔板,培养24 h,用0.25%胰蛋白酶消化细胞,用冷的70%的乙醇固定,于4 ℃放置1 d后离心5 min倒掉上清液,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤5 min,重复3次,在37 ℃无光照下染色30 min,采用流式细胞仪分析淋巴癌细胞凋亡程度.
1.6 Western blot检测
在6孔板中加入100 μg的胰蛋白酶提取液,注入3 ml的培养基停止消化,将细胞提取液放入微量离心(eppendorf,EP)管中,并与胰蛋白酶提取液按照1∶100进行混合,再放入冰箱中冷冻10 min,使细胞完全裂变成为E溶液,在EP管中放入一株淋巴癌细胞组织,并按照1∶100比例加入胰蛋白酶提取液3 ml,使细胞完全裂变成为F溶液,再将E溶液和F溶液以80∶1的体积进行摇匀,配制成工作液放入37.5 ℃的保温箱中20 min,冷却后计算Wnt/β-catenin蛋白的浓度水平.
1.7 免疫荧光检测
将淋巴癌细胞以5X104/ml浓度水平置于12孔板中(有盖玻片),用4%多聚甲醛固定10 min,PBS洗涤;用0.5%非离子表面活性剂(Triton)处理10 min,用PBS洗涤,用浓度为3%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h后用PBS洗涤,培育24 h,用PBS洗涤3次,加入羊抗小鼠IgG Alexa Flour488(1∶200)在室温、无光的条件下培育1 h,用PBS洗涤3次后加入4,6-二乙酰基-2-苯基癸酸酯(4,6-diacetyl-2-phenyl decanoate)在室温、无光的条件下染色10 min,用PBS洗涤2次后将盖玻片移到载玻片上,用抗荧光衰减封片剂封片,放置于荧光显微镜下观察.
1.8 统计学方法
采用SPSS21.0分析所有数据,3组淋巴癌细胞的DKK1、WIF-1、Wnt/β-catenin蛋白表达及凋亡情况的差异性采用卡方检验,组间数据比较采用单因素分析,计量资料用均数±标准差(±s))表示,以P<0.05表示差异有统计学意义.
2 结果
2.1 miR-34a在淋巴癌细胞株A554和正常淋巴细胞株11-ZAD中的表达
在淋巴癌细胞组中,miR-34a表达明显低于正常淋巴细胞,差异有统计学意义(t=9.517,P<0.01),见图1.

图1 miR-34a的活性表达
2.2 免疫组化检测DKK1和WIF-1的活性
miR-34a mimics组淋巴癌细胞中DKK1和WIF-1的活性表达均高于淋巴癌细胞组,差异有统计学意义(t=7.455,t=8.233,P<0.01);淋巴癌细胞组淋巴癌细胞中DKK1和WIF-1的活性表达均高于miR-34a inhibitor组,差异有统计学意义(t=8.449,t=9.233,P<0.01),见图2和图3.

图2 三组淋巴癌细胞DKK1和WIF-1蛋白活性(X400)
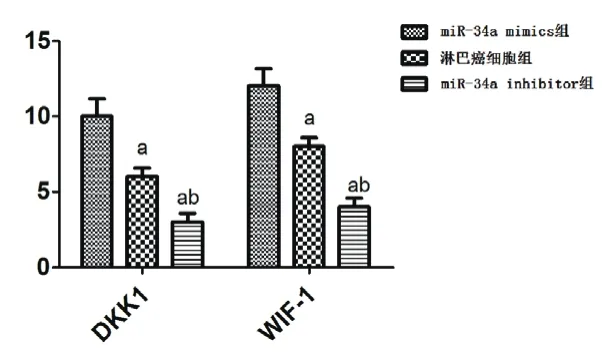
图3 三组淋巴癌细胞DKK1和WIF-1蛋白表达
2.3 流式细胞仪检测miR-34a对淋巴癌细胞的凋亡影响
miR-34a mimics组、淋巴癌细胞组和miR-34a inhibitor组的淋巴癌细胞凋亡率分别为49.82%、35.77%和22.49%.miR-34amimics组的淋巴癌细胞凋亡最强,淋巴癌细胞组的淋巴癌细胞与miR-34amimics组相比,细胞凋亡速度减弱,差异有统计学意义(x2=5.383,P<0.01);miR-34a inhibitor组淋巴癌细胞凋亡最慢,与miR-34amimics组和淋巴癌细胞组比较,差异有统计学意义(x2=13.248,x2=10.076;P<0.01),提示其增值明显受到miR-34a的影响,miR-34a表达越高淋巴癌细胞凋亡越快,见图4和图5.

图4 三组淋巴癌细胞凋亡情况

图5 三组淋巴癌细胞凋亡率比较
2.4 Western blot检测淋巴癌细胞中 Wnt/β-catenin蛋白浓度
在Western blot检测中,miR-34a mimics组淋巴癌细胞中Wnt蛋白和β-catenin蛋白浓度水平明显少于淋巴癌细胞组,差异有统计学意义(t=13.483,t=16.489;P<0.01);淋巴癌细胞组的Wnt蛋白和β-catenin蛋白浓度水平明显少于miR-34a inhibitor组,差异有统计学意义(t=5.628,t=7.853,P<0.01),见图6和图7.

图6 三组淋巴癌细胞中Wnt/β-catenin蛋白表达

图7 三组淋巴癌细胞中Wnt/β-catenin蛋白相对表达量
2.5 免疫荧光法检测淋巴癌细胞中Wnt/β-catenin蛋白表达
在免疫荧光法检测中,miR-34a mimics组淋巴癌细胞中的Wnt蛋白和β-catenin蛋白表达明显低于淋巴癌细胞组,差异有统计学意义(t=6.479,t=7.459;P<0.05);淋巴癌细胞组淋巴癌细胞中Wnt蛋白和β-catenin蛋白表达显著低于miR-34a inhibitor组,差异有统计学意义(t=8.239,t=7.689;P<0.05),见图8和图9.

图8 三组淋巴癌细胞中Wnt/β-catenin蛋白活性

图9 三组淋巴癌细胞中Wnt/β-catenin蛋白表达量
3 讨论
2008年,世界卫生组织将淋巴癌规划为需要化疗的由B细胞引发的肿瘤疾病,起源于生发中心滤泡辅助T细胞,具有特殊的生物学特征及临床表现,其特点在于具有较强的侵袭性生长特性,常常发生于青少年,预后较差,分为原发性和进展性[9-11]两种形式.各种类型的亚基在临床上都具有治疗难度大、复发率高、预后差的特征,目前是医学界的难题[12-13].针对于淋巴瘤的发病机制目前仍未明确,所以进一步了解淋巴癌的发病机制和突破点尤为重要.
本研究结果显示,在淋巴癌细胞当中,miR-34a的活性明显低于正常淋巴细胞.miR-34a mimics组、淋巴癌细胞组和miR-34a inhibitor组的淋巴癌细胞凋亡率分别为49.82%、35.77%和22.49%,表明淋巴癌细胞凋亡明显受到miR-34a干预的影响,miR-34a表达越高淋巴癌细胞凋亡越快.miR-34a在肿瘤细胞组织的生长和发展过程中具有重要作用,其缺失或者凋亡可能是癌细胞生存和发育的最大优势.免疫组化法中观察淋巴癌细胞中的DKK1和WIF-1的活性结果显示,在miR-34a mimics组淋巴癌细胞中DKK1和WIF-1活性表达均高于淋巴癌细胞组,淋巴癌细胞组DKK1和WIF-1活性表达均高于miR-34a inhibitor组.DKK1和WIF-1因子其为抑癌基因,与肿瘤发生、发展有着密切联系,在淋巴癌细胞形成和生长过程起负调控作用,DKK1和WIF-1能够使癌症内信号因子磷酸化,使其在细胞浆内被水解,被水解的主要原因在于炎性受体Lrp5结合形成多聚体复合物在其中发挥作用,该过程阻断炎症信号通路的正常传导,阻碍癌症内信号分子进入细胞核.Khalili等[14]和Kandimalla等[15]的研究表明,在淋巴癌疾病中,DKK1和WIF-1可以增加对淋巴癌中炎性因子抑制作用,修复被破坏的细胞活性,失去活性凋亡,对淋巴癌细胞起破坏作用.
Western blot方法检测Wnt/β-catenin蛋白浓度,其结果显示miR-34a mimics组淋巴癌细胞Wnt/β-catenin蛋白浓度明显低于淋巴癌细胞组,淋巴癌细胞组淋巴癌细胞Wnt/β-catenin蛋白浓度显著组低于miR-34a inhibitor组,在免疫荧光检测Wnt/β-catenin蛋白表达结果显示:miR-34a mimics组淋巴癌细胞中Wnt/β-catenin信号活性表达明显低于淋巴癌细胞组和miR-34a inhibitor组,淋巴癌细胞组的活性低于miR-34a inhibitor组.Wnt信号是机体内重要的转导通路,一是经典的Wnt信号;二是非经典的Wnt信号通路,能够促进细胞的生长、分化和发育[4,16].经典Wnt信号通路即Wnt/β-catenin,也是一种生物学行为的关键信号通路,在细胞中具有增殖、分化、迁移以及侵袭的特点[17-19].过度的激活与多种恶性肿瘤的发生密切相关,在许多淋巴癌癌细胞中可检测到Wnt和β-catenin,而在无癌的淋巴组织中含量明显减少或者无法检测.Cao等[20]和Ping等[21]研究发现,在急性淋巴癌患者组织细胞标本中有WNT信号的表达,并且在受到外界刺激时在细胞核中有观察到β-catenin的增多,癌细胞的活性和周期都明显增加.因此,Wnt/β-catenin信号的活性增强时,可以加速对淋巴癌细胞组织的扩散及加重患者病情,与本研究结果相似.
miR-34a通过靶向抑制Wnt/β-catenin信号,促进DKK1和WIF-1活性表达,从而加速淋巴癌细胞凋亡,缓解小儿淋巴癌病症.
