吉林省四平地区粉黏壤土微生物群落结构与环境因子的关系
2019-09-23黄冠南丁美月马金才
黄冠南 丁美月 马金才


摘要:微生物作为土壤中的重要组成部分,对土壤生态系统中的物质循环和能量流动有着至关重要的作用。吉林四平地区是东北地区三大粮仓之一,该地区粉黏壤土的微生物群落结构情况虽然重要,却鲜有人进行研究。在该地区的农业土地区域采集6个土壤样品点,应用二代高通量测序技术进行分析,并利用样品中的优势类群与土壤理化性质的Pearson相关性分析、典范对应分析(CCA)以及方差分解分析(VPA),以确定该地区微生物群落结构与环境因子的关系。分析结果显示,共同影响细菌、真菌优势类群的环境因素是pH值和铵态氮含量。方差分解分析(VPA)结果则又进一步指出,铵态氮含量、土壤pH值及土壤黏粒程度分别解释了15.73%、22.84%、16.81%的细菌群落结构组成变化原因;铵态氮含量、土壤pH值、溶解性有机碳含量分别解释了24.32%、20.74%、22.37%的真菌群落结构组成变化原因。通过二代高通量测序技术以及统计学研究,可以为东北地区粉黏壤土中的微生物群落结构与环境因子的关系研究提供一些新的理论依据。
关键词:Illumina MiSeq高通量测序;粉黏壤土;细菌;真菌;优势类群
中图分类号: X172 文献标志码: A 文章编号:1002-1302(2019)14-0306-04
土壤作为生态系统中的重要组成部分之一,是人类与动植物生存繁衍的基础,也是土壤微生物的附着生境,并为其提供了较为丰富的食物。微生物在调节地球生物化学营养物质的循环和生态系统功能等方面起着至关重要的作用[1-2]。由于近几年来我国对于粮食产量的需求变大,东北农作耕地作为我国重点保护的土壤生态资源,其垦殖面积不断扩增,滥用施肥的情况也日渐凸显,使得黑土资源快速衰退的情况愈发恶化[3]。土壤微生物作为土壤结构中极其重要的组成元素,也同时依赖于土壤的生态环境。近几年来,高通量测序技术的日臻完善与成熟发展,为土壤微生物群落结构及多样性的研究搭建了更为宽广的平台和途径,使得人们对于土壤中细菌以及真菌的认识愈加丰富[4]。
Illumina MiSeq高通量测序技术[5]具有低成本、低错误率、高通量等优点,目前已经成为分析自然界中细菌、真菌等微生物的群落结构组成以及相对丰度的重要工具。由于目前东北四平地区农耕地中的微生物群落结构组成和多样性以及它们受到环境因子的影响情况鲜有人报道。本研究旨在探究吉林四平地区粉黏壤土[6]的微生物群落结构及其与环境因子的关系。
1 材料与方法
1.1 研究区域概况与样品采集
四平市是吉林省的第三大城市,也是东北地区的农业重点区域,地处松辽平原中部腹地。四平市在地理上可划分为平原、丘陵2种地带,该地区的土地类型有着土地资源多样化、地貌结构复杂化、地域差异显著化等特征[7]。
土壤样品于2017年10月采集于吉林省四平地区的农作耕地区域。采用五点取样法采样,将样品置于冰袋中冷藏,并迅速带回实验室,于-80 ℃條件下保存,以便后续进行土壤物理化学性质的测定。土壤样品的基本信息如表1所示。
1.2 土壤理化性质的测定
土壤样品经过风干以及过筛后,进行以下理化性质的分析:pH值,使用pH计进行测定;水溶性有机碳(简称DOC)含量(mg/kg),使用总有机碳分析仪(SSM-5000A,日本)测定;总氮(简称TN)含量(mg/kg),通过过硫酸钾(K2S2O8)氧化分光光度法测定;铵态氮(简称NH4+-N)含量(mg/kg)、硝态氮(简称NO3--N)含量(mg/kg),分别使用纳氏试剂分光光度法和双波长比色法测定;总溶解性磷(简称TDP)含量(mg/kg),采用钼锑抗比色法测定;土壤质地(黏粒、粉粒、沙粒含量,%),采用激光粒度分布仪(Bettersize 2000,丹东市百特仪器有限公司)测定。
1.3 总DNA的提取及16S rRNA基因的PCR扩增
土壤总DNA基因组的提取是采用DNA提取试剂盒进行的。目标片段的PCR扩增通常以微生物核糖体RNA等能够反映菌群组成和多样性的目标序列为靶点,根据序列中的保守区域设计相应引物,并添加样本特异性条形码序列,进而对rRNA基因可变区(单个或连续多个)或特定基因片段进行PCR扩增。PCR扩增采用NEB公司的Q5高保真DNA聚合酶,并严格控制扩增循环数,使循环数尽可能低,同时也保证同一批样本的扩增条件一致。
1.4 统计学分析
应用软件Mothur进行统计并计算4种常用的生物多样性指数。将优势菌门与土壤理化因子结合进行Pearson相关分析。将细菌、真菌门水平上的分类信息用Origin软件制图以进行展示,进一步绘制优势菌门及其优势纲的相对丰度图,细菌、真菌的分类信息用Origin 9.0制图。用软件R(Pheatmap)绘制CCA、VPA图。使用SPSS 19.0(IBM,美国)开展优势类群与土壤理化性质的Pearson相关分析。应用 R 3.3.2 调用vegan程序包进行相关统计学分析。
2 结果与分析
2.1 土壤理化性质
经土壤质地识别系统软件(国际制标准)测定,吉林四平地区的土壤类型均为粉黏壤土。本研究采集的6个土壤样品的基本理化性质如表2所示。
2.2 微生物多样性指数分析
微生物多样性指数分析是研究土壤微生物多样性的重要手段之一。对于常用的几种多样性指数,一般来说,Chao1或ACE指数与群落的丰富度呈正相关,即Chao1或ACE指数越大,表明该群落的丰富度越高[8]。在本研究中采集到的土壤样品的微生物多样性指数如表3所示。其中细菌中SP5样品的ACE指数高达3 049.55,Chao1指数高达2 906.50,说明在SP5号样品中的细菌群落丰富度最高。SP4号样品真菌群落的Chao1指数、ACE指数分别为553.01、553.58,均是同类中最高的,说明SP4号样品真菌群落的丰富度最高。细菌群落中的SP3、SP5,真菌群落中的SP2、SP3的群落丰富度、均匀度都相对较好。细菌和真菌群落SP2、SP6样品的Chao1指数或ACE指数及Shannon指数都较低,说明它们与其他样品相比,群落丰富度和均匀度都是较低的。一般而言,Simpson指数对群落的均匀度以及优势OTU(最小操作分类单元)更为敏感,而Shannon指数则是对群落的丰富度及稀有OTU更为敏感[9]。
2.3 土壤微生物的群落结构组成与分析
将采集的土壤样品进行处理后,共获得细菌25门97纲118目402科801属和未确定类群。细菌优势门的相对丰度如图1所示,可以看出,优势细菌门有放线菌门(Actinobacteria,相对丰度为32.95%)、变形菌门(Proteobacteria,相对丰度为29.73%),这二者在细菌优势菌门中占据主导地位,而其余优势菌门中,芽单胞菌门(Gemmatimonadetes)的相对丰度为11.15%,酸杆菌门(Acidobacteria)则为8.87%。
放线菌门亚纲水平上的相对丰度如图2所示。可以看出,放线菌门下优势亚纲中放线菌亚纲(Actinobacteria)的相对丰度达到了58.43%,在放线菌门中的亚纲水平上占据主导地位,嗜热油菌纲(Thermoleophilia)的相对丰度为 16.71%,醋酸菌亚纲(Acidimicrobiia)的相对丰度为12.26%,红细菌亚纲(Rubrobacteria)的相对丰度为8.26%。其中放线菌亚纲(Actinobacteria)为最优势亚纲,其相对丰度也最高。
变形菌门亚纲水平上相对丰度如图3所示。可以明显看出,α-变形菌纲(α-alphaproteobacteria)最具优势,相对丰度达到62.89%。而变形菌门亚纲水平上的其他亚纲排序依次为β-变形菌纲(β-betaproteobacteria)、δ-变形菌纲(δ-deltaproteobacteria)、γ-变形菌纲(γ-gammaproteobacteria),相对丰度分别为14.90%、12.28%、9.92%。
由图4可见, 采集的土壤样品经处理后共获得真菌7门31纲92目190科326属和未确定类群。其中优势的真菌门有子囊菌门(Ascomycota),相对丰度为89.20%,在优势真菌门中占据主导地位。而担子菌门(Basidiomycota)则占真菌总体的8.16%。
由于子囊菌门的相对丰度达到了89.20%,笔者对于其下 属的优势亚纲进行分析,发现其中粪壳菌纲(Sordariomycetes)的相对丰度达到了51.32%,从图5可以明显看出。但是其余真菌优势门在采集的样品中的比例体现得并不相对均匀,经过分析统计得出,散囊菌纲(Eurotiomycetes)占13.40%,座囊菌纲(Dothideomycetes)占11.45%,未知菌纲占20.60%。
2.4 优势类群与土壤理化性质的Pearson相关性分析
将细菌(相对丰度大于5%)和真菌(相对丰度大于1%)的优势菌门与土壤中各项理化性质作Pearson相关性分析。表4结果显示,细菌群落中的酸杆菌门(Acidobacteria)与 NH4+-N含量呈显著负相关,芽单胞菌门(Gemmatimonadetes)与pH值呈显著负相关,其余的相关性均不显著。而在真菌群落中,子囊菌门(Ascomycota)与NH4+-N含量呈显著正相关,而担子菌门(Basidiomycota)则与 NH4+-N 含量呈显著负相关(表5)。
2.5 土壤理化性质对微生物群落结构的影响
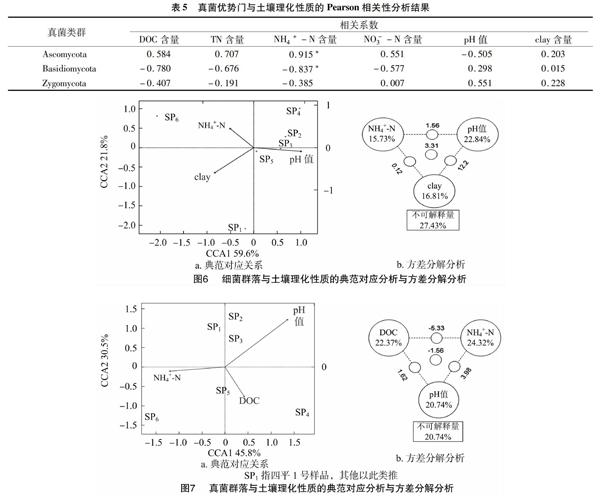
对于微生物群落组成与环境因子之间的关系,笔者采用典范对应分析(CCA)进行研究[10]。其中主要环境因子包括pH值、TN含量、DOC含量、NH4+-N含量、NO-3-N含量和clay含量等。通过典范对应分析,得到对细菌群落组成影响较大的因素分别有NH4+-N含量、pH值和clay含量(图6),对真菌群落组成影响较大的因素则为DOC含量、pH值、NH4+-N含量(图7)。
结合Pearson相关分析结果和细菌、真菌的CCA结果,选取这3个主要环境因素进行方差分解分析(VPA),以进一步量化主要环境因素对微生物群落结构组成影响的具体贡献。在细菌群落中,NH4+-N含量、pH值和黏粒含量这3个变量共解释了72.57%的细菌群落结构变化原因,其中 NH4+-N 含量、pH值和黏粒含量分别解释了15.73%、22.84%、16.81%的细菌群落结构变化原因。在真菌微生物群落中,DOC含量、NH4+-N含量和pH值这3个变量共解释了79.26%的真菌群落结构变化原因,DOC含量、pH值、NH4+-N 含量则分别解释了22.37%、20.74%、24.32%的真菌群落结构变化原因。
3 结论与讨论
微生物组成与土壤理化性质的Pearson相关性分析结果显示,影响细菌各优势类群相对丰度的环境因素主要有NH4+-N含量、pH值和黏粒含量等,影响真菌各优势类群相对丰度的环境因素主要有DOC含量、pH值、NH4+-N含量。而反映微生物群落的总体水平受环境因素影响的CCA结果和Pearson相关性分析表明,NH4+-N含量、pH值是影響沙土中细菌、真菌群落结构组成的共同环境因素。此外,细菌微生物群落结构组成还受黏粒含量的影响,真菌微生物群落结构组成还受DOC影响。
VPA结果又进一步指出3个主要因素在细菌微生物群落、真菌微生物群落多样性变化中的具体贡献。其中pH值可能对细菌群落结构产生影响,也可能通过改变其他土壤理化性质,包括阳离子金属溶解度、有机碳含量、土壤水分状况和电导率等间接影响微生物群落结构。但是,由于本研究中pH值的分布范围较窄,所以得出的结果应谨慎对待。
本研究应用二代高通量测序技术对从吉林四平地区粉黏壤土采集的6个土壤样品的微生物多样性进行了16S rRNA基因测序及整理,并运用统计学方法进行了分析[11-14]。本研究初步掌握了吉林四平地区粉黏壤土中细菌和真菌微生物群落结构组成和多样性结构及其受环境因子影响的情况以及与主要影响因子之间的关系,并进一步进行相关性分析,从而为该地区农业耕地微生物群落结构与环境因子的关系提供更为重要的依据。
参考文献:
[1]冯 瑞. 三峡库区消落带的微生物群落结构、碳氮矿化和硝化作用的研究[D]. 重庆:西南大学,2016.
[2]汪海燕,王 辉,董元华,等. 土壤生态环境质量评价指标及方法研究概述[J]. 安徽农业科学,2013,41(20):8575-8577,8652.
[3]崔 明,蔡强国,范昊明. 东北黑土区土壤侵蚀研究进展[J]. 水土保持研究,2007,14(5):29-34.
[4]刘玉莉,魏 霜,刘碧琳,等. 第二代高通量测序技术用于进口细菌型微生物肥料菌群分析[J]. 安徽农业科学,2017,45(28):146-147,150.
[5]李 桥. 基于高通量测序技术下土壤微生物群落结构的研究[D]. 济南:山东师范大学,2014.
[6]郭彦彪,戴 军,冯 宏,等. 土壤质地三角图的规范制作及自动查询[J]. 土壤学报,2013,50(6):1221-1225.
[7]秦天柱,陈长胜,李德恒. 吉林省四平地区农业气候资源特征分析[J]. 气象灾害防御,2017,24(2):43-48.
[8]Gasc A,Pavoine S,Lellouch L,et al. Acoustic indices for biodiversity assessments:analyses of bias based on simulated bird assemblages and recommendations for field surveys[J]. Biological Conservation,2015,191:306-312.
[9]Bandeira B,Jamet J L,Jamet D. Mathematical convergences of biodiversity indices[J]. Ecological Indicators,2013,29:522-528.
[10]蔡树美,徐四新,张翰林,等. 滩涂土壤固氮菌群落与环境因子的典范对应分析[J]. 土壤,2017,49(6):1159-1165.
[11]夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报,2014,54(12):1489-1499.
[12]张彩霞. 新一代高通量测序技术研究土壤微生物群落结构对环境条件的响应[D]. 南京:南京农业大学,2012.
[13]王佩雯,朱金峰,陈 征,等. 高通量测序技术下连作植烟土壤细菌群落与土壤環境因子的耦合分析[J]. 农业生物技术学报,2016,24(11):1754-1763.
[14]Chen Z B,Xia T Y,Wang D K,et al. Diversity analysis of endophytic fungi in Mentha using illumina MiSeq high-throughput sequencing technology[J]. Medicinal Plant,2016,7(1/2):46-50.
