镉胁迫下转基因水稻对根际土壤微生物的影响
2019-09-23李磊韩成王宵宵
李磊 韩成 王宵宵
摘要:为了探究镉胁迫下转基因水稻对根际土壤微生物的影响,以抗虫转基因水稻华恢1号(HH1)及其亲本非转基因水稻明恢63(MH63)为研究材料,设置不同Cd2+浓度(0、3.5、60.0、240.0 mg/kg)胁迫进行盆栽试验。结果表明:与Cd0相比,Cd3.5处理对水稻农艺性状无显著影响;Cd240.0处理显著降低了株高、产量;与Cd0处理相比,Cd60.0和Cd240.0处理下HH1水稻根际土壤细菌群落组成中Proteobacteria(变形菌门)、Acidobacteria(酸杆菌门)、Actinobacteria(放线菌门)的相对丰度显著降低;MH63水稻中Acidobacteria的相对丰度显著升高而Bacteroidetes(拟杆菌门)的相对丰度显著降低。Cd胁迫显著降低了水稻根际土壤细菌群落丰度及多样性。环境因子分析显示,Cd胁迫后水稻根际土壤pH值、总氮含量、铵态氮含量的变化是影响根际土壤细菌群落结构的主要原因。
关键词:转基因水稻;细菌群落;根际土壤;镉胁迫
中图分类号: S154.3;Q938.1 文献标志码: A 文章编号:1002-1302(2019)14-0282-06
近年来,镉(Cd)污染愈加严重,使得农业的可持续发展与人类的生态环境受到极大影响。Cd在土壤-植物系统中具有较强的迁移能力,可在作物中富集较高浓度的Cd,经食物链传递进入人体危害人类健康[1]。调查显示,广西岩溶地区自然地理环境下土壤中的Cd浓度高达20 mg/kg,远高于国家标准,且我国西南地区土壤中Cd含量普遍较高[2]。水稻是我国重要的粮食作物,同时也是极易富集Cd的作物。近年来,转基因作物迅猛发展,2017年全球转基因作物种植面积高达1.9亿hm2[3]。来源于苏云金芽孢杆菌的Bt毒蛋白基因是目前应用最为广泛的抗虫基因。转入Bt基因的抗虫转基因水稻,能够杀死鳞翅类害虫,大大降低化学杀虫剂使用量[4]。在干旱、高盐及重金属等逆境胁迫下,与亲本水稻相比,转基因水稻具有生长优势[5-8]。如在Cd及高温胁迫下,转基因水稻幼苗中抗氧化酶含量高于亲本水稻[5-6];Li等研究发现,在高浓度臭氧胁迫下,抗虫转基因水稻的光合作用、产量均高于亲本水稻[7],且能够比亲本水稻提前适应低氮环境[8]。我国受重金属污染较严重地区土壤Cd污染的平均值达到3.5 mg/kg,转基因水稻在该浓度Cd胁迫下是否能正常生长、是否富集Cd目前尚不清楚;而在高Cd浓度胁迫下,与亲本水稻相比,转基因水稻是否具有更高的抗Cd能力也有待研究。
土壤微生物是土壤生态系统中物质和能量循环的主要参与者,其活动是衡量生态系统各种功能是否正常的一个重要方面。土壤微生物群落与土壤重金属污染之间的关系是国内外环境科学领域的一个研究热点,重金属污染能够对土壤的微生物群落产生影响,如降低土壤微生物量、可培养细菌菌落数量等[9],同时重金属污染能明显改变土壤微生物群落结构[10]。转基因作物能通过作物残体、作物根系分泌物、作物花粉等方式改变根际土壤微环境,影响土壤生态系统。关于转基因水稻对土壤微生物群落的影响,学者们展开了大量研究,但目前尚未有统一结论,有学者通过田间试验监测了转基因水稻与其亲本的多样性,发现转基因水稻对土壤根际微生物多样性无显著影响[11],也有研究者比较了转基因水稻和常规水稻根际细菌类群的数量和组成,发现转基因水稻的根际土壤细菌数量少于非转基因水稻,同时发现2个品种水稻土壤微生物群落结构不同[12]。根际土壤微生物是转基因作物环境安全评价的重要指标之一,其群落丰度、组成易受根际微环境和水稻生长影响。但在Cd胁迫下,转基因水稻对根际土壤微生物的研究尚未见报道。
本研究以转基因水稻华恢1号(HH1)及其亲本非转基因水稻明恢63(MH63)为研究对象,研究不同Cd浓度胁迫下转基因水稻对根际土壤微生物的影响,为Cd污染地区水稻生长及环境安全评价提供理论依据。
1 材料与方法
1.1 供试土壤与水稻种子
供试土壤为南京师范大学仙林校区(118°55′E、32°06′N)内未经人为干扰的自然生态系统土壤,去除表面植被、落叶及颗粒物后,采集0~15 cm深度土壤,室内自然风干后研磨过筛(2 mm),混匀后备用。土壤基本理化性质如下:pH值为7.77,总氮含量为0.41 g/kg,总有机碳含量为2.7 g/kg,有机质含量为4.65 g/kg,速效磷含量为3.53 mg/kg,铵态氮含量为0.28 mg/kg,该土壤中未检测到Cd等重金属污染。供试水稻为抗虫转基因水稻华恢1号(HH1)及其非转基因亲本水稻明恢63(MH63),水稻种子由华中农业大学植物科技学院提供。
1.2 盆栽试验
盆栽试验于2017年4—11月在南京师范大学地理科学学院玻璃温室内进行。试验选用高×直径为15 cm×25 cm的聚氯乙烯(PVC)塑料桶作为水稻盆栽用桶,每桶称取相当于5.0 kg干土质量的风干土壤,添加自来水使得盆栽桶中淹水4~5 cm,并添加不同Cd浓度对土壤进行为期30 d的预处理,盆栽桶口覆膜以减少水分挥发,膜上有孔以维持通气状态。设置Cd0、Cd3.5、Cd60.0和Cd240.0共4個Cd浓度胁迫处理,Cd添加量分别为0、3.5、60.0、240.0 mg/kg,其中Cd3.5为我国受重金属污染较严重地区土壤Cd污染的平均值,本研究具有实际意义;而Cd60.0和Cd240.0为土壤污染的极端值,拟研究在该高Cd胁迫下转基因水稻的抗Cd潜力。本研究中 Cd(Ⅱ) 的添加形态为CdCl2·2.5H2O,每个Cd浓度处理设置4个重复。重金属预处理后,每桶施入N ∶ P ∶ K质量比为 1 ∶ 1 ∶ 1 的复合肥作基肥,添加量为1.0 g/kg。将培养20 d后的HH1和MH63水稻幼苗分别移栽至桶中,每桶3株。水稻生长期间盆内保持4~5 cm淹水层,于移栽后20 d追施尿素(0.05 g/kg),于移栽后30 d(水稻分蘖后期)进行晒田,其他管理措施与田间相同。成熟期破坏性采样前,采用微电极分析仪(Unisense Microsensor Multimeter Version 2.01)测定各处理水稻盆栽水-土界面下3.8 cm处水稻根际土壤氧化还原电位值,测定方法参考文献[13]。于移栽后112 d(水稻成熟期),对水稻植株进行破坏性采样,并测定株高、生物量、籽粒重金属含量等水稻农艺性状。采集土样时,根据土壤在植物根系表面抖落和黏着程度来区分根际土和非根际土,具体采用抖落法收集[14],将采集的水稻根际土壤的一部分立即装入2 mL离心管中于 -80 ℃ 保存,用于微生物分子生态学分析;一部分根际土用于土壤理化性质分析。
1.3 分析方法
1.3.1 土壤理化指标的测定 土壤pH值的测定采用蒸馏水浸提法,以2.5 mL ∶ 1 g的水土比浸提,振荡10 min并静置30 min,采用台式pH计(Mettler-Toledo)测定悬浊液pH值。植物样品使用HNO3+HClO4消煮后,采用火焰原子吸收分光光度法测定,土壤有效Cd含量采用土壤养分状况系统研究法(ASI法)浸提后,采用火焰原子吸收分光光度法测定;土壤总有机碳(total soil organic,简称TOC)含量采用日本岛津TOC仪测定;土壤有效磷(AP)含量采用氟化铵-盐酸提取-钼锑抗比色法测定;总氮含量采用凯氏蒸馏法测定,无机氮采用2 mol/L KCl按体积比5 ∶ 1水土比浸提,在20 ℃、200 r/min 条件下振荡1 h后过滤,滤液无机氮含量用流动分析仪(Skalar San Plus,Netherlands)測定。检测方法参考鲍士旦的《土壤农化分析》[15]。
1.3.2 土壤总DNA的提取 土壤微生物群落与土壤微环境及营养水平密切相关,本研究发现,Cd3.5处理对根际土壤理化性质几乎无影响,因此仅选取Cd60.0和Cd240.0处理根际土壤,作为水稻根际土壤微生物的研究材料,并以Cd0处理为对照。土壤微生物总DNA采用FastDNA SPIN Kit for Soil(MP,Biomedicals,USA)试剂盒提取。称取于-80 ℃保存的新鲜土壤样品0.5 g,按试剂盒的试验步骤提取土壤微生物总DNA。DNA溶液的浓度和纯度采用NanoDrop 2000(Thermo,USA)进行测定,提取好的DNA样品稀释10倍后保存于 -20 ℃[16]。
1.3.3 实时荧光定量PCR分析 采用基于SYBR Green染料法的实时荧光定量PCR技术测定土壤细菌16S rRNA基因丰度来表征细菌群落丰度。测定仪器为Biorad CFX96 Real-time PCR system(Biorad,USA),SYBR Green试剂选用2×SYBR Premix Ex Taq(TaKaRa,Japan),细菌16S rRNA基因扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)。反应体系为20.0 μL,包括10.0 μL的2×SYBR Premix Ex Taq、上、下游引物(20 μmol/L)各0.3、1.0 μL样品DNA模版(9.3~23.9 ng/μL)及8.4 μL灭菌超纯水。反应程序如下:94 ℃预变性5 min; 94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,40个循环,每个循环结束后采集荧光数据;采用溶解曲线分析扩增产物的特异性,分析程序如下:温度从65 ℃上升到95 ℃,每上升0.5 ℃采集1次荧光数据。以含有细菌16S rRNA基因的重组质粒作为标准DNA模版,根据质粒浓度和阿伏伽德罗常数计算该基因的拷贝数,分别以10倍梯度稀释各模板,制作标准曲线,其浓度范围为9.61×102~9.61×108 copies/μL。每个样品做3个技术重复,扩增效率为99.6%(R2为0.992)。每轮反应设置3个无模板阴性对照。
1.3.4 高通量测序分析 16S rRNA基因扩增与Illumina Hiseq高通量测序分析:16S rRNA基因扩增的引物采用515F/907R(V4~V5区)。高通量测序委托广东美格基因有限公司执行,测序平台为Illumina Hiseq 2500。测序数据处理:采用FLASH(v1.2.7,https://ccb.jhu.edu/software/FLASH/)软件对每对PE reads进行拼接,将成对的reads拼成1条序列,最小的overlap(重叠)长度设置为10 bp,拼接序列的overlap区允许的最大错配比率为0.1,过滤不符合的Tags(标签),获得原始的拼接序列。利用Mothur软件对拼接后的序列进行质量控制及过滤,最终得到有效的拼接片段。利用USEARCH软件(v8.0.1517,http://www.drive5.com/usearch/)对所有样品的全部Clean Tags进行聚类,将相似度≥97%的序列归为同一类操作单元(OTUs),利用Qiime(http://qiime.org/)从每个OTU所属的序列中,选取OTU序列中排在第1位的序列作为OTU的代表序列,为避免测序深度不同导致的误差,每个样本随机抽取17 998条序列参与统计分析,将代表序列与GreenGene数据库进行对比完成对各OTU的注释,得到每个OTU的分类学信息[17]。根据样品中包含的物种信息,在门(Phylum)水平上将相对丰度<1%细菌类群以及无法分类的细菌类群合并在Others。
1.4 数据处理与统计分析
本研究采用SPSS 16.0(IBM,USA)对试验数据进行统计分析,采用单因素方差分析法来比较不同Cd浓度胁迫处理间的差异性(P<0.05)。
2 结果与分析
2.1 Cd胁迫对土壤理化性质及水稻农艺性状的影响
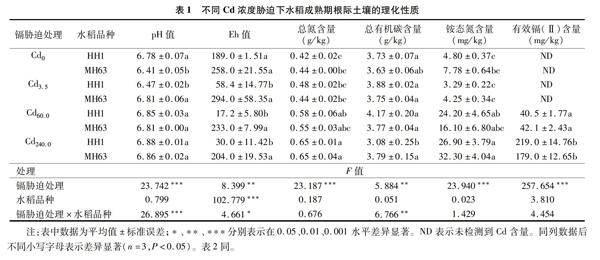
由表1可知,不同Cd浓度胁迫下HH1水稻根际土壤理化性质存在显著不同。与Cd0处理相比,Cd3.5处理水稻根际土壤pH值、氧化还原电位(Eh)值显著降低,Cd60.0处理Eh值显著降低而总氮与铵态氮含量显著升高,Cd240.0处理Eh值与总有机碳含量显著降低而总氮与铵态氮含量显著增加;与Cd3.5处理相比,Cd60.0与Cd240.0处理的pH值、铵态氮含量显著增加,Cd240.0处理的总氮含量显著增加,总有机碳含量显著降低;与Cd60.0处理相比,Cd240.0处理下总有机碳含量显著降低而有效镉含量显著增加。
不同Cd浓度胁迫下MH63水稻根际土壤理化性质也显著不同。与Cd0处理相比,Cd3.5、Cd60.0处理水稻根际土壤的pH值显著升高,Cd240.0处理水稻根际土壤的pH值、总氮含量、铵态氮含量均显著升高;与Cd3.5处理相比,Cd240.0处理的总氮与铵态氮含量显著增加;与Cd60.0处理相比,Cd240.0处理下有效镉含量显著升高。在Cd0处理下,HH1根际土壤pH值显著高于MH63;在Cd3.5处理下,HH1根际土壤pH值、Eh值显著低于MH63;在Cd60.0处理下,HH1的Eh值显著低于MH63;在Cd240.0处理下,HH1的Eh值显著低于MH63,总有机碳含量显著低于MH63。双因素方差分析显示,水稻根际土壤Eh值显著受Cd浓度胁迫及水稻品种的独立影响及交互影响,而土壤pH值、总有机碳含量显著受Cd浓度胁迫的独立影响及Cd浓度与水稻品种的交互影响,水稻根际土壤总氮、铵态氮、有效镉含量仅受Cd浓度胁迫影响。可见,Cd浓度增加了水稻根际土壤总氮、铵态氮、有效Cd含量而种植转基因水稻降低了水稻根际土壤Eh值。
由表2可知,不同Cd浓度胁迫下HH1水稻成熟期农艺性状显著不同。与Cd0、Cd3.5处理相比,Cd60.0处理生物量显著降低,Cd240.0处理株高、生物量、产量显著降低;与Cd60.0处理相比,Cd240.0处理的株高与产量均显著降低。不同Cd浓度胁迫下MH63水稻的农艺性状也显著不同。与Cd0处理相比,Cd3.5处理农艺性状无显著差异,Cd240.0处理下水稻株高、产量均显著降低;与Cd3.5相比,Cd60.0处理株高与产量显著降低;与Cd60.0处理相比,Cd240.0处理下水稻株高、产量均显著降低。双因素方差分析显示,水稻株高、生物量显著受Cd浓度胁迫及水稻品种的独立影响及两者的交互影响,水稻产量显著受Cd胁迫独立影响及Cd胁迫与水稻品种的交互影响。可见,水稻农艺性状显著受Cd胁迫抑制。
重金属处理的成熟期水稻各器官中Cd显著富集,无重金属处理的各器官中未检测到Cd。2个品种水稻根部Cd含量均随Cd胁迫浓度增加而显著上升。单因素方差分析结果显示,在Cd3.5、Cd60、Cd240处理下,水稻根中的Cd含量在同一浓度的不同品种间无显著差异,而同一品种的不同浓度处理间具有显著差异;在Cd240处理下,HH1、MH63茎中的Cd含量具有显著差异;在Cd60、Cd240处理下,水稻叶和谷粒中的Cd含量在同一浓度的不同品种间无显著差异,而不同浓度的同一品种间具有显著差异。双因素方差分析显示,水稻根、叶、谷粒Cd含量显著受Cd浓度影响。可见,水稻根部比茎、叶、谷粒更易富集Cd。
2.2 Cd胁迫下转基因水稻对根际土壤细菌群落丰度及Alpha多样性的影响
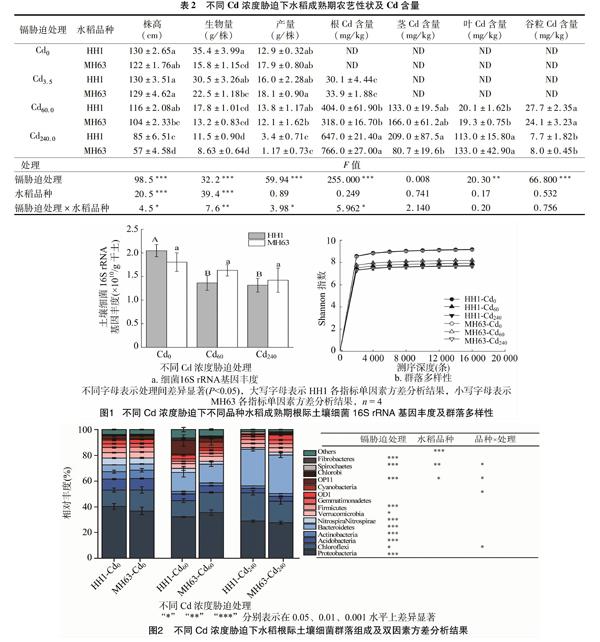
由图1可知,土壤细菌16S rRNA基因数量可以反映土壤细菌群落丰度。随着Cd浓度的增加,HH1和MH63水稻根际土壤细菌群落丰度呈下降趋势。单因素方差分析显示,部分Cd浓度胁迫下HH1水稻根际土壤细菌16S rRNA基因丰度显著不同,与Cd0处理相比,Cd60.0与Cd240.0处理根际土壤细菌群落丰度显著降低。MH63水稻根际土壤细菌群落丰度间无显著差异。双因素方差分析结果显示,根际土壤细菌16S rRNA基因丰度仅受Cd浓度胁迫显著影响和亲本水稻根际土壤细菌群落多样性。
土壤16S rRNA基因在分类水平上的相对丰度能反映土壤中的细菌群落结构和组成(图2)。本研究中的3个处理共获取16个相对丰度高于1%的门水平上的细菌类群。各处理中,Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门)、Acidobacteria(酸杆菌门)、Actinobacteria(放线菌门)Bacteroidetes(拟杆菌门)共5个优势细菌群落,占总细菌群落的70%以上。其中,Proteobacteria的相对丰度最高,占总细菌群落的28.72%~46.63%;Chloroflexi其次,占9.57%~24.72%。
单因素方差分析显示,HH1水稻根际土壤细菌群落组成显著不同,与Cd0处理相比,Cd60.0处理中Proteobacteria(变形菌门)、Acidobacteria、Actinobacteria、Firmicutes(厚壁菌门)的相对丰度显著降低,Bacteroidetes、Fibrobacteres(纤维杆菌门)的相对丰度显著升高;Cd240.0处理中Proteobacteria、Acidobacteria、Actinobacteria、Fibrobacteres、Nitrospirae(硝化螺旋菌门)的相对丰度显著降低而Chloroflexi、Spirochaetes(螺旋体门)的相对丰度显著升高;与Cd60.0处理相比,Cd240.0处理中Chloroflexi、Bacteroidetes的相对丰度显著升高而OP11、Spirochaetes、Fibrobacteres的相对丰度显著降低。单因素方差分析显示,MH63水稻根际土壤细菌群落组成也显著不同,与Cd0处理相比,Cd60.0处理中Acidobacteria、Firmicutes、Actinobacteria的相对丰度显著升高而Fibrobacteres、Bacteroidetes、OP11的相对丰度显著降低,Cd240.0处理中Proteobacteria、Acidobacteria、OP11、Nitrospirae、Actinobacteria、Fibrobacteres的相对丰度显著升高而Bacteroidetes、Spirochaetes的相对丰度显著降低;与Cd60.0处理相比,Cd240处理的Bacteroidetes、OD1的相对丰度显著升高而Fibrobacteres、OP11的相对丰度显著降低。双因素方差分析显示,水稻根际土壤中Acidobacteria、Actinobacteria、Chloroflexi等11个细菌门的相对丰度受Cd浓度胁迫影响,水稻根际土壤中Other、OP11、Spirochaetes的相对丰度受水稻品种影响,Chloroflexi、OD1、OP11、Spirochaetes的相对丰度受水稻品种和Cd浓度的影响。可见,Cd浓度胁迫和水稻品种能显著影响水稻根际土壤细菌群落组成。
2.3 Cd胁迫对转基因水稻根际土壤细菌群落结构及其与环境因子的影响
基于细菌OTU相对丰度的CCA分析结果显示,各处理细菌群落结构发生显著变化(图3)。在各Cd浓度胁迫处理下,HH1和MH63根际土壤细菌群落分布明显不同,ANOSIM相似度分析表明,各Cd浓度胁迫下根际土壤细菌群落结构存在显著差异。但在相同Cd浓度胁迫处理下,HH1和MH63水稻根际土壤细菌群落结构无显著差异。土壤环境因子分析显示,根际土壤pH值、總氮含量、铵态氮含量、总有机碳含量和Eh值影响了根际土壤细菌群落结构(图3),其中pH值、总氮含量和铵态氮含量显著改变了水稻根际土壤细菌群落结构。
3 結论与讨论
3.1 Cd胁迫对水稻生长及土壤微生物的影响
本研究结果显示,Cd胁迫能对水稻生长及土壤微生物产生显著影响。Cd60、Cd240与Cd0处理相比,MH63品种水稻的株高、生物量、产量随着Cd浓度的增加而降低。余飞宇通过对水稻添加60、180 mg/kg 2个Cd浓度胁迫,以不添加Cd胁迫为对照,结果显示,低浓度Cd胁迫下产量比对照增加了6.71%,高浓度条件下,产量比对照下降了9.52%,具有显著差异[18]。王锦文等的研究显示,Cd胁迫显著抑制水稻幼苗芽和根的生长,对根的生长影响最为显著[19]。而龙思斯等的研究结果显示,3种不同污染源中,Cd含量对水稻株高以及稻谷的质量无显著影响[20]。与本研究结果不一致,这可能与水稻品种、土壤理化性质及水稻生长条件有关。已有研究显示,Cd在低浓度时对植物有积极的“刺激作用”,在高浓度时则抑制植物生长[21-22]。有研究者表示,在重金属作用下,一方面植物应激产生保护作用,通过加速生理生化活动产生大量代谢物与重金属缔合以解毒;另一方面,激活的代谢系统也加速了重金属的进入,进而抑制植物的代谢活动,对植物产生毒害作用[23]。
本研究结果显示,随着Cd浓度的增加,土壤细菌16S rRNA基因丰度没有显著变化,而不同Cd胁迫下MH63水稻根际土壤细菌Shannon指数显著不同,与Cd0处理相比,Cd60.0与Cd240.0处理的Shannon指数显著降低,与Cd60.0处理相比,Cd240.0处理的Shannon指数显著降低,表明Cd浓度对土壤细菌群落多样性有显著影响。ANOSIM相似度分析表明,各Cd胁迫下根际土壤细菌群落结构存在显著差异。研究发现,高浓度的Cd可减少土壤细菌、真菌和放线菌数量,Cd对土壤微生物三大菌的抑制效果是细菌>放线菌>真菌。王秀丽等研究发现,Cd对土壤微生物的毒害作用导致土壤微生物数量和种群减少,说明Cd的加入导致土壤微生物群落结构发生显著变化[24]。本研究发现,Cd浓度是影响水稻株高、生物量、产量及根际土壤微生物群落组成、结构的主要因素,同时土壤pH值、总氮含量、铵态氮含量显著影响了水稻根际土壤细菌群落结构。
3.2 转基因作物对根际土壤微生物的影响
本研究发现,与亲本水稻MH63相比,HH1水稻的根际土壤细菌群落丰度、多样性、群落组成与结构均没有显著变化。而Dunfield等研究了在加拿大的4个不同田块连续2年种植4种转抗除草剂基因的油菜和4种常规油菜品种对根际微生物多样性的影响,通过分析表明,转基因油菜品种的根内和根际细菌群落与常规品种有差异[25]。Heuer等研究了转T4溶菌酶马铃薯,指出T4溶菌酶表达的马铃薯与对照相比没有发现根际群落有偏差[26]。刘明等在温室试验中发现,转CryIAb基因玉米(NK4640Bt)和非转基因玉米根际土壤中或添加玉米组织的土壤可培养细菌、放线菌和真菌数量没有显著差异[27-28]。此后,研究者通过SSCP(单链构象多态性)、CLPP(微生物群落生理代谢指纹)、PLFA(磷脂脂肪酸图谱)技术均证实,转Cry1Ab基因玉米系并未引起土壤微生物群落多样性的显著变化。Lin等研究发现,转抗黄瓜花叶病毒的番茄和野生型番茄对土壤微生物数量的影响没有显著差异,而且取样位置比转基因番茄的影响更大[29]。还有研究者发现,影响因素可能是季节、天气、土壤类型、地理位置等环境因子[30]。环境因子也是根际微生物群落变化的重要驱动力。本研究发现,外源基因的转入不会影响水稻根际土壤细菌群落丰度、多样性及群落组成与结构。同时Cd胁迫能显著影响转基因水稻的基因丰度、多样性及群落组成与结构。同时,根际土壤pH值、总氮含量、铵态氮含量显著影响了转基因水稻根际土壤细菌群落结构。另外,研究者还发现植物根际土壤微生物的变化是复杂且长期的过程,因此评估转基因作物对根际土壤微生物的影响时,应该同时监测转基因作物、亲本非转基因作物的长期效应[31]。
综上所述,本研究采用分子生态学技术研究Cd胁迫下转基因水稻对根际土壤微生物的影响,发现Cd胁迫对转基因水稻和亲本水稻农艺性状及根部Cd吸收富集有显著影响,Cd60.0与Cd240.0胁迫能显著降低转基因水稻根际土壤群落丰度和多样性,同时对土壤细菌群落组成及结构产生显著影响,该结果可为转基因水稻环境安全评价提供试验数据。
参考文献:
[1]Borah P,Singh P,Rangan L,et al. Mobility,bioavailability and ecological risk assessment of cadmium and chromium in soils contaminated by paper mill wastes[J]. Groundwater for Sustainable Development,2018,6:189-199.
[2]吴玉峰. 广西典型高背景镉地区的生态风险评价[D]. 南宁:广西师范学院,2016.
[3]Applications A B. Global status of commercialized biotech/GM crops[EB/OL]. [2018-01-10]. http://www.isaaa.org/kc,2004.
[4]刘志诚,叶恭银,胡 萃. 抗虫转基因水稻和化学杀虫剂对稻田节肢动物群落的影响[J]. 应用生态学报,2004,15(12):2309-2314.
[5]Hu T Z,Zhu S S,Tan L L,et al. Overexpression of OsLEA4 enhances drought,high salt and heavy metal stress tolerance in transgenic rice (Oryza sativa L.)[J]. Environmental and Experimental Botany,2016,123:68-77.
[6]Zhao F Y,Wen L,Zhang S Y. Different responses of plant growth and antioxidant system to the combination of cadmium and heat stress in transgenic and non-transgenic rice[J]. Journal of Integrative Plant Biology,2009,51(10):942-950.
[7]Li C H,Zhu J G,Zeng Q,et al. Different responses of transgenic Bt rice and conventional rice to elevated ozone concentration[J]. Environmental Science and Pollution Research,2017,24(9):8352-8362.
[8]Liang Y,Liu F,Li J,et al. Coexistence of Bacillus thuringiensis (Bt)-transgenic and conventional rice affects insect abundance and plant fitness in fields[J]. Pest Management Science,2018,74(7):1646-1653.
[9]陈欣瑶,杨惠子,陈楸健,等. 重金属胁迫下不同区域土壤的生态功能稳定性与其微生物群落结构的相关性[J]. 环境化学,2017,36(2):356-364.
[10]Liu B,Zeng Q,Yan F M,et al. Effects of transgenic plants on soil microorganisms[J]. Plant and Soil,2005,271(1/2):1-13.
[11]Liu W,Lu H H,Wu W X,et al. Transgenic Bt rice does not affect enzyme activities and microbial composition in the rhizosphere during crop development[J]. Soil Biology and Biochemistry,2008,40(2):475-486.
[12]陈 敏,应文荷. 转Bt水稻与常规水稻根际土壤细菌类群的比较研究[J]. 杭州师范学院学报(自然科學版),2005,4(4):290-292.
[13]Wang Z J,Deng H,Chen L H,et al. In situ measurements of dissolved oxygen,pH and redox potential of biocathode microenvironments using microelectrodes[J]. Bioresource Technology,2013,132:387-390.
[14]陈 希. 茶园根际土壤与植物体养分对酸沉降的响应[D]. 南昌:南昌大学,2015.
[15]鲍士旦. 土壤农化分析[M]. 3版.北京:中国农业出版社,2000:232-248.
[16]薛银刚,江晓栋,孙 萌,等. 基于高通量测序的冬季太湖竺山湾浮游细菌和沉积物细菌群落结构和多样性研究[J]. 生态与农村环境学报,2017,33(11):992-1000.
[17]许艳蕊,方志军,卢晓平,等. 基于高通量测序技术分析使它隆对玉米土壤细菌多样性的影响[J]. 微生物学报,2017,57(7):985-993.
[18]余飞宇. 水稻幼苗对镉胁迫的反应及其与全生育期镉积累特性的关系[D]. 扬州:扬州大学,2008.
[19]王锦文,边才苗,陈 珍. 铅、镉胁迫对水稻种子萌发、幼苗生长及生理指标的影响[J]. 江苏农业科学,2009(4):77-79.
[20]龙思斯,宋正国,雷 鸣,等. 不同外源镉对水稻生长和富集镉的影响研究[J]. 农业环境科学学报,2016,35(3):419-424.
[21]宋 建,金凤媚,薛 俊,等. 镉胁迫对植物生长及生理生态效应的研究进展[J]. 天津农业科学,2014,20(12):19-22.
[22]刘小文,齐成媚,欧阳灿斌,等. Pb、Cd及其复合污染对紫茎泽兰生长及吸收富集特征的影响[J]. 生态环境学报,2014,23(5):876-883.
[23]朱艳霞,魏幼璋,叶正钱,等. 有机酸在超积累植物重金属解毒机制中的作用[J]. 西北农林科技大学学报(自然科学版),2006,34(7):121-126.
[24]王秀丽,徐建民,姚槐应,等. 重金属铜、锌、镉、铅复合污染对土壤环境微生物群落的影响[J]. 环境科学学报,2003,23(1):22-27.
[25]Dunfield K E,Germida J J. Diversity of bacterial communities in the rhizosphere and root interior of field-grown genetically modified Brassica napus[J]. FEMS Microbiology Ecology,2001,38(1):1-9.
[26]Heuer H,Kroppenstedt R M,Lottmann J,et al. Effects of T4 lysozyme release from transgenic potato roots on bacterial rhizosphere relative to communities are negligible natural factors[J]. Applied and Environmental Microbiology,2002,68(3):1325-1335.
[27]刘 明,聂 菁,刘紫君,等. 转基因抗病玉米对土壤可培养细菌的影响[J]. 山西农业科学,2016,44(3):353-356.
[28]Griffiths B S,Caul S,Thompson J,et al. Soil microbial and faunal community responses to Bt maize and insecticide in two soils[J]. Journal of Environmental Quality,2006,35(3):734-741.
[29]Lin C H,Pan T M. PCR-denaturing gradient gel electrophoresis analysis to assess the effects of a genetically modified cucumber mosaic virus-resistant tomato plant on soil microbial communities[J]. Applied and Environmental Microbiology,2010,76(10):3370-3373.
[30]Marschner P,Crowley D,Yang C H. Development of specific rhizosphere bacterial communities in relation to plant species,nutrition and soil type[J]. Plant and Soil,2004,261(1/2):199-208.
[31]李孝刚,刘 标,徐文华,等. 转Bt基因抗虫棉对土壤微生物群落生物多样性的影响[J]. 生态与农村环境学报,2011,27(1):17-22.
