大白菜微管与灰霉菌抗性研究
2019-09-23陈晓峰丛山王百川
陈晓峰 丛山 王百川
摘要:对灰霉菌(Botrytis cinerea)诱导抗、感大白菜叶片α-微管蛋白基因诱导表达的特点及微管动态结构变化进行研究。结果表明,灰霉菌接种后大白菜中4种α-微管蛋白基因均具有上调表达特点,且抗病品种较感病品种诱导表达明显。叶片细胞微管免疫荧光观测发现,接种48、96 h后抗病品种较感病品种微管骨架受病原菌侵染影响较小,结构变化不明显。研究结果说明微管在植物对抗真菌病原菌侵染中具有一定的作用。
关键词:大白菜;灰霉菌;叶片细胞;微管;α-微管蛋白;互作动态;结构变化;作用机制
中图分类号:S436.341 文献标志码: A 文章编号:1002-1302(2019)14-0124-03
微管是真核生物细胞的重要组成部分,它和微丝、中间纤维组成植物的细胞骨架结构,在细胞形态发生、信号识别、细胞极性的建立等方面起着至关重要的作用[1-3]。在植物生长发育过程中,微管蛋白还可以调节植物细胞以不同的形态来适应环境和功能需求,同时对植物纤维素和木质素合成,构建完整细胞骨架均具有重要作用[4]。植物微管蛋白主要由α-微管蛋白和β-微管蛋白基因家族组成[4-8],其贯穿整个细胞生长发育的全过程,参与微管的生长发育和动力学变化[9-12]。
最近几年,关于微管骨架在植物抗性研究中的作用越来越受到重视,人们对微管骨架参与植物和病原菌互作中的作用进行了广泛研究[13-25],发现通过化学物质解聚细胞微管可阻碍过敏性坏死反应(hypersensitive response,简称HR)发生,加剧病原菌的入侵,降低植物抗病力[13,22-23]。在病原菌和外源化学物质诱导下,α-微管基因表达也不尽相同[2,14-17,23-25],是否该基因家族全部成员都参与了植物抗性反应目前尚不清楚。
本研究对不同抗性大白菜材料α-微管蛋白基因受病原菌诱导表达的特点进行分析,对微管骨架在寄主与病原菌互作中的动态结构变化进行观察,以期阐明微管在抗真菌病害体系中的作用。
1 材料与方法
1.1 材料
试验于2016—2018年在中国农业大学烟台研究院进行。大白菜抗真菌病害品种为新烟杂3号(XYZ),感病品种为包头莲(BTL)。大白菜种子经消毒后,于人工气候箱在20~25 ℃、光周期12 h/d、相对湿度(85±5)%条件下培养,待幼苗长至2~4张真叶时用于试验。
免疫荧光观测所用果胶酶和纤维素酶,微管标记抗体一抗为抗α-微管蛋白IgG,二抗为FITC结合的羊抗鼠IgG,均采用Sigma公司产品。
1.2 灰霉菌接种液的制备和接种程序
灰霉菌(Botrytis cinerea)接种液的制备和接种参照马清华等的方法[26-27],最终配成的孢子悬浮接种液浓度为1×106个/mL。处理组每个单株叶片喷洒病原菌诱导液,对照组用纯水代替病原菌诱导液。诱导处理后植株在100%相对湿度下保湿24 h,然后揭掉遮光物,于人工气候箱在20~25 ℃、光周期12 h/d、相对湿度(85±5)%条件下培养,直至采样结束,每个处理设3個重复。
1.3 实时定量PCR检测灰霉菌诱导α-微管蛋白基因表达
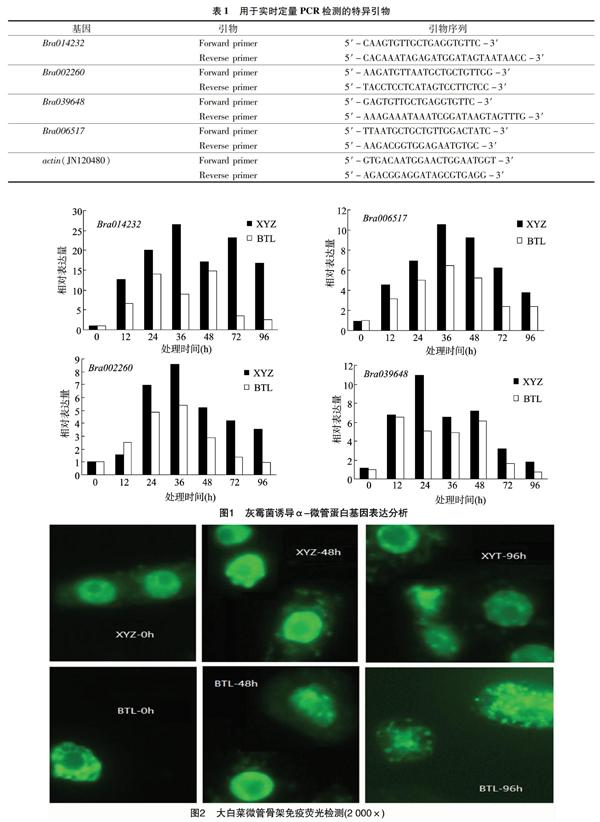
1.3.1 实时定量PCR反应引物设计 在GenBank大白菜数据库中选取所需要的α-微管蛋白基因,引物设计参考Zhang等的研究[2],大白菜actin基因为内标基因,用于实时定量PCR的反应引物序列见表1。
1.3.2 实时定量PCR反应体系和反应程序 采用Takara公司SYBR Premix Ex Taq试剂盒进行实时定量PCR反应。提取处理和对照叶片0、12、24、36、48、72、96 h的大白菜叶片RNA,利用反转录酶将mRNA合成cDNA。实时定量PCR反应体系和反应程序参考陈晓峰等的方法[28],每个处理设3次重复。
1.4 大白菜叶片细胞微管间接免疫荧光检测
分别采集灰霉菌诱导接种0、48、96 h抗感病大白菜植株叶片,参考张静宜等的方法[3]进行微管免疫荧光观测。
2 结果与分析
2.1 灰霉菌诱导α-微管蛋白基因表达分析
由图1可知,4个α-微管蛋白基因均呈现诱导表达特点,但表达特点各不相同。4个基因在抗病品种中的表达均高于感病品种,其中Bra006517和Bra002260基因呈现单峰表达特点,Bra014232基因在所有试验材料中呈现双峰表达特点。4个α-微管蛋白基因均在诱导24~48 h内出现峰值表达量,其中Bra014232基因表现出明显的诱导表达特点,Bra002260、Bra006517、Bra039648呈现较弱的上调表达特点。感病品种中4个基因在诱导48 h后表达量明显下降。
2.2 间接免疫荧光观测大白菜叶片微管结构差异
由图2可知,灰霉菌诱导处理后,抗、感病品种叶片中微管显微结构观测结果表现出明显的差异,在整个诱导过程中,抗病品种XYZ的叶片细胞中细胞核周围微管骨架结构变化不明显,部分细胞微管在病原菌诱导96 h后结构出现不完整现象。感病品种BTL叶片细胞在病原菌诱导48 h后微管骨架结构出现分散现象,病原菌诱导96 h后,绝大部分微管结构出现分散降解现象。
3 结论与讨论
微管蛋白由于在保持细胞结构、胞内物质运输、细胞发育等过程中具有重要作用,人们对其在植物抗病体系中的作用进行了广泛研究。关于微管骨架与植物抗病性关系研究主要集中在病原菌与寄主过敏性坏死反应和抗性化学物质累积等方面[9]。研究发现,通过oryzalin等已知的诱导微管解聚的化学物质处理植物材料,这些植物对外源病原菌侵染诱导过敏反应细胞的产生率降低,抗性降低[9,16,23]。正常条件下植物微管呈网状结构围绕在细胞周围,病原菌侵染植物组织后,免疫荧光观测发现微管骨架分散聚集于侵染点或接种点周围[14-18],说明微管直接或者间接参与了植物的抗性反应。
本研究对大白菜中4种α-微管蛋白基因进行了诱导表达分析,这4个基因在大白菜不同组织中存在特异表达的特点,且受茉莉酸甲酯(MJ)、紫杉醇、赤霉素(GA3)等化学物质诱导[2]。本研究中笔者所在课题组发现4个α-微管蛋白基因均受灰霉菌诱导,呈上调表达特点,且抗病品种中微管蛋白基因表达量略高于感病品种,个别基因在抗病品种中出现双峰表达特点,这都说明微管蛋白基因在抗病品种中参与了大白菜对真菌病原菌侵染的抗性反应。对不同抗性材料叶片细胞中微管骨架的免疫荧动态观测发现,抗病品种叶片细胞中微管骨架结构比较完整,只有少量细胞出现微管降解现象,而感病品种在诱导处理2 d后微管骨架结构出现分散降解,微管降解导致植物细胞结构变化,说明微管骨架结构完整对真菌病原菌与寄主抗性反应的重要性。
未来须要着重研究整个微管基因家族组织和诱导表达特性,同时完善病原菌诱导植物细胞微管骨架的动态研究。
参考文献:
[1]Chan J,Eder M,Crowell E F,et al. Microtubules and CESA tracks at the inner epidermal wall align independently of those on the outer wall of light-grown Arabidopsis hypocotyls[J]. Journal of Cell Science,2011,124(7):1088-1094.
[2]Zhang Y W,Jin D,Xu C,et al. Regulation of bolting and identification of the α-tubulin gene family in Brassica rapa L. ssp pekinensis[J]. Genetics and Molecular Research,2016,15(1):15017507.
[3]张静宜,侯喜林,史公军,等. 白菜组织细胞微管间接免疫荧光检测体系的优化[J]. 园艺学报,2007,34(6):1551-1554.
[4]饶国栋,张建国. 植物微管蛋白基因研究进展[J]. 世界林业研究,2013,26(3):17-20.
[5]Kopczak S D,Haas N A,Hussey P J,et al. The small genome of Arabidopsis contains at least six expressed α-tubulin genes[J]. Plant Cell,1992,4(5):539-547.
[6]Parrotta L,Cai G,Cresti M. Changes in the accumulation of α- and β-tubulin during bud development in Vitis vinifera L.[J]. Planta,2010,231(2):277-291.
[7]Oakley R V,Wang Y S,Ramakrishna W,et al. Differential expansion and expression of α- and β-tubulin gene families in Populus[J]. Plant Physiology,2007,145(3):961-973.
[8]Dixon D C,Seagull R W,Triplett B A. Changes in the accumulation of α- and β-tubulin isotypes during cotton fiber development[J]. Plant Physiology,1994,105(4):1347-1353.
[9]Nogales E . A structural view of microtubule dynamics[J]. Cellular & Molecular Life Sciences Cmls,1999,56(1/2):133-142.
[10]Nogales E,Wolf S G,Downing K H. Structure of the alpha-beta tubulin dimer by electron crystallography[J]. Nature,1998,391(6663):199-203.
[11]Nogales E,Whittaker M,Milligan R A,et al. High-resolution model of the microtubule[J]. Cell,1999,96(1):79-88.
[12]Carpenter J L,Ploense S E,Snustad D P,et al. Preferential expression of an α-tubulin gene of Arabidopsis in pollen[J]. Plant Cell,1992,4(5):557-571.
[13]姚 晶,禹 坷,陳艳利,等. 微管骨架在辣椒-黄瓜炭疽病菌非寄主互作中的作用[J]. 植物病理学报,2013,43(2):136-142.
[14]Skalamera D,Heath M C. Changes in the cytoskeleton accompanying infection-induced nuclear movements and the hypersensitive response in plant cells invaded by rust fungi[J]. Plant Journal,1998,16(2):191-200.
[15]Schmelzer E. Cell polarization,a crucial process in fungal defense[J]. Trends in Plant Science,2002,7(9):411-415.
[16]Christopher-Kozjan R,Heath M C. Cytological and pharmacological evidence that biotrophic fungi trigger different cell death execution processes in host and non-host cells during the hypersensitive response[J]. Physiological and Molecular Plant Pathology,2003,62(5):265-275.
[17]Hardham A R,Jones D A,Takemoto D. Cytoskeleton and cell wall function in penetration resistance[J]. Current Opinion in Plant Biology,2007,10(4):342-348.
[18]Kobayashi I,Kobayashi Y,Yamaoka N,et al. Recognition of a pathogen and a nonpathogen by barley coleoptile cells. Ⅲ. Responses of microtubules and actin filaments in barley coleoptile cells to penetration attempts[J]. Canadian Journal of Botany,1992,70(9):1815-1823.
[19]Takemoto D,Hardham A R. The cytoskeleton as a regulator and target of biotic interactions in plants[J]. Plant Physiology,2004,136(4):3864-3876.
[20]Takemoto D,Jones D A,Hardham A R. GFP-tagging of cell components reveals the dynamics of subcellular reorganization in response to infection of Arabidopsis by oomycete pathogens[J]. Plant Journal,2003,33(4):775-792.
[21]Münch S,Lingner U,Floss D S,et al. The hemi-biotrophic lifestyle of Colletotrichum species[J]. Journal of Plant Physiology,2008,165(1):41-51.
[22]左 海,王海燕,马 青. 微管骨架在小麦抗条锈菌侵染中作用的研究[C]. 中国植物病理学会2012年学术年会. 北京:中国农业科学技术出版社,2012.
[23]郝心愿,李红莉,禹 珂,等. 微丝骨架解聚剂在小麦-黄瓜白粉菌非寄主互作中的作用[J]. 中国农业科学,2011,44(2):291-298.
[24]Li H L,Wang H Y,Hao X Y,et al. Effects of microtubule polymerization inhibitor on the hypersensitive response of wheat induced by the non-host pathogen Sphaerotheca fuliginea[J]. Agricultural Sciences in China,2010,9(3):378-382.
[25]Song X H,Ma Q,Hao X Y,et al. Roles of the actin cytoskeleton and an actin-binding protein in wheat resistance against Puccivia striiformis f. sp. tritici[J]. Protoplasma,2012,249(1):99-106.
[26]馬清华,陈晓峰,牟晋华,等. 灰霉菌侵染大白菜后ADF7和ADF10基因表达分析[J]. 南京农业大学学报,2015,38(5):742-747.
[27]王利英. 不结球白菜黑斑病抗性机制初步研究[D]. 南京:南京农业大学,2008:40.
[28]陈晓峰,隋好林,马清华,等. 霜霉病菌诱导大白菜几丁质酶和葡聚糖酶基因的表达[J]. 山东农业科学,2015,47(2):96-99.
