2种姜属植物组培快繁体系的优化
2019-09-23李昕洋吴丹熊武建
李昕洋 吴丹 熊武建

摘要:分别以光果姜块茎幼芽、珊瑚姜组培苗茎尖为外植体,通过组织培养方式进行芽诱导、芽增殖,以筛选出合适的培养基。结果表明,光果姜适宜的增殖培养基配方为MS+6-BA 5.0 mg/L+TDZ 0.2 mg/L+NAA 0.5 mg/L+瓊脂0.7%+蔗糖3%,此时丛生芽增殖系数相对最大,为3.44,芽增殖时期在20 d左右,平均每株新生幼苗株高为 1.53 cm,新叶展开数为1.80张,且均能自然生根;珊瑚姜增殖诱导的最佳培养基配方为MS+TDZ 0.1 mg/L+NAA 0.5 mg/L+琼脂0.7%+蔗糖3%,此时芽增殖系数为5.47,较佳配方为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+琼脂0.7%+蔗糖3%,此时芽增殖系数为4.47,2个配方芽增殖诱导率均达到100%,外植体褐化死亡率均为0%。
关键词:光果姜;珊瑚姜;快繁体系;生长调节剂;培养基
中图分类号: S632.504+.3 文献标志码: A 文章编号:1002-1302(2019)14-0054-05
姜科植物分布于热带及亚热带地区,兼具药用和观赏价值,是开发新型花卉品种的重要资源。目前,姜科花卉在南方地区已形成一定规模,并从国内外引种了一些品种,但很多品种都没有进行大量开发利用。若想推动其产业发展,加快繁殖是当前必须要解决的问题[1]。
姜科植物通常采用分切根状茎这种常规技术进行繁殖,繁苗速度慢,且生产规模难以扩大。组织培养快繁技术是植物短期内进行大量繁殖的有效途径,采用茎尖、腋芽、幼茎、幼小的花序轴作为外植体[2],在优化组织培养体系的基础上进行组织培养,能够提高植物的再生效率[3],实现姜科种苗的大量繁殖。本研究以光果姜(Zingiber nudicarpum)和珊瑚姜(Z. corallinum)为材料,建立、优化光果姜、珊瑚姜组织培养快速繁殖体系,以提高芽增殖诱导率,降低外植体褐化死亡率,缩短培养周期,为光果姜和珊瑚姜的进一步开发利用奠定良好的基础和技术支持。
1 材料与方法
1.1 试验材料
光果姜引种自海南吊罗山,其带芽块茎采集于华南师范大学生物园内;珊瑚姜引种自广东阳春,其茎尖采集于广东省植物发育生物工程重点实验室前期诱导出的组培苗。6-苄氨基腺嘌呤(6-BA)、苯基噻二唑基脲(TDZ)、萘乙酸(NAA),市购。芽增殖所用基础培养基为MS+琼脂0.7%+蔗糖3%。
1.2 试验方法
1.2.1 光果姜组培快繁体系的优化
1.2.1.1 外植体的获得 采挖光果姜带芽块茎,放入滴有洗洁精的清水中浸泡;用细毛刷将粘连的泥土清洗干净,用蒸馏水冲洗8~10次,在无菌操作台上用70%乙醇、0.1%氯化汞溶液消毒;用无菌水冲洗5次,再用灭菌滤纸吸干表面水分,即获得无菌外植体。
1.2.1.2 芽的诱导 将获得的无菌外植体接种在芽诱导培养基MS+6-BA 2.0 mg/L+NAA 0.1 mg/L上,3个月后即得到无菌幼苗(图1)。为储备足够的无菌苗用于后续芽增殖试验,30 d继代1次,连续继代2~3次。
1.2.1.3 不定芽的增殖 待光果姜无菌苗长至约5 cm时,切下茎基部约0.5 cm,接入基础培养基中添加不同生长调节剂组合的芽增殖培养基上进行培养,每个处理接种30个芽,重复3次。选取6-BA、 TDZ、NAA这3种生长调节剂,其组合采用L16(34)正交设计(表1)。6-BA浓度分别为0、2、3、5 mg/L,TDZ浓度分别为0、0.2、0.4、1.0 mg/L,NAA浓度分别为0、0.5、1.0、2.0 mg/L。每5 d统计1次芽的增殖情况,40 d时调查统计丛生芽的株高、新叶展开数等情况。
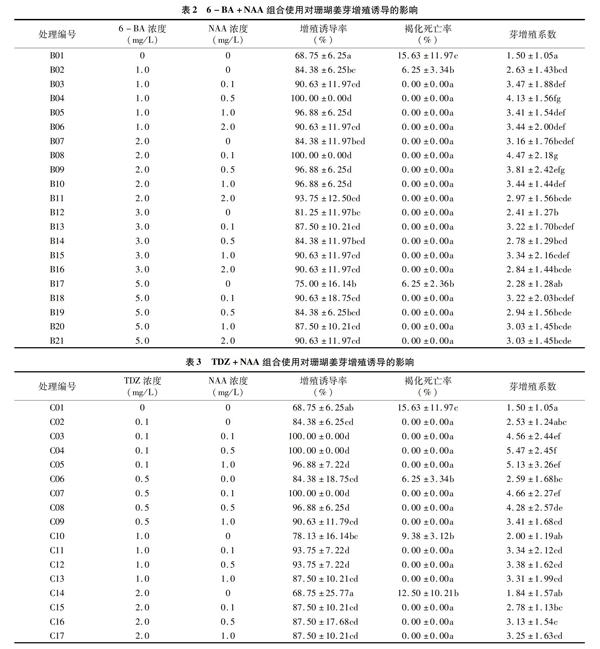
1.2.2 珊瑚姜组培快繁体系的优化 在前期试验的基础上,选取生长健壮的珊瑚姜组培苗,将其叶片及根系适当修剪,留取约1.0 cm的茎尖作为外植体,分别接种到基础培养基中添加不同生长调节剂组合的芽增殖培养基上进行培养,每个处理接种4瓶,重复2次。生长调节剂组合设计见表2、表3,6-BA 浓度分别为1.0、2.0、3.0、5.0 mg/L,TDZ浓度分别为0.1、0.5、1.0、2.0 mg/L,NAA浓度分别为0.1、0.5、1.0、2.0 mg/L。培养40 d后调查统计试验结果。
1.3 组织培养条件
光源为荧光灯,光照时间为16 h/d,光照度为 40 μmol/(m2·s),培养温度为(25±2) ℃。
1.4 统计方法
在试验调查的基础上,统计芽增殖系数、增殖诱导率、褐化死亡率,计算公式如下:
增殖系数=诱导产生芽的总数/接种外植体的总数;
增殖诱导率=(诱导生芽的外植体数/接种外植体总 数)×100%;
褐化死亡率=(褐化死亡的外植体数/接种外植体的总数)×100%。
2 结果与分析
2.1 光果姜组培快繁体系的优化
2.1.1 光果姜芽的诱导 由图2可见,无菌苗接种后10 d左右,外植体开始膨大,15 d开始有芽点形成,之后每10 d左右展开1张新叶,35 d时每个外植体都基本产生新芽,有些已形成幼苗。
2.1.2 不同生长调节剂及其浓度组合对光果姜芽增殖的影响
2.1.2.1 TDZ、NAA使用浓度相对固定 由表1可见,TDZ、NAA使用浓度均为0 mg/L,分别单独使用6-BA浓度为2、3、5 mg/L时,光果姜芽增殖系数分别为2.06±0.32、2.37±0.39、2.57±0.31,随6-BA使用浓度的增加,增殖系数略呈提高的趋势,且相互间差异不显著;随着6-BA使用浓度的增加,幼苗株高及新叶展开数呈先减小后增加的趋势;芽增殖集中时间较6-BA浓度为0 mg/L(CK)时略有缩短。当TDZ、NAA使用浓度分别为0.2、0.5 mg/L固定不变,6-BA浓度分别为2、3、5 mg/L时,光果姜芽增殖系数分别为 3.00±0.50、3.12±0.36、3.44±0.31,随6-BA使用浓度的增加,增殖系数也略呈提高趋势,且相互间差异不显著,芽增殖集中时间分别为25、25、20 d,略有缩短,株高、新叶展开数相互间差异不显著。当TDZ、NAA使用浓度分别为0.4、1.0 mg/L 固定不变,6-BA浓度分别为2、3、5 mg/L时,光果姜芽增殖系数分别为2.25±0.37、3.37±0.37、2.44±0.40,随6-BA使用浓度的增加,增殖系数呈先升高后下降趋势,相互间差异不显著,芽增殖集中时间分别为35、20、20 d,有明显缩短。当TDZ、NAA使用浓度分别为1.0、2.0 mg/L固定不变,6-BA浓度分别为2、3、5 mg/L时,光果姜芽增殖系数分别为2.00±0.33、2.64±0.34、1.40±0.24,随6-BA使用浓度的增加,增殖系数呈先升高后下降趋势,相互间差异不显著,芽增殖集中时间分别为25、25、20 d,略有缩短。可见,6-BA 在2.0~5.0 mg/L单独作用时,随使用浓度的增大,对光果姜芽的增殖有促进作用,但并不明显;TDZ、NAA处于较低水平时,随6-BA浓度的增加,芽增殖系数整体呈升高趋势,但TDZ、NAA处于较高水平时,芽增殖系数表现出先升高后下降的现象,即当6-BA浓度为3.0 mg/L时,芽增殖系数相对最大,且TDZ、NAA低水平下配合使用6-BA对光果姜芽有较好的增殖效果;随6-BA使用浓度的增加,芽集中增殖所用时间总体在缩短,6-BA浓度为5.0 mg/L时芽集中增殖时间多在20 d左右。
2.1.2.2 6-BA使用浓度相对固定 由表1可见,在6-BA使用浓度均为0 mg/L,不同浓度TDZ、NAA共同作用下,3个处理的光果姜芽增殖系數、株高及叶片展开数相互间差异不显著,芽增殖时间也基本一致,为30~35 d;6-BA浓度分别为2.0、3.0 mg/L时,各处理光果姜芽的增殖系数相互间差异不显著;6-BA浓度为5.0 mg/L,TDZ、NAA使用浓度分别为1.0、2.0 mg/L时的芽增殖系数较TDZ、NAA使用浓度分别为0.2、0.5 mg/L时的有显著降低。
2.1.2.3 3种生长调节剂综合使用 由表1可见, 培养基中不使用生长调节剂时,光果姜株高和新叶展开数显著高于其他处理。
2.2 珊瑚姜组培快繁体系的优化
2.2.1 芽的增殖 由图3可见,接种后7 d,大多数外植体开始有侧芽萌动,15 d左右展开第1张新叶,20 d左右单个幼芽基本可以长成完整的植株幼苗,约30 d可形成丛生芽,且生根率达100%。
2.2.2 6-BA+NAA组合对珊瑚姜芽增殖诱导的影响 由表2可见,NAA使用浓度为0 mg/L、单独使用不同浓度6-BA时,均可诱导珊瑚姜芽的增殖,其中以6-BA浓度为 2.0 mg/L 时诱导增殖效果相对最好,增殖系数为3.16±1.76,显著高于不使用生长调节剂的处理(P
6-BA与NAA组合使用时,当6-BA浓度为1.0 mg/L时,随NAA浓度的增加,芽增殖诱导率、增殖系数呈先上升后下降的趋势,NAA浓度为0.5 mg/L时芽增殖诱导率、芽增殖系数相对最大,分别为100.00%、4.13;当6-BA浓度为 2.0 mg/L 时,随NAA浓度的增加,芽增殖系数、芽增殖诱导率逐渐降低,以NAA浓度为0.1 mg/L时芽增殖诱导率、芽增殖系数相对最大,分别为100.00%、4.47;当6-BA浓度为 3.0 mg/L 时,随NAA浓度的增加,芽增殖诱导率整体呈先下降后上升的趋势,芽增殖系数呈波浪形变化,其中,以NAA浓度为 1.0 mg/L 时珊瑚姜芽的增殖诱导率、增殖系数相对最大,分别为90.63%、3.34;当6-BA浓度为5.0 mg/L时,随NAA浓度的增加,芽增殖诱导率整体呈先下降后上升的趋势,芽增殖系数呈先减小后增大的趋势。
2.2.3 TDZ+NAA组合对珊瑚姜芽增殖诱导的影响 由表3可见,NAA使用浓度为0 mg/L、单独使用不同浓度TDZ时,均可诱导珊瑚姜芽的增殖,其中以TDZ浓度为0.5 mg/L时芽增殖系数较高,为2.59;当TDZ浓度超过0.5 mg/L时,芽增殖诱导率逐渐下降,芽增殖系数逐渐减小;随着TDZ浓度的升高,珊瑚姜芽的褐化死亡率逐渐提高,TDZ浓度为 2.0 mg/L 时相对最大,褐化死亡率为12.50%。
TDZ与NAA组合使用时,当TDZ浓度为0.1 mg/L时,随NAA浓度的增加,芽增殖诱导率有所下降但不明显,芽增殖系数呈先增大后减小的趋势,NAA浓度为0.5 mg/L时,芽增殖诱导率、芽增殖系数相对最大,分别为100.00%、5.47;当TDZ浓度为0.5 mg/L时,随NAA浓度的增加,珊瑚姜芽增殖诱导率逐渐降低,芽增殖系数减小,NAA浓度为0.1 mg/L时,芽增殖诱导率、芽增殖系数相对最大,分别为100.00%、4.66;当TDZ浓度为1.0 mg/L时,随NAA浓度的增加,芽增殖诱导率整体呈下降趋势,芽增殖系数呈先增大后减小趋势,NAA浓度为0.5 mg/L时,芽增殖诱导率、芽增殖系数相对最大,分别为93.75%、3.38;当TDZ浓度为2.0 mg/L时,随NAA浓度的增加,芽增殖诱导率基本无变化,芽增殖系数逐渐增大,NAA浓度为1.0 mg/L时芽增殖诱导率、芽增殖系数相对最大,分别为87.50%、3.25。
综上可见,TDZ浓度为0.1 mg/L、NAA浓度为0.5 mg/L配合使用时,珊瑚姜芽的增殖诱导率相对最好,芽增殖系数也相对最大,分别为100.00%、5.47,可作为珊瑚姜芽增殖培养基中最佳的生长调节剂组合,其次为6-BA 2.0 mg/L+NAA 0.1 mg/L,珊瑚姜芽的增殖诱导率、芽增殖系数可分别达到100.00%、4.47。
3 结论与讨论
植物生长调节剂是组培快繁的重要影响因子,不同种类的植物生长调节剂对外植体生长分化的作用效果不同,同种植物生长调节剂不同浓度的作用效果也存在差异,因此,不同植物生长调节剂的合适配比是外植体快速繁殖体系建立的关键。在植物不定芽的诱导增殖研究中,添加的生长调节剂主要为6-BA、NAA、TDZ等,TDZ具有很强的分裂素活性,6-BA是性价比较高的细胞分裂素,热稳定性较好。细胞分裂素的生理作用主要是引起细胞分裂、分化,以及诱导芽的形成,促进芽的生长[4-5]。
有研究发现,生长素在低浓度时可促进生长,浓度高时则抑制生长,如果浓度更高则会使植物受伤[6-7];在芽诱导增殖过程中,高浓度TDZ会使外植体褐化死亡率提高[8-10]。本研究结果表明,光果姜适宜的生长调节剂组合为6-BA 5.0 mg/L+TDZ 0.2 mg/L+NAA 0.5 mg/L,相应丛生芽增殖系数相对最大,为3.44,芽增殖时期在20 d左右,平均每株新生幼苗株高为1.53 cm,新叶展开数为1.80张,珊瑚姜增殖诱导的最佳生长调节剂组合为TDZ 0.1 mg/L+NAA 0.5 mg/L,相应芽增殖系数为5.47,较佳组合为6-BA 2.0 mg/L+NAA 0.1 mg/L,芽增殖系数为4.47,合适的6-BA、TDZ浓度可有利于促进芽增殖诱导,加入一定浓度的NAA能进一步提高其增殖系数,与戴水莲等的研究结果[11]一致,这可能与NAA促进芽的生长和生根,有利于充分吸收培养基中的营养物质有关[12];如继续提高6-BA、TDZ浓度反而会使芽增殖诱导率降低,高浓度细胞分裂素反而会抑制芽的增殖诱导。
参考文献:
[1]王 俊. 三种姜科花卉离体快繁体系的建立[D]. 广州:仲恺农业工程学院,2017.
[2]路国辉,王英强. 姜科植物花卉应用现状及开发前景[J]. 北方园艺,2011(10):82-86.
[3]李 芳. 生姜组织培养快速繁殖及移栽技术的研究[J]. 辽宁农业职业技术学院学报,2016,18(2):13-14,20.
[4]侯 俊,王彩云,张翔宇,等. 驼峰藤组织培养及快速繁殖[J]. 湖北农业科学,2017,56(17):3345-3348.
[5]金美芳,曹 智,蔡俊杰,等. 红花草莓的组织培养与快繁技术研究[J]. 广西植物,2017,37(11):1395-1405.
[6]林碧英,魏郑珍,陈燕华. 生姜茎尖组织培养和快速繁殖研究[J]. 亚热带植物科学,2002,31(4):13-16.
[7]彭 琼,荆风雪,周小毛,等. 四倍体稗草的组织培养与快速繁殖[J]. 激光生物学报,2017,26(5):475-480.
[8]张月婷,桂大萍,叶小文,等. TDZ在花生离体扩繁中的应用研究[J]. 江苏农业科学,2011(1):65-68.
[9]Archana C P,Geetha S P,Indira B. Effect of ammonium nitrate and photoperiod on in vitro microrhizome induction in three high yielding cultivars of Curcuma longa L. and their comparative phytochemical analysis[J]. Asian Journal of Pharmaceutical Science and Technology,2015,5(1):45-49.
[10]吴 凡,赵蓓蓓,王 浩,等. 植物生长调节剂对紫霞黄栌组织培养的影响[J]. 湖北农业科学,2017,56(15):2942-2946,2958.
[11]戴水蓮,谢绍辉,李 涛. 生姜芽的组培快繁[J]. 安徽农业科学,2008,36(28):12112-12113.
[12]刘 果,陈少雄,高丽琼,等. 两种优良巴西杂交桉树的组织培养和快速繁殖[J]. 桉树科技,2017,34(4):10-16.
