青藏高原土壤微生物多样性研究进展
2019-09-23赵龙妹
赵龙妹
摘要:土壤微生物是土壤生态系统中的重要组成部分,其多样性在整个土壤生态系统的物质循环中起着关键作用,因此对其多样性的研究具有重要意义。土壤微生物多样性受到环境和人为干扰等多方面的影响,随着研究的不断深入,对其研究的方法也从传统培养法发展到生化法和分子生物学法。目前青藏高原土壤微生物多样性的研究已经取得一些进展,本文从青藏高原土壤微生物多样性的影响因素、研究方法和研究現状等方面简要地综述了目前国内外的相关进展。
关键词:青藏高原;土壤微生物多样性;影响因素;研究方法
中图分类号:S154.3 文献标志码: A 文章编号:1002-1302(2019)14-0006-07
土壤微生物是土壤的重要组成部分,主要包括原核微生物(细菌、蓝细菌、放线菌、超显微结构微生物)和真核微生物(原生动物、真菌、藻类、地衣)两大类,在整个土壤物质的循环中扮演着一个重要的角色。因此,土壤微生物的组成、分布及其多样性是研究土壤生态功能和土壤生态平衡的关键,同时,土壤微生物的多样性也受到不同地理环境中土壤理化性质的制约[1]。土壤微生物多样性主要包括遗传多样性、物种多样性以及生态系统多样性,其中物种多样性是土壤微生物多样性研究中最基本的内容[2]。
青藏高原地势高纬度低,地域辽阔,平均海拔超过 4 000 m,是目前全球海拔最高、面积最大的生态系统,独特的地理位置造成了其特有的生态环境,青藏高原生物特有种丰富,珍稀濒危物种多,从东南到西北分布着森林、灌丛、草甸、草原和荒漠等生态系统[3]。正是由于青藏高原生态系统的复杂多样性,使其土壤微生物种类具有多样性。土壤微生物的主要功能是降解土壤中的有机质,包括纤维素、半纤维素和木质素等木质纤维类物质,以此推动土壤生态系统中的物质循环。此外,土壤微生物也是土壤生态系统状态的指示剂,正常情况下,土壤微生物都具备一定的多样性,但是当土壤生态系统遭受到外界破坏时,比如由于过度放牧所引起的退化现象等,土壤微生物的多样性以及功能微生物的活性都会发生不同程度的减少和丧失;相反,引入特定的植物微生物共生体系能够帮助沙漠化生态系统的恢复[4]。因此,土壤微生物与其所在的生态系统之间存在着密切的互作关系。
青藏高原土壤微生物资源具有其独有的特异性和丰富性,具有极高的科研价值,研究青藏高原土壤微生物资源特点对于探讨分析高原乃至全球气候环境变化、生物多样性以及碳循环都具有非常重要的意义。本文针对青藏高原土壤微生物多样性的影响因素、研究方法和现状等作一简要综述。
1 土壤微生物多样性的影响因素
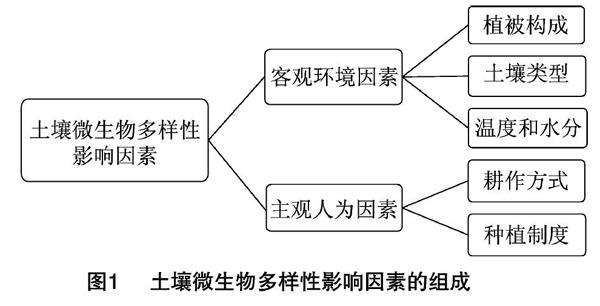
土壤微生物参与土壤动态生化循环的多个过程中,如土壤有机质的分解、腐殖质的形成、储备土壤养分以及为植物提供生长所需养分。土壤微生物多样性主要指在遗传、种类、结构功能和生态系统层次上,不同微生物所表现出的变化,也指土壤生态系统中所有微生物种类及其基因与环境之间相互作用的多样化程度,可以理解为微生物生命体构成的丰富性,它代表了微生物群落的稳定性,也反映了土壤生态机制和土壤胁迫对群落的影响[5-6]。影响土壤微生物多样性的因素,总体上可分为两大类:一类是客观环境因素,包括植被构成、土壤类型、温度、水分;另一类是主观人为因素,包括耕作方式和种植制度等管理方式(图1)。
1.1 植被构成
植被生长代谢过程中所需的大量养分来源于土壤,而土壤中的养分又来源于微生物的代谢作用,比如根系固氮菌通过固氮作用提供土壤中的氮素等;另一方面,植物生长代谢过程中给周围环境带来的变化也间接影响着土壤微生物,植被对土壤中有机碳氮水平、含水量、温度、通气性以及pH值产生一定影响,从而间接地影响土壤微生物的多样性,土壤微生物生长所需的有机物和能量来源于植被,如植物凋落物等,植被的存在也影响着土壤微生物的生存环境条件,比如土壤中含水量的变化受到植被疏密度的影响。因此,植被影响着土壤微生物多样性和土壤微生物的生物量[7-9]。研究发现,不同草地类型土壤的养分含量随深度增加的变化规律不同[10],这就导致不同草地类型不同层之间微生物多样性的差异。现有研究发现,植物种类能够影响土壤中的微生物群落多样性(表1)。Zhang等通过使用宏基因组测序技术研究植被生产力和微生物多样性之间的关系发现,植被生产力或者多样性下降后,微生物可利用的新鲜植物资源减少,从而增加了生态环境筛选的压力,使一些跟能量生产或转化、物质运输或代谢以及氨基酸循环相关的基因留存下来,而其他功能基因被淘汰;植被的缺失或增加所引起的碳能资源数量的变化会导致微生物功能基因多样性的改变,而这种关系也构成了地上和地下群落间的重要联结,异于传统的将植被多样性同微生物种类多样性联系在一起的理论观点[11]。
1.2 土壤条件
土壤微生物多样性与土壤特性密切相关[12],其主要与动植物的生物活性相关,但生物活性带来的影响比较复杂,同时也会影响土壤本身的理化性质。有研究比较了南极洲菲尔德斯(Fildes)地区4种不同种类土壤的微生物多样性和菌群结构,发现pH值、磷酸盐磷、有机碳、有机氮含量是影响土壤微生物菌群结构最显著的因素[13]。除土壤本身条件外,灌溉方式、森林采伐、植物凋落物、碳氮循环等都会对土壤中的微生物产生影响。
1.3 管理方式
人类对土壤的管理方式包括一系列的耕作制度、对农田施加肥料、对植物施加农药等人为干预,都是通过改变土壤的理化特性而对土壤微生物多样性产生影响。对瑞典南部不同农耕制度下田地土壤中丛枝菌根真菌(AMF)的组成和多样性研究发现,永久牧场中的AMF多样性最高,而耕作会削弱AMF的多样性;地理位置、土壤类型、土壤的特性都不会影响AMF的多样性和区系组成;AMF区系组成主要受到不同农耕制度的影响,传统农耕过程中施用的肥料会影响土壤微生物的生命活动,使AMF的多样性降低,而有机农耕能够维持更高的AMF多样性[14]。农业管理措施能够改变土壤的理化特性,影响微生物的生长环境和群落区系组成,与微生物多样性间可以相互影响作用[15]。土地使用方式的改变能够显著地影响土壤质量及其可持续性[16]。研究发现,有机农耕表层的土壤微生物生物量、有机碳氮量以及土壤酶活性都比传统农耕和森林高,土地使用方式地改变能够显著地改变表层土壤微生物特性,而对底层土壤微生物特性影响较小[17]。
1.4 土壤理化性质
土壤理化性质是指土壤自身所表现出的一种物理化学特点,包括土壤pH值、有机质和氮磷含量等,能够直接影响土壤微生物资源库的组成。研究发现,森林采伐作业能够通过降低土壤的多孔性和有机功能而显著地影响土壤理化性质,土壤理化性质的改变又会导致土壤微生物群落(固氮和硝化细菌)定性和定量的变化;定性变化主要体现在物種的数量上,定量变化主要体现在微生物物种的丰度和均匀度上[18]。此外,土壤固氮微生物群落的多样性随着土壤pH值升高呈线性增加[19-22]。
1.5 温度和水分
温度和水分对土壤微生物多样性的影响可以概括为气候的影响,不同季节、气候影响太阳辐射热量以及降雨量,从而改变温度和水分。土壤温度以及土壤含水量的变化会影响植物新陈代谢速度,进而使植物向土壤中释放与微生物生长相关的分泌物的过程受到影响,最终改变土壤中微生物的多样性。虽然新陈代谢速度会随着含水量的升高而升高,但是对于一些极端环境而言,如热带沙漠生态系统,水分含量的突然增加对土壤微生物带来的影响还存在一定争议。有学者在沙漠土壤的围隔试验中建立了不同程度降水量和温度的模型,模拟了微生物区系在21 d中的应答,发现影响因素是降雨强度和温度的交互作用;此外,气候变暖和干旱都会对土壤微生物多样性带来影响,导致土壤微生物种类的变更[23-25]。
2 土壤微生物多样性研究方法
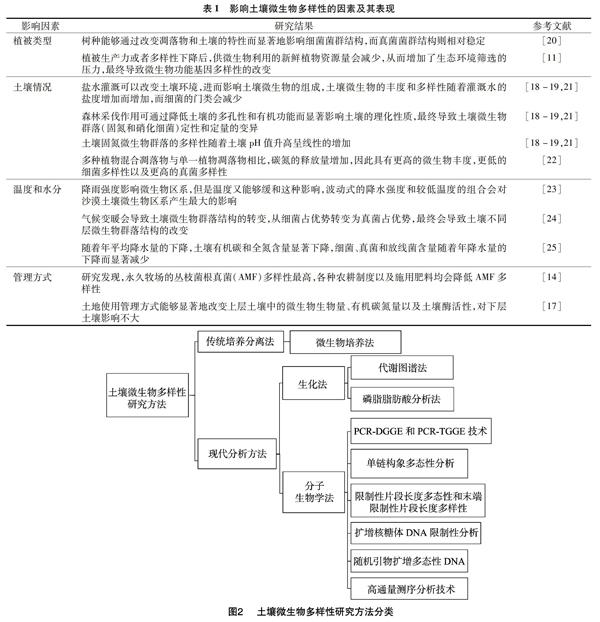
土壤微生物多样性研究主要针对土壤环境微生物的种属、丰度、分布均匀度、结构变化和群落功能多样性等进行,包括细菌、真菌、古菌等,土壤微生物多样性可分为遗传多样性、功能多样性、结构多样性、物种多样性[26]。随着科学的发展、研究技术的进步,其研究方法从最传统的一般培养法开始,历经了改变和革新,逐渐向生化技术和分子生物学技术方面发展(图2)。
2.1 传统培养分离法
土壤微生物多样性的研究方法主要有分为两大类,一类是传统的培养分离法,此方法通过对样品进行稀释、涂布选择性平板、培养分离,获取菌落总数和菌落形态来确定微生物的类型和组成,操作较简单,容易掌握,但工作量较大。土壤中含有大量利用现在的技术手段不可培养的微生物,可培养微生物仅占微生物总数的0.1%~1%[27],因此,这种方法具有一定的局限性,仅仅依赖此方法获得的研究结果只可片面地描述土壤中可培养的微生物多样性情况,而不能够获得土壤所有微生物多样性的情况。但是通过微生物培养法,能够获得某些微生物的特征性数据,比如菌落形态等,也可使用传统培养法对微生物的功能多样性进行深层次研究,因此在目前的研究中,可结合传统微生物培养法与其他研究方法共同阐述土壤微生物多样性的具体情况。
2.2 生化法和分子生物学法
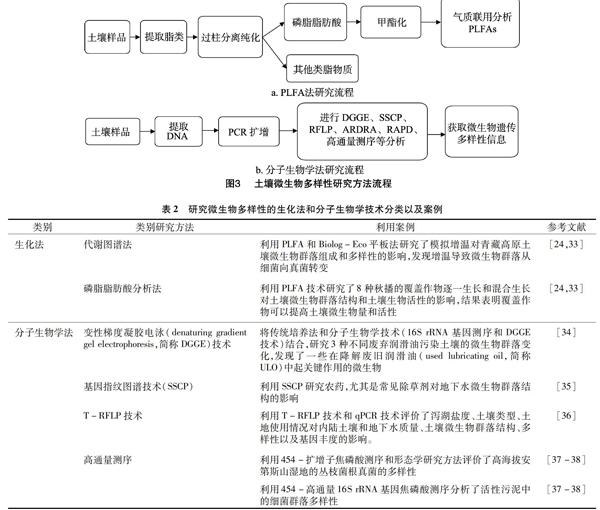
生化技术和分子生物学技术在土壤微生物多样性研究中的应用,大大提高了研究的效率和精确度。生化法主要包括基于底物利用率的代谢图谱法和磷脂脂肪酸分析法,其中代谢图谱法主要指Biolog微孔板法和底物诱导呼吸法,此类方法主要根据微生物代谢过程中产生的特征指纹图谱来对其群落多样性进行鉴定,适用于可正常培养且生长速度正常的微生物,磷脂脂肪酸分析法是利用活细胞细胞膜磷脂成分中的磷脂脂肪酸(phospholipid fatty acid,简称PLFA)的结构多样性和生物学特异性来对土壤微生物群落结构进行分析,该方法的准确性主要取决于脂肪酸的提取效果(图3-a);分子生物学法是利用分子生物学技术,以土壤微生物的遗传信息为对象进行研究,从而获取土壤微生物多样性信息,主要包括聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,简称PCR-DGGE)、聚合酶链式反应-温度梯度凝胶电泳(polymerase chain reaction-temperature gradient gel electrophoresis,简称PCR-TGGE)技术、单链构象多态性分析(SSCP)、限制性片段长度多态性(RFLP)、末端限制性片段长度多态性(T-RFLP)和扩增核糖体DNA限制性分析(ARDRA)、随机引物扩增多态性DNA(RAPD)、荧光原位杂交技术、高通量测序分析技术等[28-30]。利用分子生物学法研究土壤微生物多样性,首先要使用合适的方法从土壤中有效提取遗传物质DNA或RNA,然后以此遗传物质为对象,通过PCR扩增获取目的片段,根据所选择的方式,对片段进行测序、电泳、酶切等来分析遗传多样性(图3-b)。因此,合理有效地提取土壤中的遗传物质至关重要,应该针对不同土壤特性选取不同的提取方法。在提取污染和非污染土壤中细菌DNA的过程中,比较了2种提取方法,发现如果在细胞裂解的过程中进行腐殖酸纯化,能更好地除去蛋白质和RNA,相反如果在细胞裂解后纯化土壤中的腐殖酸则能够更好地除去腐殖酸,这2种方法对DNA的提取率没有影响,但是土壤细菌数量和菌群结构都受到了影响[31]。已有不少学者利用生化法和分子生物学方法来研究土壤微生物多样性,取得了相应的进展(表2)。综上所述,研究土壤微生物多样性的试验方法很多,每种方法都有优缺点、针对性和方向性,只有将多种方法有机地结合起来才能够全面地分析土壤微生物的生态特征,这也是如今研究土壤微生物生态结构的常用方法[32]。
3 青藏高原土壤微生物研究现状
目前,对青藏高原土壤微生物的研究主要集中在2个方向,一个是针对青藏高原特有的生态系统和土壤环境,研究土壤理化性质、土壤微生物量、功能微生物、基因丰度、土壤酶活性等指标的具体表现以及随着海拔梯度或植被类型变化所产生的影响;另一个方向是探究不同的处理方式(包括放牧、模拟升温以及植被恢复方式等)对土壤微生物群落的影响,旨在逐步揭示自然条件的变化和人为干扰对青藏高原微生物多样性带来的影响。
3.1 不同地域生态系统土壤微生物的研究
一些学者对青藏高原高寒草甸、冻土区以及沼泽等地区的土壤微生物群落结构以及土壤酶活性进行了研究,发现了土壤微生物多样性的变化规律。通过对青藏高原高寒草甸土壤微生物量和酶活性进行研究,发现矮嵩草草甸土壤酶活性显著大于金露梅丛间草地,且更有利于提高土壤养分并促进土壤微生物的生长和繁殖[39]。采用传统平板培养法分析研究青藏高原不同退化程度高寒草甸土壤0~30 cm土层的细菌、真菌和放线菌数量,结果表明随着高寒草甸退化程度增加,土壤微生物数量大幅度减少,其中真菌数量显著降低[40]。采用PLFA技术对青藏高原藏东南地区色季拉山不同海拔森林土壤微生物群落结构进行研究,发现随着海拔增高,土壤理化性质和生化指标没有发生显著变化,而微生物丰度呈现中峰优势分布规律,在海拔3 900 m和4 000 m处生物量显著高于低海拔和更高海拔[41];此外,该学者也使用PLFA方法对念青唐古拉山沼泽土壤微生物群落和酶活性进行了研究,结果显示,高寒沼泽土壤理化指标、土壤酶活性和土壤微生物量都随海拔增高而减小,年平均气温是影响该生态系统土壤微生物群落结构和土壤酶活性变化的重要因子[42]。利用454焦磷酸测序技术对青藏高原阿里地区土壤菌群结构多样性进行研究,发现该地区土壤细菌有34大门类,微生物的相对丰度都与土壤总碳呈现一定的相关,且上层土壤微生物物种多样性和系统发育多样性显著高于下层,土壤总碳对细菌群落的分布起主要作用[1]。对青藏高原冻土区土壤微生物的研究发现,随着土壤深度增加,冻土年代递增,可培养的微生物数量显著减少,土壤中可培养微生物的数量与土壤理化性质无显著相关关系,而与土壤深度关系密切[43],通过PCR技术和构建克隆文库对冻土垂直剖面土壤中微生物多样性进行研究,发现垂直剖面土壤中的古菌属于泉古菌和广古菌2个门,细菌分属于10个类群,真菌均属于子囊菌门和担子菌门,多样性较高[44]。利用Illumina测序技术分析青藏高原中部冻土区上层30 cm土壤中细菌群落组成,发现属于酸杆菌门、变形菌门、拟杆菌门的较多[45]。青藏高原地区拥有多种极端环境,因此微生物资源相对丰富[46-49],通过对不同群落组成地上生物量、土壤养分及土壤微生物数量的分析,发现圆穗蓼草甸由于含水量较低,养分含量较好,土壤真菌、细菌和放线菌数量较多[50]。通过对青藏高原土壤中可培养放线菌的分析研究,筛选出的1 930株放线菌属于11亚目16科,初步的分类学研究发现至少包括22属,其中10种属于迄今未知的种类[51]。在对青藏高原永久冻土区土壤原核微生物多样性的研究中,发现大多数微生物属于新种,表现出与现有种差异较大的多样性,细菌多样性和群落组成随着取样深度发生显著变化,这些变化主要是由土壤生态因子(碳氮含量、pH值、传导率)的变化而引起的[12]。通过对青藏高原不同海拔梯度土壤进行模拟增温和降温,利用16S rRNA基因测序分析土壤细菌群落,结果显示增温会导致α-变形菌、γ-变形菌、放线菌的相对丰度增加,酸杆菌、β-变形菌、δ-变形菌的相对丰度减少,而降温会产生相反的结果,因此,增温和降温带来的土壤中细菌种类的变化与温室效应相关[9]。针对青藏高原冻土区,有学者研究了植被类型和土壤特性对微生物多样性的影响,发现微生物类群在不同植被类型土壤中的变化规律,在沼泽草甸、草甸、干草原、荒漠草原中,变形菌门和酸杆菌门的比例逐渐降低,而子囊菌门和担子菌门的比例逐渐升高,此外,还发现土壤中的碳氮比影响细菌群落多样性,土壤水分含量影响真菌群落多样性[52]。此外,也有研究分析了特殊功能基因在青藏高原土壤微生物中的分布情况,发现林芝、日喀则和那曲地区土壤中的微生物能够检测到厌氧氨氧化菌,而且旱地与湿地相比具有更高的多样性[53]。综上所述,已有学者针对青藏高原特殊地域土壤的微生物群落组成情况作了细致的研究,并获得了一些进展。
3.2 不同处理方式对土壤微生物影响的研究
不同处理方式对于土壤微生物群落乃至整个土壤生态系统都会产生较大的影响,青藏高原土壤生态系统比较复杂,有相关研究报道了放牧、增温以及植被恢复方式等对青藏高原土壤微生物群落产生的影响。通过对青藏高原高寒草甸4个放牧梯度下土壤微生物特征比较分析发现,中等放牧水平处理下的土壤微生物量较高,放牧强度对微生物群落结构不存在显著影响,适度放牧可以增加土壤有效碳氮库[54]。通过开顶式温室(open top chambers,简称OTCs)升温以及刈割、施加牛粪处理,采用PLFA方法研究了青藏高原东部高寒草甸土壤微生物群落结构对气候变暖和放牧的响应,发现模拟升温和放牧均可显著影响土壤微生物群落结构,增加细菌相对含量,降低真菌相对含量,因此放牧和全球气候变暖会显著影响青藏高原高寒草甸土壤微生物群落结构,进而可能会对该区整个生态系统造成影响[55-56]。也有研究发现,在短期内增温能够改善青藏高原高山草甸土壤生化和微生物相关指标[57]。有学者研究分析了几种不同的植被恢复方式对高寒草原区土壤微生物的影响,结果发现与自然恢复相比,人工种植植被能够更快速有效地增加植被盖度和多样性,提高土壤微生物物种和功能多样性[58],对于遭到破坏的青藏高原生态系统,使用单播梭罗草的人工种植方式能够获得较好的恢复效果。通过研究增温和氮沉积对青藏高原高寒草甸生态系统的影响,发现氮沉积显著改变了土壤表层微生物群落,尤其降低了真菌/细菌值,增温会导致真菌多样性降低、放线菌多样性增加,这些变化都是通过影响土壤特性和植物群落而产生的[59]。通过研究紫外线辐射对青藏高原高寒草甸生态系统中微生物群落的影响,发现紫外线辐射会降低土壤可培养细菌数量和种类[60]。随着寒区油气资源的开发利用,青藏高原高寒地區的生态环境遭到原油污染的程度日益加剧,通过对青藏高原土壤中原油降解菌的研究,从10个原始土样中富集培养获取了53种微生物和相应的94种降解酶基因,以假单胞菌和不动杆菌为优势菌群,此外还包括变形菌、放线菌、拟杆菌,降解酶基因的多样性低于海洋环境和极地环境样品,这些结果也反映了青藏高原生态环境还未遭到原油的严重污染[47]。因此,外界环境因素的变化会对青藏高原土壤微生物群落组成产生影响,进而导致青藏高原整个生态系统状态的改变,这些改变还将作用于微生物群落,从而产生周而复始的影响。
4 結语
青藏高原作为全球平均海拔最高的自然生态地区[61-62],在近年来人为干扰和气候变化的作用下,其生态系统结构和物种数量发生了较大的变化,这些变化又与全球气候和生态变化息息相关,因此对青藏高原地区土壤微生物多样性进行深入研究很有必要,通过将传统研究方法和生化、分子生物学研究方法进行有机结合,来研究土壤微生物生态系统多样性以及群落结构的变化,进而揭示青藏高原生态系统物质循环规律,为更好地保护以及合理利用青藏高原生态环境提供有利条件。
参考文献:
[1]Shanmugam,S,Magbanua Z,Williams M A,et al. Bacterial diversity patterns differ in soils developing in sub-tropical and cool-temperate ecosystems[J]. Microbial Ecology,2017,73(3):556-569.
[2]孙怀博. 青藏高原阿里地区土壤细菌群落多样性及其分布的研究[D]. 南京:南京农业大学,2013.
[3]张宪洲,杨永平,朴世龙,等. 青藏高原生态变化[J]. 科学通报,2015,60(32):3048-3056.
[4]Requena N,Perez-Solis E,Azcon-Aguilar C,et al. Management of indigenous plant-microbe symbioses aids restoration of desertified ecosystems[J]. Applied and Environmental Microbiology,2001,67(2):495-498.
[5]杨海君,肖启明,刘安元. 土壤微生物多样性及其作用研究进展[J]. 南华大学学报(自然科学版),2005,19(4):21-26,31.
[6]林先贵,胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报,2008,45(5):892-900.
[7]周 桔,雷 霆. 土壤微生物多样性影响因素及研究方法的现状与展望[J]. 生物多样性,2007,15(3):306-311.
[8]Shang W,Zhao L,Wu X D,et al. Soil organic matter fractions under different vegetation types in permafrost regions along the Qinghai-Tibet Highway,north of Kunlun Mountains,China[J]. Journal of Mountain Science,2015,12(4):1010-1024.
[9]Rui J P,Li J B,Wang S P,et al. Responses of bacterial communities to simulated climate changes in alpine meadow soil of the Qinghai-Tibet Plateau[J]. Applied and Environmental Microbiology,2015,81(17):6070-6077.
[10]顾振宽,杜国祯,朱炜歆,等. 青藏高原东部不同草地类型土壤养分的分布规律[J]. 草业科学,2012,29(4):507-512.
[11]Zhang X,Johnston E R,Barberan A,et al. Decreased plant productivity resulting from plant group removal experiment constrains soil microbial functional diversity[J]. Global change biology,2017,23(10):4318-4332.
[12]Hu W G,Zhang Q,Tian T,et al. Characterization of the prokaryotic diversity through a stratigraphic permafrost core profile from the Qinghai-Tibet Plateau[J]. Extremophiles,2016,20(3):337-349.
[13]Wang N F,Zhang T,Zhang F,et al. Diversity and structure of soil bacterial communities in the Fildes Region (maritime Antarctica) as revealed by 454 pyrosequencing[J]. Frontiers in microbiology,2015,6:1188.
[14]Manoharan L,Rosenstock N P,Williams A,et al. Agricultural management practices influence AMF diversity and community composition with cascading effects on plant productivity[J]. Applied Soil Ecology,2017,115:53-59.
[15]Lei Y P,Xiao Y L,Li L F,et al. Impact of tillage practices on soil bacterial diversity and composition under the tobacco-rice rotation in China[J]. Journal of Microbiology,2017,55(5):349-356.
[16]泽让东科,文勇立,艾 鷖,等. 放牧对青藏高原高寒草地土壤和生物量的影响[J]. 草业科学,2016,33(10):1975-1980.
[17]Maharjan M,Sanaullah M,Razavi B S,et al. Effect of land use and management practices on microbial biomass and enzyme activities in subtropical top-and sub-soils[J]. Applied Soil Ecology,2017,113:22-28.
[18]Cambi M,Paffetti D,Vettori C A,et al. Assessment of the impact of forest harvesting operations on the physical parameters and microbiological components on a Mediterranean sandy soil in an Italian stone pine stand[J]. European Journal of Forest Research,2017,136(2):205-215.
[19]Wang Y S,Li C N,Kou Y P,et al. Soil pH is a major driver of soil diazotrophic community assembly in Qinghai-Tibet alpine meadows[J]. Soil Biology & Biochemistry,2017,115:547-555.
[20]Li W B,Bai Z,Jin C J,et al. The influence of tree species on small scale spatial heterogeneity of soil respiration in a temperate mixed forest[J]. Science of the Total Environment,2017,590/591:242-248.
[21]Chen L J,Li C S,Feng Q,et al. Shifts in soil microbial metabolic activities and community structures along a salinity gradient of irrigation water in a typical arid region of China[J]. Science of the Total Environment,2017,598:64-70.
[22]Santonja M,Rancon A,Fromin N,et al. Plant litter diversity increases microbial abundance,fungal diversity,and carbon and nitrogen cycling in a Mediterranean shrubland[J]. Soil Biology & Biochemistry,2017,111:124-134.
[23]Sˇtovícˇek A,AekAzatyan A,Soares M I M,et al. The impact of hydration and temperature on bacterial diversity in arid soil mesocosms[J]. Frontiers in Microbiology,2017,8:1078.
[24]Wang C T,Zhao X Q,Zi H B,et al. The effect of simulated warming on root dynamics and soil microbial community in an alpine meadow of the Qinghai-Tibet Plateau[J]. Applied Soil Ecology,2017,116:30-41.
[25]斯貴才,王光鹏,雷天柱,等. 青藏高原东北缘土壤微生物群落结构变化[J]. 干旱区研究,2015,32(5):849-855.
[26]曹宏杰,倪红伟. 土壤微生物多样性及其影响因素研究进展[J]. 国土与自然资源研究,2015(3):85-88.
[27]Kirk J L,Beaudette L A,Hart M,et al. Methods of studying soil microbial diversity[J]. Journal of Microbiological Methods,2004,58(2):169-188.
[28]蔡晨秋,唐 丽,龙春林. 土壤微生物多样性及其研究方法综述[J]. 安徽农业科学,2011,39(28):17274-17276,17278.
[29]李 洁,李睿玉,杨 红,等. 土壤微生物多样性的研究方法[J]. 山西农业科学,2016,44(11):1738-1742,1746.
[30]吴才武,赵兰坡. 土壤微生物多样性的研究方法[J]. 中国农学通报,2011,27(11):231-235.
[31]Mazziotti M,Henry S,Laval-Gilly P,et al. Comparison of two bacterial DNA extraction methods from non-polluted and polluted soils[J]. Folia microbiologica,2017,63(1):85-92.
[32]Widmer F,Fliessbach A,Laczko E,et al. Assessing soil biological characteristics:a comparison of bulk soil community DNA-,PLFA-,and BiologTM-analyses[J]. Soil Biology & Biochemistry,2001,33(7/8):1029-1036.
[33]Finney D M,Buyer J S,Kaye J P. Living cover crops have immediate impacts on soil microbial community structure and function[J]. Journal of Soil and Water Conservation,2017,72(4):361-373.
[34]Meeboon N,Leewis M C,Kaewsuwan S,et al. Changes in bacterial diversity associated with bioremediation of used lubricating oil in tropical soils[J]. Archives of Microbiology,2017,199(6):839-851.
[35]Mauffret A,Bara N,Joulian C. Effect of pesticides and metabolites on groundwater bacterial community[J]. Science of the Total Environment,2017,576:879-887.
[36]Canfora L,Salvati L,Benedetti A,et al. Is soil microbial diversity affected by soil and groundwater salinity? Evidences from a coastal system in central Italy[J]. Environmental Monitoring and Assessment,2017,189(7):319.
[37]Silvani V A,Colombo R P, Scorza M V,et al. Arbuscular mycorrhizal fungal diversity in high-altitude hypersaline Andean wetlands studied by 454-sequencing and morphological approaches[J]. Symbiosis,2017,72(2):143-152.
[38]Huang C K,Shi Y J,Sheng Z Y,et al. Characterization of microbial communities during start-up of integrated fixed-film activated sludge (IFAS) systems for the treatment of oil sands process-affected water (OSPW)[J]. Biochemical Engineering Journal,2017,122:123-132.
[39]牛 犇,張立峰,马荣荣,等. 高寒草甸土壤微生物量及酶活性的研究[J]. 南开大学学报(自然科学版),2016,49(4):53-60.
[40]于健龙,石红霄. 高寒草甸不同退化程度土壤微生物数量变化及影响因子[J]. 西北农业学报,2011,20(11):77-81.
[41]斯贵才,袁艳丽,王 建,等. 藏东南森林土壤微生物群落结构与土壤酶活性随海拔梯度的变化[J]. 微生物学通报,2014,41(10):2001-2011.
[42]斯贵才,王 建,夏燕青,等. 念青唐古拉山沼泽土壤微生物群落和酶活性随海拔变化特征[J]. 湿地科学,2014,12(3):340-348.
[43]冯虎元,马晓军,章高森,等. 青藏高原多年冻土微生物的培养和计数[J]. 冰川冻土,2004,26(2):182-187.
[44]王艳发,魏士平,崔鸿鹏,等. 青藏高原冻土区土壤垂直剖面中微生物的分布与多样性[J]. 微生物学通报,2016,43(9):1902-1917.
[45]Wu X D,Xu H Y,Liu G M,et al. Bacterial communities in the upper soil layers in the permafrost regions on the Qinghai-Tibetan Plateau[J]. Applied Soil Ecology,2017,120:81-88.
[46]Boonchayaanant B,Nayak D,Du X,et al. Uranium reduction and resistance to reoxidation under iron-reducing and sulfate-reducing conditions[J]. Water Research,2009,43(18):4652-4664.
[47]Long H Z,Wang Y L,Chang S J,et al. Diversity of crude oil-degrading bacteria and alkane hydroxylase (alkB) genes from the Qinghai-Tibet Plateau[J]. Environmental Monitoring and Assessment,2017,189:116.
[48]Zhang G S,Niu F J,Ma X J,et al. Phylogenetic diversity of bacteria isolates from the Qinghai-Tibet Plateau permafrost region[J]. Canadian Journal of Microbiology,2007,53(8):1000-1010.
[49]Zhan B L,Tang S K,Chen X M,et al. Streptomyces lacrimifluminis sp nov,a novel actinobacterium that produces antibacterial compounds,isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology,2016,66(12):4981-4986.
[50]張东杰. 青藏高原高寒草甸植被与土壤特征[J]. 草业科学,2015,32(2):269-273.
[51]Zhang Y Q,Liu H Y,Chen J,et al. Diversity of culturable actinobacteria from Qinghai-Tibet Plateau,China[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2010,98(2):213-223.
[52]Zhang X F,Xu S J,Li C M,et al. The soil carbon/nitrogen ratio and moisture affect microbial community structures in alkaline permafrost-affected soils with different vegetation types on the Tibetan plateau[J]. Research in Microbiology,2014,165(2):128-139.
[53]Zhao S Y,Zhuang L J,Wang C,et al. High-throughput analysis of anammox bacteria in wetland and dryland soils along the altitudinal gradient in Qinghai-Tibet Plateau[J]. Microbiology Open,2017,7(2):e00556.
[54]陈懂懂,孙大帅,张世虎,等. 放牧对青藏高原东缘高寒草甸土壤微生物特征的影响[J]. 兰州大学学报(自然科学版),2011,47(1):73-77,81.
[55]王 蓓,孙 庚,罗 鹏,等. 模拟升温和放牧对高寒草甸土壤微生物群落的影响[J]. 应用与环境生物学报,2011,17(2):151-158.
[56]Zhang B,Chen S Y,He X Y,et al. Responses of soil microbial communities to experimental warming in alpine grasslands on the Qinghai-Tibet Plateau[J]. PLoS One,2014,9(8):e103859.
[57]Li N,Wang G X,Gao Y H,et al. Warming effects on plant growth,soil nutrients,microbial biomass and soil enzymes activities of two Alpine Meadows in Tibetan Plateau[J]. Polish Journal of Ecology,2011,59(1):25-32.
[58]张 琪. 高寒草原区不同植被恢复方式对土壤微生物的影响研究[D]. 兰州:兰州大学,2015.
[59]Xiong Q L,Pan K W,Zhang L,et al. Warming and nitrogen deposition are interactive in shaping surface soil microbial communities near the alpine timberline zone on the eastern Qinghai-Tibet Plateau,southwestern China[J]. Applied Soil Ecology,2016,101:72-83.
[60]Niu F,He J,Zhang G,et al. Effects of enhanced UV-B radiation on the diversity and activity of soil microorganism of alpine meadow ecosystem in Qinghai-Tibet Plateau[J]. Ecotoxicology,2014,23(10):1833-1841.
[61]程长林,任爱胜,刘鉴洪,等. 青藏高原社区畜牧业发展模式研究[J]. 江苏农业科学,2018,46(2):296-300.
[62]高丽楠,张 宏. 青藏高原高寒草地土壤铁的空间异质性[J]. 江苏农业科学,2017,45(15):239-243.
