动物MSTN基因作用机制及突变研究
2019-09-20雷初朝蓝贤勇
王 真, 潘 赟, 毕 谊, 雷初朝, 陈 宏, 蓝贤勇
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
肌肉生长抑制素(myostatin,MSTN)又称生长分化因子8(growth and differentiation factor 8,GDF8),是骨骼肌发育的主要调节因子之一[1]。MSTN在家畜出生前、出生后都起到关键作用,并且决定家畜的整体肌肉含量,由于MSTN基因突变,导致牛和羊等许多物种表现出“双肌”现象。因此,一直以来,MSTN多态性及其对肉类产量的遗传效应研究是动物育种领域的热点。研究表明:MSTN基因在哺乳动物中高度保守,过表达会减少肌肉重量;MSTN缺失型家畜骨骼肌重量增加,即所谓的“双肌(双肌)”表型。MSTN突变已经在许多物种中被报道过,包括羊[2]、牛[3]、猪[4]、兔[5-6]以及人类[7]等。因此,本文首先介绍MSTN调控肌肉发育的机制通路,然后再探讨MSTN突变及其与表型的关系,以及改变MSTN表达对家养动物(牛、马、山羊、绵羊、猪、鸡和兔)的生理影响,最后,综述了MSTN基因多态在国内外畜禽中的研究进展。
1 MSTN信号通路及其对动物骨骼肌发育的调控
人、牛、绵羊、山羊的MSTN基因定位在2号染色体,兔和鸡的MSTN基因定位在7号染色体,马MSTN基因定位在18号染色体上,猪的MSTN基因定位在15号染色体。研究表明:MSTN在许多组织(包括乳腺)中表达,但主要在骨骼肌中表达[8〗。MSTN基因高度保守,包括3个外显子和2个内含子,外显子编码一种375个氨基酸的潜在蛋白,该蛋白进行翻译后修饰从而具有生物活性[9]。首先,多肽通过形成二硫键在细胞内进行同源二聚化,然后裂解形成N-端前肽区和C-端成熟区。MSTN的C-端成熟片段通过结合和激活细胞表面激活素Ⅱ型受体启动细胞内的信号级联,随后激活素受体IIB(ActRIIB)自磷酸化导致低亲和力I型受体招募激活素激酶受体4(Activin receptor-like kinase 4,ALK4)或激活素激酶受体5(activin receptor-like kinase 5,ALK5);活化的I型受体激酶磷酸化转录因子Smad2和Smad3,使其与Smad4相互作用,并转移到细胞核中激活靶基因转录。MSTN受体的激活也抑制了蛋白激酶B(protein kinase B,PKB/Akt)的活性,而肌肉纤维的增大和纤维肥大(简称肥大)的过程在很大程度上是由Akt活性控制的[10]。MSTN在产前胎儿的肌肉发育过程的关键点调控肌肉发育,包括调控肌肉前体细胞增殖、成肌细胞增殖和分化[11]。Amthor等[12]的研究表明:MSTN的异位表达可下调肌肉前体增殖的关键标志物Pax-3基因表达[12];也可上调p21表达,最终抑制成肌细胞的增殖[13]。MSTN上调可检测过度活跃的成肌分化抗原(myogenic differentiation antigen,MyoD)诱导的错误分化,因此,MSTN可以抑制成肌细胞前体(Pax3+/MyoD+)和成肌细胞(Pax3-/MyoD+)的增殖;下调MSTN表达可导致上述细胞数量增加[14]。小鼠的研究表明,MSTN-/-小鼠表现为肌细胞增多导致肌肉增生[15],在出生前不久,MSTN-/-小鼠肌肉中不仅肌肉纤维增多,而且每一根纤维都有明显的增大(18%)。提示在小鼠中肌肉体积增加是由于出生前纤维数量增加(增生)和出生后纤维体积增大(肥大)的结果[16]。综合已有研究,成肌细胞增殖和分化过程中MSTN作用可绘制成图1。

注:视网膜母细胞瘤蛋白(Rb)处于低磷酸化状态,抑制细胞分裂,由于重组人周期蛋白依赖性激酶2(CKD2)激酶过磷酸化Rb使其活性减弱,MSTN作用诱导的p21抑制CDK2的活性;MSTN还激活Smad2/3信号,抑制正常成肌细胞分化所需的MyoD表达。
图1成肌细胞增殖和分化过程中肌肉生长抑制素(MSTN)的作用
2 动物“双肌”表型
肌肉肥大一词常被用来描述哺乳动物在解剖后表现的肌肉增大;但是,一般来说,这个术语的使用并不严格,因为在许多情况下,肌肉增大仅仅是由于出生前肌肉增生导致,而不包括出生后纤维肥大。具有重要商业价值的大型双肌表型动物,特别是牛,具有极高的胴体产量,同时体内器官质量较低[17],然而,这些动物更容易患呼吸道疾病、尿石症、跛行、营养不良、发热和难产,导致体能较差[18];此外,也会影响繁殖性能[19]。
在强迫运动时,双肌肉牛比正常牛表现出更快的疲劳迹象,这与新陈代谢性酸中毒有关,因为血液循环减少导致氧气输送不足和肌肉有氧代谢活动减少[18]。事实上,双肌肉牛的快速抽动糖酵解纤维比例增加,导致糖酵解表型更快、更明显[20]。在一种美国whippet赛狗品种中,人们发现MSTN第三外显子中2-bp的缺失与双肌表型有关,这种缺失使第3外显子的939和940 nt消失,导致313位aa处代替正常的半胱氨酸而提前出现终止密码子,相比较原来的375个aa减少了63个aa[21]。使用CRISPR/Cas9系统的基因定位方法已被用于创建敲除MSTN小猎犬[22]。MSTN突变也会导致其他动物包括人出现双肌现象:Schuelke等人[7]观察到MSTN存在SNP突变(g.IVS1+5G>A)导致一个小男孩的肌肉异常发达,尤其是大腿和上臂,但患者无健康问题,睾酮和IGF-1水平正常。由于MSTN对肌肉质量、生长等性状的影响,利用MSTN多态性可来提高肉牛和羊等家畜的选择[23],故骨骼肌MSTN基因研究一直是动物育种领域的研究热点。
3 动物MSTN基因突变研究
3.1 牛MSTN多态性
位于比利时蓝牛上的MSTN基因功能缺失突变最早由Grobet等人[24]报道,随后不久,McPherron和Lee[16]不仅证实了Grobet的发现,也报道了皮埃蒙特牛MSTN的外显子3存在无义突变。目前,大约有20种不同类型的遗传变异在牛MSTN基因中已被鉴定,包括缺失、插入和单核苷酸多态性(SNPs),一些MSTN等位基因突变和低表达与动物生长速度和胴体性状有显著的相关性[25],且MSTN的缺失和抑制是导致肌肉质量增加和脂肪质量减少的主要原因[26],因此这些多态性可用于提高肉牛肉质和产量。但是在双肌肉牛身上经常出现与难产相关的问题,例如出生前由于纤维增生导致的小牛变大,进而导致难产[27],且纯合子双肌肉牛比杂合子表现出更多的难产问题。因此,为了在产生纯合子动物的同时降低成本,降低幼崽死亡率,值得考虑交配杂合子动物[28]。
在皮埃蒙特牛中,双肌表型是由第3外显子g.938G>A位置发生替换发生的遗传表型,此突变改变了MSTN的功能,破坏了蛋白质的二硫键[29]。目前,该品种已被系统地选择为双肌肉牛,在许多畜群中固定(意大利的皮埃蒙特地区>96%为纯合子)。一些研究表明,即与没有突变的动物相比,杂合双肌表型对胴体的影响相对较大,对产犊没有负面影响[30]。
Marchigiana牛第3外显子存在g.874G>T的突变,此突变导致291位谷氨酸改变为1个终止密码子[31]。杂合子动物常被选为父系[32],因为杂合动物比其他纯合基因型动物的肉质量也更好,且拥有更为良好的健康状况[33]。此外,在启动子区域g.-371T>A和g.-805G>C(相对于起始密码子的基因组编号)中发现了两种不同的SNP突变。
在Blonde d’Aquitaine、Limousine Parthenaise和Rubia Gallega牛中均发现了11-bp的缺失(c.821_831del11)[29,34]。Limousine牛品种中存在1个颠换突变(g.433C>A),该突变在功能上与肌肉质量和胴体产量增加有关,且不导致生殖劣势[35];在皮埃蒙特牛中,存在1个g.938G>A的替换[29,34];在Maine-Anjou牛中存在1个indel(c.419_421del7ins10),导致140位氨基酸处提前出现终止密码子[16],此外,1个c.676G>T替换,也导致在p.Glu226Thr位置提前出现终止密码子[24]。Charolaise和Limousine牛都有1个c.610C>T的替换,在204位氨基酸处提前出现终止密码子[32]。此外,在瘤牛基因组的MSTN编码部分也已经报道了14个多态性(3个在外显子1,7个在外显子2,4个在外显子3)。然而,这些多态性是否为功能突变仍有待阐明[36]。表1报告了牛MSTN基因的遗传变异。

表1 牛MSTN基因突变
3.2 马MSTN基因突变研究
Hosoyama等人[45]从纯种马中分离并测序了MSTN基因的cDNA序列。Dall’Olio等人[46]对16个马品种进行测序后,共发现7个SNP:2个位于起始密码子上游启动子646 bp(GQ183900:g.26T>C)和156 bp(GQ183900:g.156T>C)位置;其余5个SNP位于内含子区域,4个位于内含子1,1个位于内含子2。其中位于内含子1的g.2115A>G突变与纯血马的短跑能力和赛跑耐力有关。随后,在15个中国马品种的研究,发现MSTN中有6个不同的SNP:2个SNP(g.26T>C和g.156T>C)在启动子区,2个SNP(g.587A>G和G.598C>T)在5′-UTR区域;另外2个SNP(G.1485 C>T和g.2115A> G)在第1内含子中,其中g.587A>G和g.598C>T突变为新发现的SNP突变,而其他均是先前报道的[47]。
最近在4个波兰马品种中检测到5个多态性(g.66495826T>C、g.66495696T>C、g.66493737T>C、g.66495254C>T和g.66490010T >C)[48]。g.66495254C>T多态性(又称g.598C>T)[49]在中国马品种、波兰科尼克马和阿拉伯马中均有描述,此突变与纯血马的最佳奔跑距离相关[50]。在纯血马中首次报道MSTN基因存在g.66495326_66495327ins227位点多态[47]。表2报告了马MSTN基因的遗传变异。
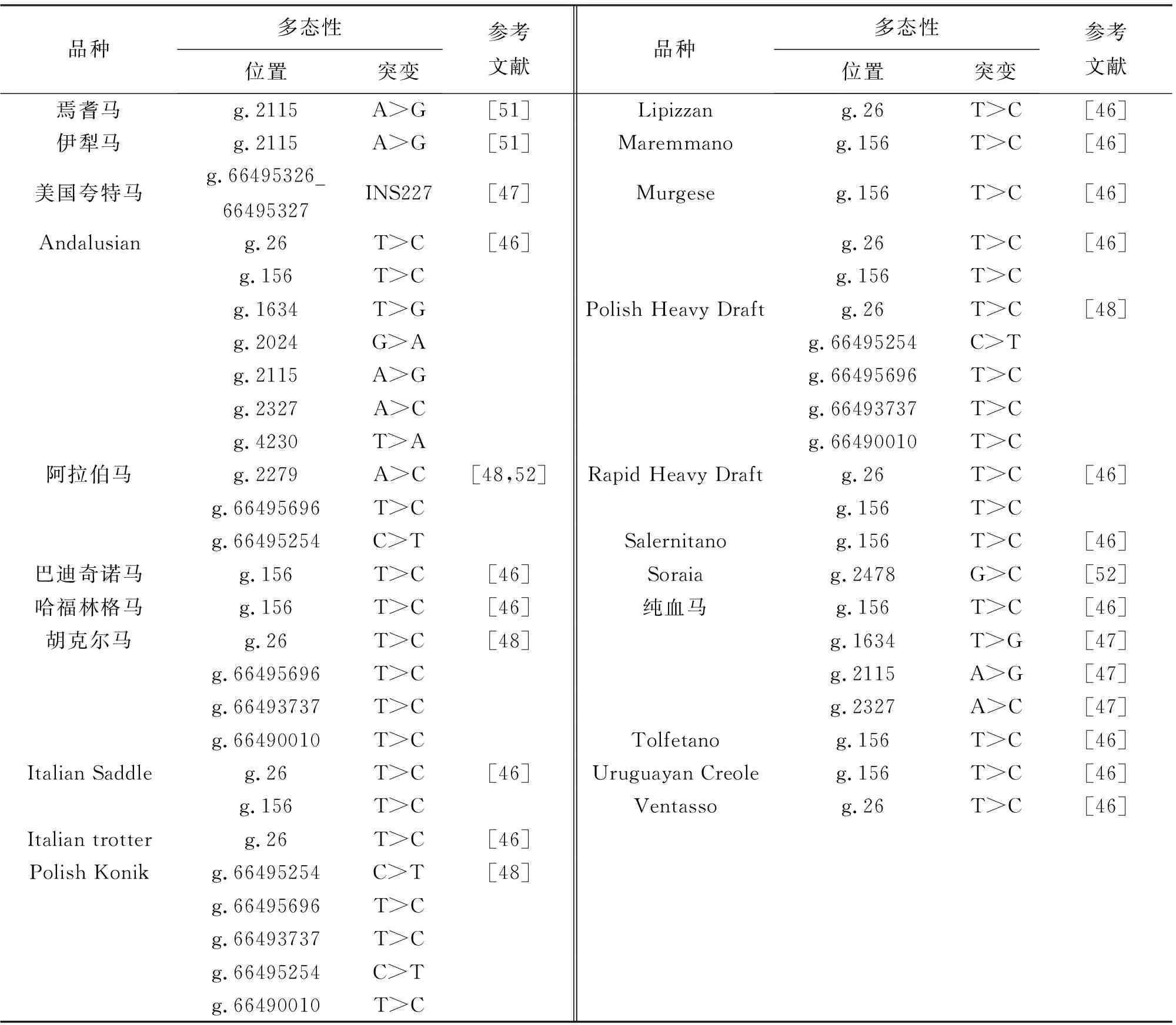
表2 马MSTN基因突变
3.3 山羊MSTN基因突变研究
在山羊MSTN基因多态性研究,刘铮铸等[53-54]发现在19个山羊品种中发现MSTN基因在内含子2存在SNP位点,且与生长性状显著相关。在波尔山羊、马头山羊、海门山羊和努比山羊在5′-UTR区域内均存在5-bp indel(c.12561260delinsTTTTA)多态,但仅在波尔山羊中检测到外显子1的1个SNP替换(g.1388T>A)[55],在波尔山羊和安徽白山羊中发现了位于5′UTR区域(g.197G>A)和第1外显子(g.345A>T)的2个新的SNP[56]。在中国22个不同山羊品种共发现8个SNP多态性(g.1980A>G、g.1981G>C、g.1982A>G、g.1984G>T、g.2121A>G、g.2124T>C、g.2174G>A和g.2246A>G)[57]。最近,Nguluma等[58]在波尔山羊中发现了1个新的多态性位点(g.298T>C)。表3总结了山羊MSTN基因的遗传变异。
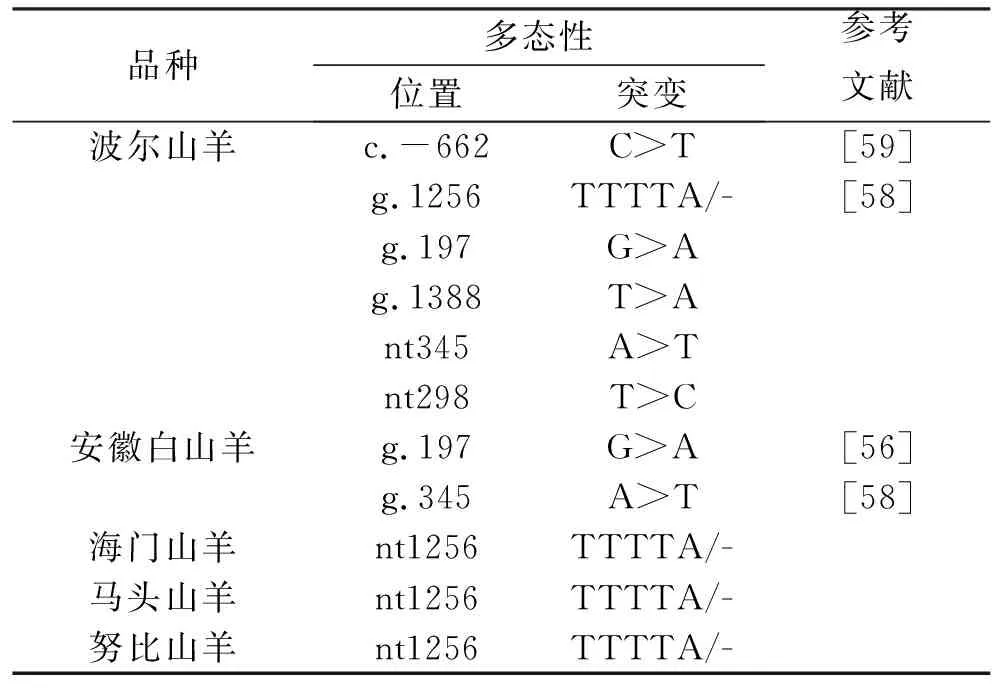
表3 山羊MSTN基因突变
3.4 绵羊MSTN基因突变研究
表4报道了绵羊MSTN基因的遗传变异。除了在挪威白绵羊MSTN基因中发现存在1-bp缺失(MSTN:c.960delG)和罗姆尼羊存在1-bp插入(c.120insA)突变[60-61]外,其他SNP突变多位于基因的非编码区域。
贺三刚等[62]报道在MSTN基因启动子区域,陶赛特羊、美利奴羊、巴音布鲁克羊、多浪羊、阿勒泰羊存在-959T>C突变;在美利奴羊、巴什拜羊、巴音布鲁克羊、多浪羊、阿勒泰羊中存在-784G>A突变。在国外的研究中,特塞尔绵羊肌纤维肥大,故特塞尔绵羊作为一种终端杂交品种被广泛利用,它们具有特殊的构造和潜力,可以在增加瘦肉和减少脂肪含量的情况下产生产量更高的胴体[63]。数量性状位点分析鉴定了特塞尔绵羊2号染色体MSTN基因3′-UTR存在1个对肌肉质量有影响的变异(g.6723G>A),可为骨骼肌中高度表达的microRNAs(miR1和miR206)创建了靶点[64]。
挪威白羊双肌表型表现为肌肉、尤其是后腿的过度发育。序列分析显示双肌个体MSTN基因缺失1-bp(c.960delG),G碱基的缺失破坏了阅读框,并在359氨基酸处提早产生终止密码子(野生型动物的终止密码子在375氨基酸)[60]。在挪威白羊中也发现了特塞尔绵羊中发现的3′-UTR突变(c.*2360G>A),但此突变对于挪威白羊的肌肉含量影响不大[60],对MSTN编码区域进行测序,结果发现双肌动物体内存在1个插入突变(c.120insA),导致在49位氨基酸位置提前产生终止密码子[60]。
在新西兰不同绵羊品种MSTN的多态性研究,从核苷酸c.-1199(启动子区域)到3′-UTR的c*1813区域中共鉴定出28个SNP,其中3个位于启动子区域,3个位于5′-UTR,11个位于内含子1,5个位于内含子2,5个位于3′-UTR。共新发现10种新的替换突变:c.-959C>T、c.-784A>G、c.373+563A>G、c.373+607A>G、c.374-654G>A、c.374-54T>C、c.748-54T>C、c.*83A>G、c.*455A>G和c.*709C>A[65];其他18例替换突变之前已被报道,在新西兰杂交绵羊中观察到的c.*123A突变和在特塞尔绵羊中报道的c.373+18T>G突变均与双肌表型有显著的联系[66]。
泽尔羊是伊朗北部的一个肉羊品种,和伊朗的Iranian Baluchi sheep一样,在第2内含子中存在1个多态位点[67]。在5′-UTR、外显子1和外显子2区域发现了印度绵羊的3个多态性位点,其中外显子1(c.539T>G)和外显子2(c.821T>A)的2个SNP是非同义突变[68],这些基因变异与双肌表型均不显著相关。
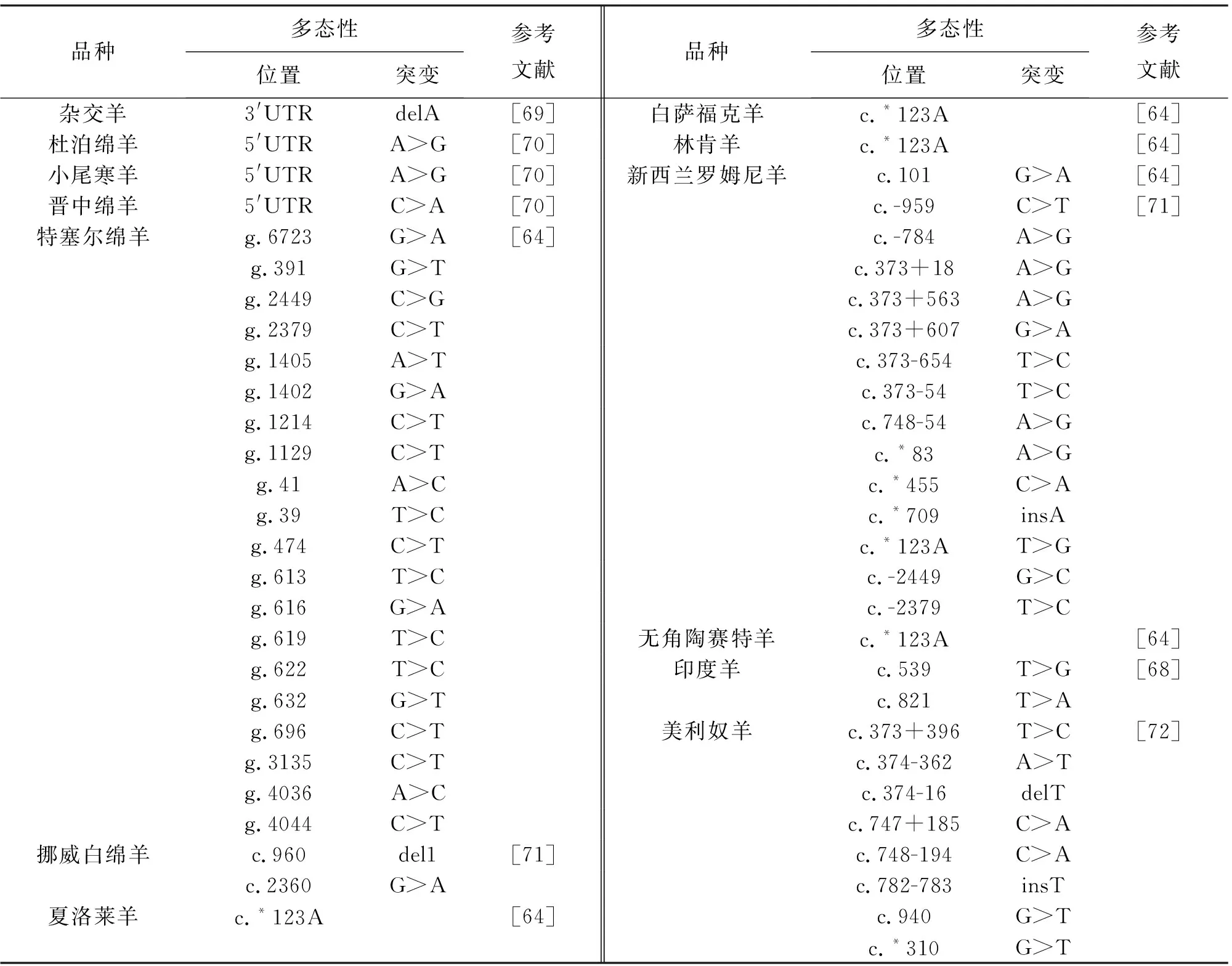
表4 绵羊MSTN基因突变
3.5 猪MSTN基因突变研究
易恒洁等[73]鉴定出高坡猪MSTN基因存在c.63C>Tde SNP位点,刘晓琴等[74]在长白猪、大白猪、杜长大、通城猪、莱芜猪、五指山猪6个不同猪种中,共发现16个SNPs。Jiang等[75]在猪MSTN基因报道了3种SNP(登录号分别为AF393396、AF393397和AF393398),其中只有1个突变(MSTN:g.383T>A)与育成期约克郡猪(活体重60~100 kg)的平均日增重有关,并且杂合突变型猪体重更大[75]。Stinckens等[76]将肌肉发达的皮特兰猪的MSTN序列与其他5个品种(皮特兰猪、长白猪、大白猪、眉山猪和野猪)进行比较后,共发现15个多态性位点,但这些MSTN基因中自然发生的突变与肌肉表型没有显著的相关性;然而Qian等[77]采用锌指核酸酶技术和体细胞细胞核转移技术制备了MSTN缺失型眉山猪,由此产生的后代表现出显著的双肌表型(尤其是在后躯)。缺失型MSTN猪的肌肉重增加了50%~100%,且证明是由于纤维增生导致肌肉增重。表5报告了在猪MSTN中检测到的遗传变异。
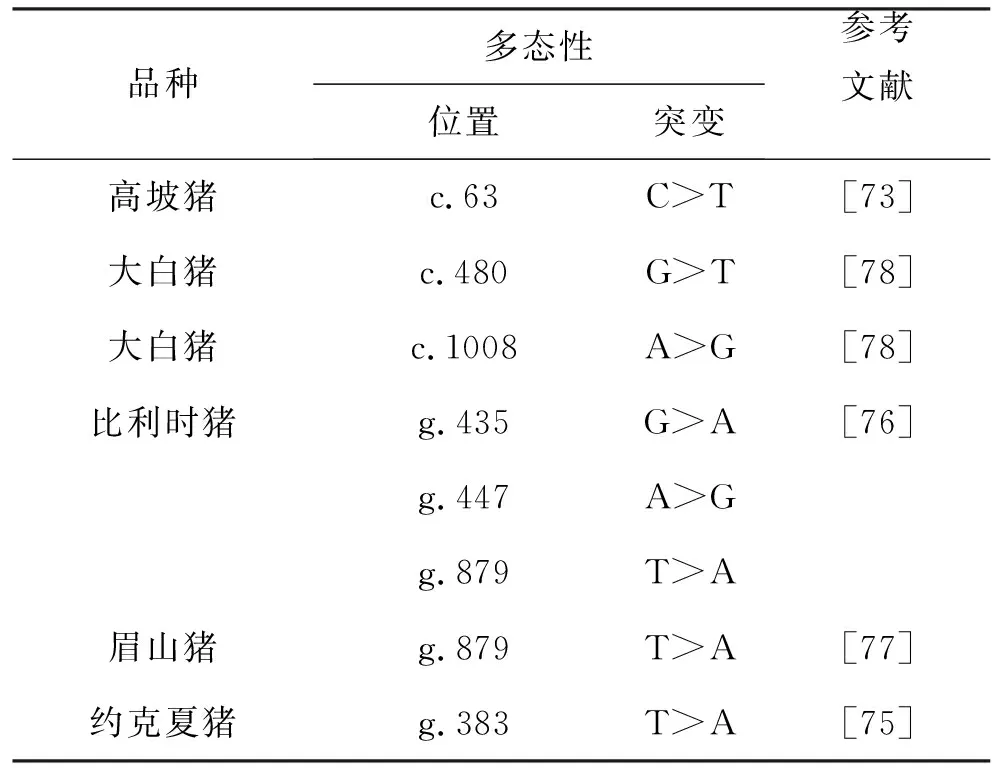
表5 猪MSTN基因突变
3.6 鸡MSTN基因突变研究
在鸡中,MSTN基因与哺乳动物相似,由3个外显子(分别为373,374,1 567 bp)和2个内含子组成。Gu等[79]的研究表明,鸡MSTN基因不仅具有调节骨骼肌发育的作用,还参与脂肪代谢和分布,并在不同品系鸡中确定了7个SNP:5个在5′调控区域(g.167G>A、g.177T>C、g.304G>A、g.322A>G和g.334C>T),2个在3′调控区(g.7263A>T和g.6935A>G)。Ye等人[80]究发现了14个SNP:7个SNP(g.2100G>A、g.2109G>A、g.2244G>C、g.2283A>G、g.2346C>T、g.2373C>T和g.2416A>G)位于外显子1,1个SNP(g.4842T>G)位于外显子2,3个SNP(g.7434C>G、g.7435A>G和g.7436C>A)位于外显子3,3个SNP(g.4405G>C、g.4405A>T和g.4954A>G)位于内含子1或2,同时研究了MSTN多态性与3种商品肉用鸡品系的死亡率、生长速率、饲料转化率、超声乳腺深度、乳腺百分率、内脏重量、腿部缺陷、血氧水平的相关性影响。由于MSTN的主要功能是调节骨骼肌生长,Ye等[80]认为1个非同义SNP(g.4842T>G)通过导致MSTN的一个氨基酸的变化,可能与体重的变化有关。文献报道4个中国鸡品种MSTN基因存在SNP多态,且可能影响腹部脂肪重量、乳房肌肉重量、出生体重和成年体重[81]。Gu等[82]在MSTN基因的5′调控区鉴定了3个SNP,在3′调控区鉴定了2个SNP,且在5′调控区域的1个位点上,纯合子基因型腹部脂肪重量和脂肪百分比均高于杂合基因型[82]。
对鸭子MSTN的5′调控区域进行分析,发现3个SNP多态性(g.753G>A,g.658G>T和g.235G>C)与乳房肌肉百分比和腹部脂肪率相关[83],此外,Xu等[84]研究了北京鸭MSTN的多态性,发现了3个显著的突变,第1个是位于开放阅读框内的c.129T>C突变,与乳房肌肉厚度相关,第3个SNP(c.952T
3.7 家兔MSTN基因突变研究
Fontanesi等[91]研究了MSTN多态性对家兔生产性状影响。通过对14个不同的体型和肌肉重的兔子代表品种或品系进行测序后,在比利时兔、Burgundy fawn、巨型格仔兔和大灰兔中确定了4个SNP多态:位于外显子1的罕见的SNP同义突变(c.108C>T)、位于外显子2的SNP同义突变(c.713T>A)、位于3′-UTR的SNP突变(c.*194A>G)和位于内含子2的SNP突变(c.747+34C>T)。在商品杂交兔中,Qiao等人[92]在5′调控区检测到1个SNP突变(g.476T>C),但在外显子中未检测到突变位点,相关分析显示,SNP多态与肝脏和胴体量增加有关。这些结果表明,MSTN上游调控区域的SNPs对家兔体细胞发育有利,可作为家兔肉质选择的分子标记。Sternstein等人[93]在大灰兔和新西兰兔MSTN基因中发现了多态性,对这些品种进行测序,发现2个SNP分别位于调控区(c.-125T>C)和内含子1(c.373+234T>C)。表7为家兔MSTN基因的多态性。
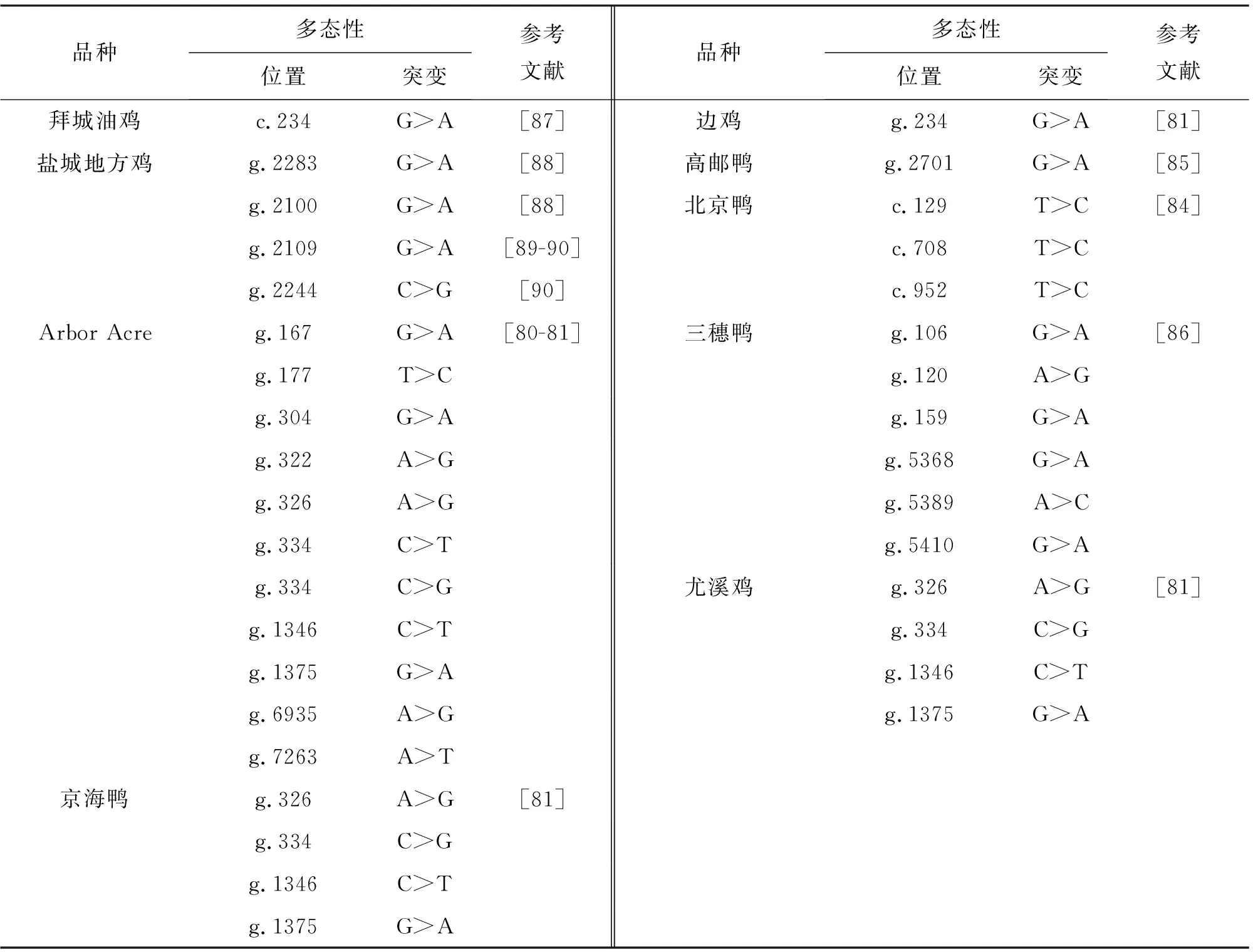
表6 鸡MSTN基因突变

表7 家兔MSTN基因突变
4 MSTN基因及其研究前景
MSTN基因变异是肌肉肥大的主要原因,而其它基因变异所起的作用较小[94]。许多研究,尤其是在小鼠上,报道了抑制MSTN表达可促进肌肉生长,在缺失突变体中,一些肌肉大约是正常体重的3倍,因此,使MSTN失活的手段被认为是一种改善食用动物肌肉生长和治疗与肌肉无力和营养不良相关的人类疾病的策略[95],故研究和确定MSTN基因不同突变的分子基础是重要且必要的。
2018年12月国际知名期刊《Animal Genetics》发表的一篇文章指出:损害MSTN功能的突变会导致家畜肌肉纤维增生,然而,小鼠和大型动物(牛和猪)之间的明确差异之一是出生后的表型[96]。小鼠显示出相当大的纤维肥大,而牛和猪的纤维大小没有增加。这些发现可作为今后在大型动物身上进行双肌现象研究的基准。因此,使用正确的术语来描述动物的表型是非常重要的。双肌动物通常被称为肌肉“肥大”,但在牛和猪的情况下,没有出现纤维肥大,所以笔者建议在建立机制时使用正确的术语描述。Aiello等[96]建议使用以下4个术语:(i)肌肉增生导致的肌肉增大;(ii)肌肉肥大导致的肌肉增大;(iii)肌肉增生和肥大导致的肌肉增大;(iv)未知细胞机制导致的肌肉增大。今后研究中需要了解MSTN在哺乳动物产后肌肉发育中的作用机制。小动物和大动物的功能缺失突变都会导致增生,然而,只有在小鼠中,MSTN突变才会对肌肉纤维的大小产生影响,表现为肥大,但为什么在没有MSTN的情况下,老鼠的纤维会肥大,而大型哺乳动物的纤维却不会。解决这一问题的线索可能来自于最近在猴子身上的研究,研究表明,MSTN和激活素协同作用,抑制成年期猴子的纤维肥大[97]。笔者建议可以通过量化大型和小型动物在不同发育阶段的MSTN和激活素水平来验证,这是继针对MSTN和激活素的特异性ELISAs开发之后,现在可能的一种方法[97]。
最后,MSTN是旨在提高家畜肉类生产的主要目标[23],包括产生MSTN敲除动物。此外,还需要考虑更精细的转基因方法,例如针对产后或性别特异性抑制MSTN。Wang等[98]报道了CRISPR/Cas9系统在山羊胚胎中通过靶向MSTN的Cas9 mRNA和sgRNA微注射成功构建山羊基因组,他们通过干扰MSTN证明了这种方法的有效性,从而在Cas9介导的基因修饰山羊中提高了体重和更大的肌纤维尺寸;最近研究发现,利用CRISPR/Cas9基因编辑技术可成功获得牛MSTN基因编辑胚胎[99],利用CRISPR-Cas9系统定点突变可获得MSTN基因突变猪[100]。
5 结 论
简言之,损害MSTN功能的突变会导致多余的肌肉纤维增生,在商用动物中存在大量的MSTN基因变异,其多态性在动物育种领域具有重要意义,可用于育种选择进而提高家畜肉品生产。
