锰镍单一及复合污染对土壤脲酶活性的影响
2019-09-17宋凤敏乔权汤波
宋凤敏 乔权 汤波
摘要:采用室内模拟试验向土壤中添加重金属Mn、Ni离子后测定土壤脲酶活性变化,确定重金属锰镍单独污染和复合污染对土壤脲酶活性的影响。结果表明,在单一镍污染体系中,Ni2+浓度为0~30 mg/kg时,随着污染时间延长,土壤脲酶活性增大;当Ni2+浓度为60~120 mg/kg时,随着污染浓度和时间的增加,土壤脲酶活性下降,重金属镍污染浓度的增加对土壤脲酶活性具有抑制作用。在单一重金属锰污染体系中,当Mn2+浓度小于等于120 mg/kg、污染时间为12、24 h时,Mn2+浓度的增加对脲酶活性具有促进作用;在Mn2+浓度大于120 mg/kg时,对脲酶活性具有抑制作用。在重金属锰镍复合污染时,土壤脲酶的净变化量(ΔU)>0的处理占总处理的90%以上;在Ni2+、Mn2+复合污染体系中,镍和锰之间存在较强的协同作用,使得土壤脲酶活性增强,且大部分体系在污染时间较长时,随锰离子浓度增大,ΔU总体增大;在污染24 h,Ni-Mn浓度为120-240 mg/kg时,ΔU最大,为1.832。在重金属复合污染体系中,重金属锰对脲酶活性的影响起主导作用。
关键词:锰;镍;复合污染;脲酶活性
中图分类号: X171.5 文献标志码: A 文章编号:1002-1302(2019)07-0248-04
随着工农业的大力发展,土壤的重金属污染愈发严重,土壤重金属污染往往是多种金属同时存在的复合污染,在土壤生态系统中具有多样性、复杂性等特点。有研究表明,我国耕地中有16.67%左右的土壤受重金属污染,占耕地总面积的1/6左右[1]。重金属复合污染不仅严重危害植物生长,而且对土壤酶活性、土壤微生物生长和代谢产生明显不良影响。土壤重金属离子对土壤酶活性产生抑制或激活作用,重金属对酶活性的影响机制不仅和单一重金属含量相关,更与多种重金属复合污染有关。由于土壤酶稳定、敏感的特性,其活性大小能较敏感地反映土壤中生化反应的方向和程度,是探讨重金属污染生态效应的有效指标之一[2]。因此通过土壤酶的活性变化研究来探明土壤重金属污染的程度及其对作物生长的影响是一种常用的手段。
土壤脲酶是土壤系统中最重要的酶之一,参与土壤系统中的氮循环,可以反映土壤的供氮水平和能力,是研究重金属污染的重要指标之一[3-4]。已有研究表明,土壤脲酶活性与土壤的微生物数量、有机物质含量、全氮含量和速效磷含量呈正相关关系[5]。有关研究表明,以土壤脲酶活性作为预测土壤重金属复合污染程度的主要生化指标具有一定的可行性[6],且脲酶对于某些重金属较敏感,因此脲酶活性成为土壤重金属污染的1个敏感指标[7]。重金属锰和镍是土壤污染中比较常见的重金属,近年来有一些关于单一重金属镍或锰污染对土壤脲酶活性影响的研究[8-9],但关于土壤锰镍复合污染对脲酶活性影响的研究还鲜有报道,本试验通过揭示锰镍复合污染对土壤脲酶活性的影响,以期为重金属锰镍复合污染土壤的生态效应及其治理和修复提供理论依据。
1 材料与方法
1.1 供试土壤
供试土壤于2017年3月采自陕西省勉县驿巴乡(远离城区和金属矿区)的农田,采样深度为0~20 cm。土样经风干碾碎处理,过1 mm尼龙筛,装入自封袋备用。采用常规方法[10]分析土样的理化性质。
土壤中锰、镍全量分析用电热板湿法消解,即土壤样品消解采用硝酸-氢氟酸-高氯酸高温溶解,消解液用原子吸收分光光度计测量;土壤中有效态锰、镍用欧洲共同体标准物质局(BCR)提出的连续提取法[11]进行提取用原子吸收分光光度计测量可交换态的金属离子含量。
1.2 研究方法
本研究采用Ni(NO3)2·6H2O、MnSO4·H2O(分析純)制成不同浓度处理水平溶液对土壤进行Ni、Mn单一及复合污染。重金属镍添加至土壤的质量分数为0、30、60、90、120 mg/kg,重金属锰添加到土壤的质量分数为0、60、120、180、240 mg/kg,采用随机两两组合设计,每组作3次平行试验。
脲酶活性测定[12]:称取5 g土样置于150 mL三角瓶中,加1 mL甲苯,15 min后,单一污染的处理为添加不同质量浓度的硝酸镍或硫酸锰10 mL,复合污染的处理为添加不同质量浓度的硝酸镍和硫酸锰各5 mL,混合均匀30 min后,加入0.1 mol/L尿素溶液10 mL和pH值为6.7的柠檬酸缓冲液20 mL,摇匀放入恒温培养箱,37 ℃培养,每隔6 h取1 mL上清液于50 mL容量瓶中,连续进行4次,用靛酚蓝比色法测定酶的活性,以试验时间内5 g土壤中NH3-N的毫克数来表示。每一土样需作无基质(以相同的水代替尿素溶液)对照,整个试验需作无土(其他操作与样品试验相同)对照。
1.3 数据处理
试验数据为3次平行试验的算术平均值,数据采用Excel进行初步计算及处理作图。采用计算酶活性净变化量(ΔU)的方法[13]判断锰镍对土壤脲酶活性的联合作用。
ΔU=(UNi+Mn-UCK)-(UNi-UCK)-(UMn-UCK)。
式中:UNi+Mn为一定浓度Ni-Mn复合处理的酶活性;UNi和UMn为相应浓度的Ni、Mn单独处理时土壤的酶活性;UCK为无Ni、Mn处理的对照土壤酶活性。
当ΔU=0时,锰和镍之间无交互作用;当ΔU>0时,锰和镍之间存在协同作用;当ΔU<0时,锰和镍之间存在拮抗作用。
2 结果与分析
2.1 单一重金属污染对土壤脲酶活性的影响
由分析测得,土壤pH值为6.78,土壤有机质含量为11.90%,速效氮含量为60.21 mg/kg,速效钾含量为 293.52 mg/kg,速效磷含量为 8.65 mg/kg,总锰含量为 554.7 mg/kg,有效态锰含量为43.7 mg/kg,总镍含量为 22.7 mg/kg,有效态镍含量为1.7 mg/kg。
2.1.1 不同浓度镍和锰单一污染对土壤脲酶活性的影响 从图1可以看出,在Ni单一污染条件下,当Ni2+浓度小于等于30 mg/kg时,土壤脲酶活性没有明显变化,当Ni2+浓度大于30 mg/kg时,土壤脲酶活性开始受到抑制作用,脲酶活性逐渐降低至0,其原因在于脲酶中的α亚基在其双核活性的中心部位键结合了2个镍离子,其中镍在维持脲酶的分子结构和催化功能上起到了很重要的作用;因此,在Ni2+允许的浓度范围内,添加的镍对脲酶的合成有促进作用,可以刺激土壤中微生物的大量繁殖,使土壤的脲酶活性呈上升趋势;但高浓度Ni2+则会抑制酶促反应,抑制微生物繁殖,使脲酶活性降低,这与王学峰等的研究结果[14]一致。
由图2可知,向土壤中加入不同浓度的Mn2+之后,土壤脲酶活性也有不同程度的变化。培养24 h时Mn2+浓度为120 mg/kg的脲酶活性最高,Mn2+浓度为240 mg/kg,土壤的脲酶活性最低,表明一定浓度的Mn2+对土壤脲酶活性具有促进作用,随着Mn2+浓度的继续增加,土壤脲酶活性呈现出下降的趋势,但下降的幅度较小,趋于平衡。赵峰等研究锰对土壤酶活性的影响时,也取得类似研究结果[15],重金属对土壤酶活性低促高抑的现象同样被其他研究者[16]观察到。低浓度Mn2+对土壤脲酶活性具有促进作用的原因,一方面可能是由于低浓度的重金属对土壤微生物生物量存在刺激作用,且其刺激作用有一定的浓度范围[17];另一方面可能是由于酶为蛋白质,重金属离子作为辅基,有利于酶活性中心与底物的配位合成,使酶分子与酶活性中心保持了一定的专性结构,改变了酶促反应的平衡性和酶蛋白的表面电荷,从而进一步增强酶活性[18]。大量研究表明,高浓度的Mn2+对土壤脲酶活性有抑制作用,其抑制机制可能与酶分子中的活性部位——巯基和含咪哇的配体等结合[19],形成了较稳定的络合物,产生与底物的竞争性抑制作用有关。另有研究报道,重金属污染对土壤脲酶活性的影响为抑制作用,是由于重金属抑制了土壤微生物的生长和繁殖,减少其体内酶的合成和分泌,导致土壤脲酶活性下降[20]。
2.1.2 单一金属镍和锰不同污染时间对土壤脲酶活性的影响 从图1可以得出,在Ni2+浓度小于等于30 mg/kg时,随着污染时间的增加,脲酶的活性增强,在Ni2+浓度为60~120 mg/kg 时,随着污染时间的增加,脲酶的活性总体减弱。在镍浓度为60 mg/kg时,培养6 h的脲酶活性最大,而培养18、24 h 的脲酶活性趋近于0。为了更具体地说明随着时间的延长,脲酶活性的变化,对重金属镍单一污染情况下土壤中脲酶活性随时间变化的情况进行拟合(表1)。
从表1可以看出,在单一Ni2+污染的状况下,Ni2+浓度在 30 mg/kg 时,随着时间延长,脲酶的活性与污染时间呈正相关关系,且相关性较好,说明随着时间的延长,脲酶活性逐渐增强;当Ni2+浓度大于等于60 mg/kg时,脲酶活性均随污染时间的延长而减小,呈负相关关系。
从图2可以看出,在单一Mn2+污染下,脲酶活性均随着污染时间的延长而增大。在作用6 h时,脲酶活性在各个浓度之间变化幅度较小;同一Mn2+浓度下,脲酶活性由大到小均为24 h>18 h>12 h>6 h。为了进一步说明单一Mn2+污染时间与土壤脲酶活性的相关性,对Mn2+污染时间与土壤脲酶活性进行拟合(表2)。
由表2可知,Mn2+污染时间与脲酶活性都呈正相关关系,这说明在试验范围内,土壤脲酶的活性是随着锰污染时间的延长逐渐增强的;但超出一定浓度后,随着时间延长,脲酶活性增加的幅度逐漸减小。在Mn2+浓度为120 mg/kg,土壤脲酶活性随污染时间延长的增加幅度最大,其相关系数也最大,Mn2+浓度为240 mg/kg时,土壤脲酶活性与污染时间的相关系数最小。
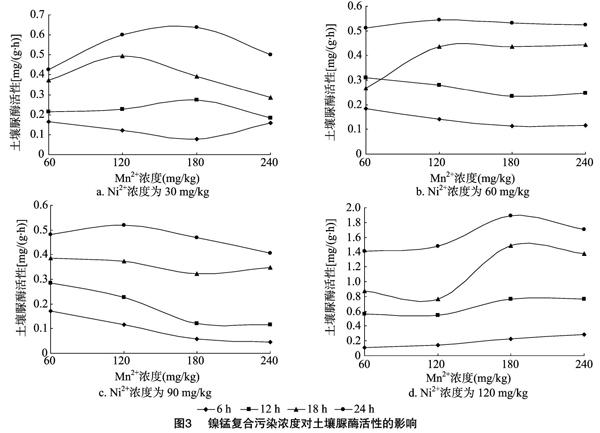
2.2 镍锰复合污染对土壤脲酶活性的影响
从图3-a可以看出,在复合污染的情况下,当Ni2+浓度为30 mg/kg时,作用12、18、24 h时,随着Mn2+浓度的增加,土壤脲酶活性均先增加后降低。作用6 h时,金属离子对脲酶的影响较小,其趋势与单一Mn2+污染相似。其原因可能是,在Ni2+浓度为30 mg/kg时,Mn2+对复合污染起主导作用,当Mn2+浓度低于120 mg/kg或180 mg/kg时对脲酶活性有促进作用,但超过120 mg/kg或180 mg/kg时,随着Mn2+浓度的增大,土壤脲酶活性降低。
从图3-b可以看出,在60 mg/kg Ni2+与不同浓度Mn2+组合的复合污染中,土壤脲酶活性的变化明显变强。当作用时间为24 h,Ni-Mn复合浓度为60 mg/kg-120 mg/kg时,脲酶活性最大,而随着Mn2+浓度增大,作用24 h的脲酶活性变化幅度不大,说明在Ni-Mn复合污染下,当Ni2+浓度为 60 mg/kg,作用时间为24 h时,Mn2+浓度的变化对酶活性没有产生明显影响。
从图3-c可以看出,在Ni2+浓度为90 mg/kg时,随着锰污染浓度的增大,作用24 h的土壤脲酶的活性先增加后降低,这说明Ni2+在此复合浓度中起主导作用,下降趋势明显。
当Ni2+浓度为120 mg/kg时,单一镍污染对脲酶活性具有很强的抑制作用。但从图3-d可以看出,在Ni-Mn复合中,镍浓度为120 mg/kg时,作用12、18、24 h时,随着锰浓度的增加土壤脲酶活性均在Ni-Mn浓度为120 mg/kg-180 mg/kg 时最高;其后,随着Mn2+浓度的增加,土壤脲酶活性降低。脲酶活性随着重金属离子浓度的增加有所回升然后再降低,此种现象被称为抗性酶活性,认为当重金属在土壤中达到一定浓度时,大部分微生物死亡,而小部分微生物在有毒物质污染下能生存下来,自行繁殖,从而产生抗性酶活性,表观上酶活性值降低后又增大,有时还会出现多个抗性峰[21]。
2.3 关于镍锰复合污染浓度与土壤脲酶活性的变化分析
经对比发现,在相同的重金属浓度和相同污染时间下,土壤脲酶活性表现为锰镍复合污染>锰单一污染>镍单一污染。大部分体系中,土壤脲酶的活性都随着重金属含量的增加而先增加后降低或持续降低;在镍单一污染体系中,当Ni2+浓度较低(0~30 mg/kg)时,土壤脲酶活性随着污染时间的延长而增加;在锰单一污染和Ni-Mn复合污染体系中,土壤脲酶活性基本随着污染时间的延长而增加。为了更清楚地了解Ni-Mn共存对土壤脲酶活性是否存在交互作用,计算了酶活性的净变化量。从表3中可以看出,在不同的污染时间下,不同浓度的56个复合污染处理中ΔU>0的处理占总处理的90%以上,仅污染12 h,Ni-Mn浓度为30-60、30-90、30-240 mg/kg 和污染时间为18 h,Ni-Mn浓度为30-240 mg/kg 的ΔU<0。 说明镍、锰同时污染土壤时存在较强的协同作用,使得土壤脲酶活性增强,且大部分在污染时间较长时,随锰离子浓度增大,ΔU总体呈逐渐增大的趋势。在污染24 h,Ni-Mn浓度为120-240 mg/kg时,ΔU最大,为 1.832,说明锰离子的浓度在对土壤脲酶活性的影响中可能起主导作用。
2.4 镍锰复合金属污染时间对脲酶活性的变化分析
为了进一步分析复合重金属污染的时间对土壤脲酶活性的影响,对重金属镍锰污染时间与土壤脲酶活性进行拟合(表4)。
从表4可以看出,重金属镍锰复合污染时间与土壤脲酶的活性都呈正相关关系,且r2>0.95的处理占总处理的75%,说明随着污染时间的延长对脲酶活性的刺激作用越来越强。当镍浓度不变,锰浓度小于等于180 mg/kg,随着锰浓度的增大,污染时间与土壤脲酶活性的比例系数逐渐增大;而当Mn2+浓度大于180 mg/kg的镍锰复合污染时间与土壤脲酶活性的比例系数减小;当Mn2+浓度不变,而Ni2+浓度增大或减小时,镍锰复合污染时间与土壤脲酶活性的比例系数没有呈规律性的变化,说明重金属镍锰复合污染时间的延长对土壤脲酶活性的影响以锰的作用为主导。
3 结论
单一镍污染土壤,在Ni2+浓度小于等于30 mg/kg时对脲酶活性具有促进作用,在Ni2+浓度大于30 mg/kg时对脲酶活性有抑制作用。单一锰污染土壤,在染毒时间为12、24 h,Mn2+浓度小于120 mg/kg时,Mn2+浓度的增加对脲酶活性具有促进作用;在Mn2+浓度高于120 mg/kg时,Mn2+浓度的增加对脲酶活性具有抑制作用。
单一镍污染土壤,在浓度等于30 mg/kg时,污染时间的延长对脲酶活性具有促进作用,在高于30 mg/kg时,污染时间的延长对脲酶活性有抑制作用。单一重金属锰污染土壤,在试验浓度范围内,不论Mn2+浓度的高低,污染时间的延长均对脲酶活性具有促进作用,但在高浓度时,其促进作用减弱。
土壤脲酶活性在镍锰复合污染作用下,Mn2+浓度对土壤脲酶活性的影响起主导作用,而随着复合污染中Mn2+浓度的增大,大部分体系中土壤脲酶活性呈现先增高后减小或持续减小的趋势,与单一重金属Mn2+污染浓度对土壤脲酶活性的影响相似。随着重金属镍锰复合污染时间的延长,土壤脲酶活性增大,重金属镍锰污染时间与脲酶的活性呈正相关关系。
参考文献:
[1]宋 伟,陈百明,刘 琳. 中国耕地土壤重金属污染概况[J]. 水土保持研究,2013,20(2):293-298.
[2]程根伟,余新晓,赵玉涛,等. 贡嘎山亚高山森林带蒸散特征模拟研究[J]. 北京林业大学学报,2003,25(1):23-27.
[3]线 郁,王美娥,陈卫平. 土壤酶和微生物量碳对土壤低浓度重金属污染的响应及其影响因子研究[J]. 生态毒理学报,2014,9(1):63-70.
[4]杨春露,孙铁珩,和文祥,等. 汞对土壤脲酶的抑制动力学研究[J]. 辽宁工程技术大学学报(自然科学版),2008,27(3):454-457.
[5]卢冠男,夏梦洁,贾丹阳,等. 我国14种典型土壤脲酶、脱氢酶活性对汞胁迫的响应[J]. 环境科学学报,2014,34(7):1788-1793.
[6]黄 娟,李 稹,张 健. 改良靛酚蓝比色法测土壤脲酶活性[J]. 土木建筑与环境工程,2012,34(1):102-107.
[7]滕 应,駱永明,李振高. 土壤重金属复合污染对脲酶、磷酸酶及脱氢酶的影响[J]. 中国环境科学,2008,25(2):147-152.
[8]孟庆峰,杨劲松,姚荣江,等. 单一及复合重金属污染对土壤酶活性的影响[J]. 生态环境学报,2012,21(3):545-550.
[9]蔡信德,仇荣亮,陈桂珠. 镍污染对土壤微生物的生态效应[J]. 生态科学,2004,23(8):273-277.
[10]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,1999:12-212.
[11]刘恩峰,沈 吉,朱育新. 重金属元素BCR提取法及在太湖沉积物研究中的应用[J]. 环境科学研究,2005,18(2):57-60.
[12]关松荫. 土壤酶及其研究法[M]. 北京:中国农业出版社,1986:23-35.
[13]周启星. 复合污染生态学[M]. 北京:中国环境科学出版社,1995:56-58.
[14]王学锋,尚 菲,刘修和,等. Cd、Ni单一及复合污染对土壤酶活性的影响[J]. 环境工程学报,2014,8(9):4027-4034.
[15]赵 峰,谌 斌,李明顺. 锰及锰镉复合污染对锰矿区茶园土壤酶活性的影响[J]. 广西师范大学学报(自然科学版),2008,26(4):128-131.
[16]田海霞,和文祥,乔 园,等. Hg的土壤酶效应初步研究[J]. 农业环境科学学报,2012,31(5):913-919.
[17]Bai L Y,Zheng X B,Li L F,et al. Effects of land use on heavy metal accumulation in soils and sources analysis[J]. Agricultural Sciences in China,2010,9(11):1650-1658.
[18]罗 虹,刘 鹏,宋小敏. 重金属镉、铜、镍复合污染对土壤酶活性的影响[J]. 水土保持学报,2006,20(2):94-96,121.
[19]王 新,周启星. 土壤重金属污染生态过程、效应及修复[J]. 生态科学,2004,23(3):278-281.
[20]杨志新,刘树庆. Cd、Zn、Pb单因素及复合污染对土壤酶活性的影响[J]. 土壤与环境,2000,9(1):15-18.
[21]孟庆峰,杨劲松,姚荣江,等. 单一及复合重金属污染对土壤酶活性的影响[J]. 生态环境学报,2012,21(3):545-550.王 华,郭小敏,胡冬南. 不同类型肥料对油茶幼林土壤微生物特性的影响[J]. 江苏农业科学,2019,47(7):252-255.
