羟基红花黄色素A对氧化应激损伤血管内皮 细胞的保护作用研究
2019-09-10崔丽霞孙丽萍赵丕文刘欣石丹宁陈梦
崔丽霞 孙丽萍 赵丕文 刘欣 石丹宁 陈梦








〔摘要〕 目的 探討羟基红花黄色素A(hydroxysafflor yellow A, HSYA)对血管内皮细胞氧化应激损伤的保护作用及其可能机制。方法 体外培养人血管内皮细胞EC-304,用H2O2构建细胞氧化应激损伤模型,分别设置正常对照组、H2O2损伤模型组、HSYA药物组,其中各药物组用不同浓度的HSYA预培养细胞24 h后加入50 μmol/L的H2O2,继续培养12 h。用MTT法检测细胞的增殖活力,用试剂盒检测各组细胞内超氧化物歧化酶(SOD)、一氧化氮(NO)的含量,用Western Blot法检测各组细胞Bax、Bcl-2、Caspase-3、cleaved Caspase-3蛋白表达水平。结果 与H2O2模型组相比,HSYA能显著提高细胞存活率,且呈剂量依赖性,提高细胞内SOD的活性,提高细胞内NO的含量,降低Bax表达,提高 Bcl-2表达,降低Caspase-3和cleaved Caspase-3的表达(P<0.01或P<0.05)。
结论 HSYA对于H2O2诱导的血管内皮细胞氧化应激损伤具有保护作用,其可能的作用机制与抑制EC-304细胞凋亡相关。
〔关键词〕 羟基红花黄色素A;血管内皮细胞;氧化应激损伤;细胞凋亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.04.009
Protective Mechanism of Hydroxysafflor Yellow A on Vascular Endothelial Cells Injured by Oxidative Stress
CUI Lixia1, SUN Liping1, ZHAO Piwen1, LIU Xin2, SHI Danning1, CHEN Meng1*
(1. Beijing University of Chinese Medcine, Beijing 102488, China; 2. The Third Affiliated Hospital of
Beijing Univesity of Chinese Medicine, Beijing 100029, China)
〔Abstract〕 Objective To study the protective mechanism of hydroxysafflor yellow A (HSYA) on vascular endothelial cells injured by oxidative stress. Methods EC-304 human vascular endothelial cells were cultured in vitro. An oxidative stress injury model was established with H2O2. The cells were divided into several groups, namely control group, H2O2 injury model group, and HSYA groups. The cells in HSYA groups were pre-cultured with different concentrations of HSYA for 24 h, followed by addition of 50 μmol/L H2O2, and the cells were then cultured for another 12 h. Cell proliferation activity was determined by MTT assay, the content of superoxide dismutase (SOD) and nitric oxide (NO) was measured by kits, and the protein expression levels of Bax, Bcl-2, Caspase-3, and cleaved Caspase-3 were determined by Western Blot. Results Compared with the H2O2 model group, HSYA significantly increased the cell survival rate in a dose-dependent manner, and it significantly increased SOD activity, NO content, and Bcl-2 expression and significantly reduced the expression of Bax, Caspase-3, and cleaved Caspase-3 (P<0.01 or P<0.05). Conclusion HSYA has a protective effect on H2O2-induced oxidative stress injury of vascular endothelial cells, and the mechanism is possibly related to inhibition of the apoptosis of EC-304 cells.
〔Keywords〕 hydroxysafflor yellow A; vascular endothelial cell; oxidative stress injury; apoptosis
血管内皮细胞是衬于血管内壁的单层扁平上皮细胞,在人体内具有吞噬异物、分泌生长因子、参与血管形成、调节血管张力、凝血、纤溶等多种生理功能,保证心血管系统的正常运转。血管内皮细胞损伤是造成高血压、动脉粥样硬化等多种心血管疾病的因素,而氧化应激和细胞凋亡又是导致内皮细胞损伤的主要原因[1],因此,抑制血管内皮细胞免受氧化应激损伤,抑制细胞凋亡,保护细胞功能,对于治疗心血管疾病具有重要临床意义。
红花是活血通经、祛瘀止痛的中药,羟基红花黄色素A(hydroxysafflor yellow A, HSYA) 是红花的主要活性成分,具有查尔酮类结构,有抗炎、抗肿瘤、治疗妇科疾病等多种药理作用,本课题组前期对于HSYA的雌激素样作用也进行了相关研究[2]。本实验选取人血管内皮细胞EC-304为研究对象,在体外用H2O2处理制备氧化应激损伤模型,诱导细胞凋亡,探讨HSYA对氧化应激损伤细胞的保护作用及可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 人脐静脉血管内皮细胞株(EC-304)购自南京凯基生物科技发展有限公司。
1.1.2 药物 HSYA购自中国药品生物制品检定所,质量分数≥98%,实验时用二甲基亚砜(DMSO)溶解至所需浓度,4 ℃保存备用。
1.1.3 主要试剂 1640培养基(Gibco公司);胎牛血清FBS(Hyclone公司);0.25%胰蛋白酶(Gibco公司);PBS缓冲液(Solarbio公司);H2O2(Amresco公司);DMSO(Sigma公司);四甲基偶氮唑蓝MTT(江苏凯基生物技术股份有限公司);SOD试剂盒、NO试剂盒(南京建成生物科技有限公司);一抗:Bax、Bcl-2、Caspase-3、cleaved Caspase-3(Abcam公司);二抗:Goat Anti-Rabbit IgG(H+L)(北京普利莱基因技术有限公司);蛋白定量试剂盒(北京索莱宝科技有限公司);ECL化学发光试剂盒(北京普利莱基因技术有限公司);显影液、定影液(天津市世纪奥博公司)。
1.1.4 主要仪器 VS-1300L-U超净台(日本AIRTECH公司);MC0-18AIC细胞培养箱(日本SANYO公司);TS100普通倒置显微镜(日本NIKON公司);SAFIREⅡBASIC多功能荧光酶标仪(瑞士TECAN公司);3K15低温高速离心机(美国SIGMA公司);WD-9405B水平摇床(北京六一仪器厂);DYY-6C电泳仪(北京市六一仪器厂);Mini-PROTEAN Tetra Cell单垂直电泳槽、Mini-PROTEAN Ⅱ转移电泳槽(BIO-RAD公司)。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的1640培养基,在37 ℃、5%CO2、100%饱和湿度的培养箱中,静置培养EC-304细胞。传代3次以上,待细胞状态稳定后,取对数生长期细胞进行后续实验。
1.2.2 H2O2损伤模型的构建 取对数生长期EC-304细胞,用0.25%胰酶消化5 min,制成细胞混悬液,以5×103个/孔接种于96孔培养板。待细胞贴壁后,吸去培养液,以含H2O2终浓度分别为50、100、200、400、800 μmol/L的培养基对细胞进行培养,12 h后测定490 nm处吸光度值,选取合适的H2O2造模浓度,构建细胞氧化应激损伤模型。
1.2.3 MTT法检测细胞增殖活力 取对数生长期EC-304细胞,以5×103个/孔接种于96孔培养板。待细胞贴壁后,吸去培养液,实验组加入终浓度分别为1×10-5、1×10-6、1×10-7、1×10-8、1×10-9 mol/L的HSYA,同时设置正常对照组(无任何处理)和H2O2模型组(50 μmol/L H2O2),每组设4个复孔,置于CO2培养箱中,连续培养12、24、36 h后,吸弃对照组的培养液,再加入100 μL的完全培养基继续作用12 h。吸弃模型组和各药物组的培养液,加入100 μL含H2O2终浓度均为50 μmol/L的培养基继续作用12 h。终止培养,用PBS缓冲液清洗。向各孔加入MTT 100 μL,于培养箱中避光孵育4 h,吸去上清液,每孔加入DMSO 150 μL,在摇床上震荡10 min,使紫色结晶完全溶解。用酶标仪测定各组在490 nm处的吸光度值,计算细胞的增殖率。
细胞增殖率=(受试物的平均OD值/对照组的平均OD值)×100%
1.2.4 Wst-1法测定细胞SOD含量 取对数生长期EC-304细胞,终止培养,弃培养基,用预冷的PBS缓冲液冲洗,加胰酶进行消化,收集细胞混悬液,1 000 r/min离心5 min,吸弃上清液,将离心管置于冰上。加入预冷的裂解液(RIPA∶PMSF=100∶1),不断混匀,待细胞完全裂解后,4 ℃ 10 000 r/min离心5 min,吸取上清液。按照说明书,在96孔板中操作,设置对照组、对照空白组、测定组和测定空白组,其中测定孔与测定空白孔又包括正常对照组、模型组和不同浓度HSYA组。置于水平摇床37 ℃孵育20 min,酶标仪测定波长为450 nm处的吸光度值。
1.2.5 一步法测定细胞NO含量 取对数生长期EC-304细胞,收集细胞混悬液,1 000 r/min離心5 min,弃上清液,留细胞沉淀,用PBS缓冲液清洗2次,加入200 μL PBS缓冲液,冰水浴条件下超声破碎,制备好匀浆液。在96孔板中操作,设置空白孔、标准孔、测定孔,空白孔加入双蒸水,标准孔加入亚硝酸钠标准液,测定孔中加入各组经处理的细胞上清液(匀浆液300 μL加试剂一200 μL,涡旋充分混匀后静置10 min,4 000 r/min离心15 min,吸上清),分别加入显色剂反应,静置15 min,酶标仪测定550 nm波长处的各孔吸光度值。
NO含量(μmol/L)=■×
标准品浓度(20 μmol/L)×稀释倍数
1.2.6 Western Blot检测细胞蛋白表达 取对数生长期细胞,终止培养,弃培养基,用预冷的PBS冲洗,加胰酶进行消化,收集细胞混悬液,1 000 r/min离心5 min,吸弃上清液,将离心管置于冰上。加入预冷的蛋白裂解液,不断混匀,待细胞完全裂解后,4 ℃ 10 000 r/min离心5 min,吸取上清液。按照BCA蛋白定量试剂盒说明书检测蛋白含量。用上样缓冲液调节蛋白样品,加热变性后,迅速入冰冷却。配制10%的分离胶和5%的浓缩胶,80 V恒压电泳1 h,待条带跑至浓缩胶与分离胶的交界处时,电压换为120 V。120 V恒压湿法转膜75 min,室温下封闭1 h。加入一抗(β-actin 1∶15 000,Bax 1∶1 000,Bcl-2 1∶2 000,Caspase-3 1∶5 000,cleaved Caspase-3 1∶3 000)后于4 ℃冰箱中过夜,次日洗去一抗,孵育二抗(二抗1∶5 000),滴加ECL发光液后显影定影。用Image J软件分析结果。
1.2.7 统计学分析 实验数据采用SPSS 20.0统计软件进行分析,先对数据进行正态分析及方差齐性检验,符合正态分布和方差齐,采用单因素方差分析ANOVA检验,组间比较用LSD(L);不符合正态分布和方差齐的,用非参数检验。数据均用“x±s”表示,P<0.05为差异有统计学意义。
2 结果
2.1 H2O2对细胞活力的影响
如表1所示,与正常对照组相比,50 μmol/L的 H2O2可显著抑制细胞增殖(P<0.01)。由于100 μmol/L至更高剂量的H2O2对细胞抑制率过大,易产生细胞毒性(如图1所示),因此,选择50 μmol/L 的H2O2作用12 h作为EC-304细胞的氧化应激损伤造模条件。
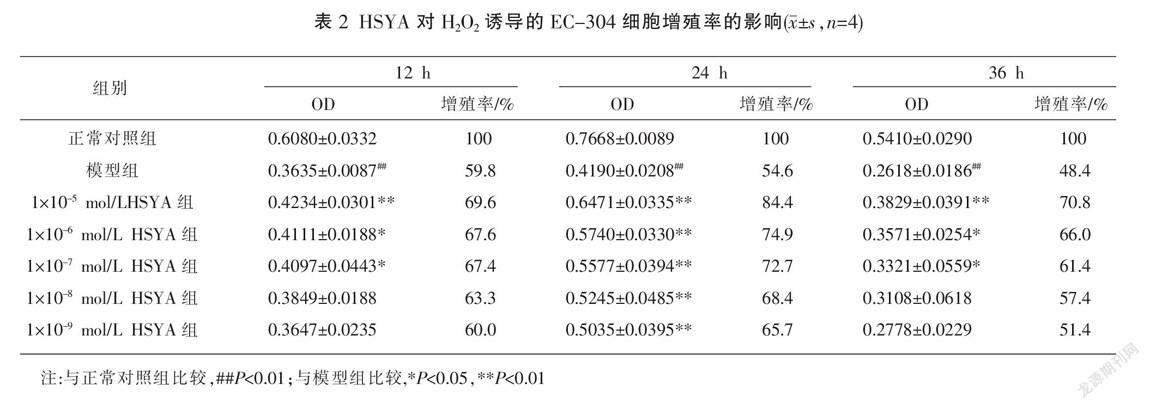
2.2 HSYA对细胞增殖活力的影响
如表2所示,在24 h时,与对照组相比,模型组中细胞增殖率显著下降(P<0.01);与模型组相比,各药物组细胞增殖率均显著提高(P<0.01),且HSYA浓度越高,效果越显著,呈剂量依赖性。在12 h和36 h时,与模型组相比,高浓度的HSYA(1×10-5 mol/L)促进细胞增殖作用最显著(P<0.01),HSYA(1×10-6、1×10-7 mol/L)对细胞也有促进作用(P<0.05)。
2.3 HSYA对细胞SOD含量的影响
如表3所示,与正常对照组相比,模型组SOD含量明显低于正常组,差异有统计学意义(P<0.01)。与模型组相比,HSYA浓度为1×10-5 mol/L时,SOD含量明显高于模型组,且差异有统计学意义(P<0.01)。
2.4 HSYA对细胞内NO含量的影响
如表4所示,与正常组相比,模型组中NO的含量明显低于正常组,差异有统计学意义(P<0.01)。与模型组比较,HSYA浓度为1×10-5 mol/L时,NO的含量明显高于模型组,且差异有统计学意义(P<0.01)。
2.5 HSYA对细胞蛋白表达水平的影响
如图2-3所示,加入HSYA预处理后,与模型组相比,Bax的表达量和Bax/Bcl-2的比值显著降低(P<0.01),Bcl-2的表达量显著升高(P<0.01),且HSYA剂量越高,效果越明显,呈剂量依赖性。药物组与模型组相比,Caspase-3和cleaved Caspase-3的表达含量显著降低(P<0.01),且HSYA剂量越高,效果越明显,呈剂量依赖性。
3 讨论
活性氧自由基引起的血管内皮细胞氧化应激损伤是诱发多种心血管疾病的病因。H2O2是机体代谢产生的一种氧自由基,血管内皮细胞受到H2O2的刺激后,打破了原本的氧化与抗氧化平衡状态,引起细胞功能障碍,诱发细胞凋亡[3-4]。本实验选取50 umol/L的H2O2作用于EC-304细胞,建立氧化应激损伤模型。预先加入HSYA可以提高细胞的存活率,提高细胞中SOD表达水平及NO的含量,且呈一定的剂量依赖关系。SOD是机体内抗氧化酶系的主要成员,可以有效地清除氧自由基,保护细胞免受氧化损伤,其含量越高表明机体的抗氧化能力越强。NO在体内具有广泛生理作用,在血管系统中,它主要由内皮细胞释放,可以阻止内皮细胞凋亡,调节平滑肌以调节血管张力,减少血小板聚集,防止血栓形成。NO的生成量减少被认为是血管內皮功能障碍的原因之一[5]。
细胞凋亡是指细胞由基因调控的一种自主有序的死亡,是维持机体内环境稳定的方式。其中与细胞凋亡关系最为密切的基因包括Bcl-2、Caspase两大家族。Bcl-2蛋白家族是由B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)编码而成,包括Bcl-2样促生存亚家族和Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)样促凋亡亚家族,正常细胞中这两者处于平衡状态。在细胞凋亡过程中,Bax通过与Bcl-2形成异源二聚体,封闭 Bcl-2活性,诱导细胞凋亡[6]。因此Bax与Bcl-2比值是决定细胞凋亡与否的关键因素。Caspase是一类含半胱氨酸的天冬氨酸蛋白水解酶,Caspase蛋白酶家族有11个成员,与细胞凋亡密切相关[7],Caspase依赖的凋亡通路主要包括死亡受体介导的凋亡通路和线粒体介导的凋亡通路[8-9]。死亡受体与配体结合激活Caspase-8,线粒体释放细胞色素C激活Caspase-9,两条通路最终都刺激Caspase级联,激活Caspase-3。活化的天冬氨酸特异性半胱氨酸蛋白酶(clevead Caspase-3)与Bcl-2结合,抑制其活性,诱导细胞凋亡[10],因此,Caspase-3在凋亡程序中起到执行者的关键作用[11]。实验结果显示加入HSYA的药物组Bax和Bax/Bcl-2的比值显著降低,Bcl-2的比值显著升高,Caspase-3和cleaved Caspase-3的表达含量显著降低,提示HSYA可以抑制细胞凋亡,减轻氧化应激损伤。
HSYA作為中药红花的主要活性成分,近年来对其抗氧化作用的研究较多[12-13],但是对其在心血管系统的抗氧化研究并不多。本实验对HSYA保护H2O2造成的血管内皮细胞氧化应激损伤的作用进行研究,结果表明,HSYA可以提高损伤细胞的增殖率,增加细胞内抗氧化酶的活性,抑制细胞凋亡,并且具有剂量依赖性。这一结果为我们深入研究HSYA保护心血管疾病的作用机制和途径提供了实验基础,为其临床应用提供了理论依据,奠定了新思路。
参考文献
[1] CHEN X, PANG S, LIN J, et al. Allicin prevents oxidized low-density lipoprotein-induced endothelial cell injury by inhibiting apoptosis and oxidative stress pathway[J]. BMC Complementary &Alternative Medicine, 2016,16(1):1-6.
[2] 陈 梦,赵丕文,孙丽萍,等.羟基红花色素A对雌激素效应相关蛋白表达的影响[J].湖南中医药大学学报,2017,37(11):1218-1221.
[3] SUI X, DOU L, CHEN X, et al. miR-291b-3p mediated ROS-induced endothelial cell dysfunction by targeting HUR[J]. International Journal of Molecular Medicine, 2018, 42(5):2383-2392.
[4] NIKE E. Oxidant-specific biomarkers of oxidative stress. Association with atherosclerosis and implication for antioxidant effects[J]. Free Radical Biology And Midicine, 2018,120:425-440.
[5] STEINHORN B S, LOSCALZO J, MICHEL T. Nitroglycerin and Nitric Oxide-A Rondo of Themes in Cardiovascular Therapeutics[J]. New England Journal of Medicine, 2015, 373(18):277-280.
[6] YU Y, ZHANG X, LI Z, et al. LncRNA HOTAIR suppresses TNF-αinduced apotosis of nucleus pulposus cells by regulating miR-34a/Bcl-2 axis[J]. Biomedicine & Pharmacotherapy, 2018,107:729-
737.
[7] OSMAN A M, NEUMANN S, KUHN H G, et al. Caspase inhibition impaired the neural stem/progenitor cell response after cortical ischemia in mice[J]. Oncotarget, 2016, 7(3):2239-2248.
[8] KURIYAMA S, TSUJI T, SAKUMA T, et al. PLEKHN1 promotes apoptosis by enhancing Bax-Bak hetro-oligomerization through interaction with Bid in human colon cancer[J]. Cell Death Discovery, 2018,4:11.
[9] LOPEZ J, TAIT S W. Mitochondrial apoptosis: killing cancer using the enemy within[J]. British Journal Cancer, 2015,112(6):957-962.
[10] JUNG S Y, KIM D Y, YUNE T Y, et al. Treadmill exercise reduces spinal cord injury-induced apoptosis by activating the P13K/Akt pathway in rats[J]. Experimental & Therapeutic Medicine, 2014,7(3):587-593.
[11] DING L, WU J P, XU G, et al. Lentiviral-mediated RNAi targeting caspase-3 inhibits apoptosis induced by serum deprivation in rat endplate chondrocytes in vitro[J]. Brazilian Journal of Medical & Biological Research, 2014,47(6):445-451.
[12] ZHAO Y, SUN H, LI X, et al. Hydroxysafflor yellow A attenuates high glucose-induced pancreatic β-cells oxidative damage via inhibiting JNK/c-jun signaling pathway[J]. Biochemical and Biophysical Research Communications, 2018,505(2):425-440.
[13] PEI J P, FAN L H, NAN K, et al. HSYA alleviates secondary neuronal death through attenuating oxidative stress, inflammatory response, and neural apoptosis in SD rat spinal cord compression injury[J]. Journal of Neuroinflammation, 2017,14(1):97.
