低氮下外源海藻糖对烤烟叶绿素代谢及叶绿体发育的影响
2019-09-10王志红孔德钧陈丽莉吴春陈浩杨志晓韦克苏林英超
王志红 孔德钧 陈丽莉 吴春 陈浩 杨志晓 韦克苏 林英超
摘要:【目的】研究低氮下外源海藻糖对烟草幼苗叶绿素代谢与叶绿体发育的影响,以期揭示海藻糖调控低氮下植物氮素代谢的作用机制,为提高植物氮素利用效率提供参考。【方法】采用盆栽法比较外源海藻糖对低氮处理和正常氮素水平(对照)烟草幼苗叶片叶绿素酶活性、叶绿素合成前体物质含量、叶绿素合成关键酶活性及叶绿体结构的影响。【结果】施加外源海藻糖对低氮下烟草幼苗叶片叶绿素酶活性无显著影响(P>0.05),但可增加叶绿素合成前体物质5-氨基酮戊酸(ALA)、胆色素原(PBG)、尿卟啉原(URO)、原卟啉(Proto)、镁原卟啉(Mg-Proto)和原叶绿素酸酯(Pchl)含量,提高叶绿素合成途径中关键催化酶5-氨基酮戊酸脱水酶(ALAD)和尿卟啉原Ⅲ合成酶(UROS)活性。低氮处理后叶绿体结构破坏严重,膜系统全部解体,但外源施加海藻糖可改善叶肉细胞叶绿体的完整性。【结论】在低氮环境下施加外源海藻糖能提高烤烟幼苗的叶绿素含量,其原因不在于海藻糖可抑制叶绿素的降解,而在于海藻糖能促进叶绿素的合成并维持叶绿体结构的完整性。
关键词: 海藻糖;氮素;烟草;叶绿素;叶绿体
中图分类号: S572.01 文献标志码: A 文章编号:2095-1191(2019)06-1191-06
Abstract:【Objective】This study was conducted to analyze the effects of exogenous trehalose on tobacco seedlings chlorophyll metabolism and chloroplast development under low nitrogen condition,to reveal the underlying mechanisms that trehalose regulated nitrogen metabolism under low nitrogen condition,and to provide reference for improving plants nitrogen use efficiency. 【Method】Effects of exogenous trehalose on chlorophyllase activity,precursor substance of chlrophyll biosynthesis, chlorophyllase biosynthesis core enzyme activity and chloroplast structure of seedlings were investiga-ted with a pot experiment simulating low nitrogen condition(treatment) and optimal condition(control). 【Result】There was no significant effects on chlorophyllase activity when exogenous trehalose was applied to tobacco seedlings under low nitrogen condition(P>0.05),however,contents of precursor substances of chlorophyll biosynthesis including 5-aminolevulinic acid(ALA),porphobilinogen(PBG),urogen(URO),protoporphyrin(Proto),Mg-protoporphyrin(Mg-Proto) and protochlorophyllide(Pchl) were increased,and activities of key enzymes of chlorophyll biosynthesis such as 5-aminolevelinate dehydratase(ALAD) and uroporporphyrinogn Ⅲ synthase(UROS) were enhanced. The structure and membrane system of chloroplast was destroyed seriously after long time low nitrogen treatment. Applying of exogenous trehalose improved the integrity of mesophyll cell. 【Conclusion】Instead of inhibiting chlorophyll degradation,the increased chlorophyll content in exogenous trehalose applied seedlings is due to its increased chlorophyll biosynthesis and the integrity of chloroplast under low nitrogen condition.
Key words: trehalose; nitrogen; tobacco; chlorophyll; chloroplast
收稿日期:2019-01-29
基金項目:贵州省科技厅科技项目(黔科合基础〔2015〕2099,〔2016〕1097);中国烟草总公司贵州省公司科技项目(201801);贵州省烟草科学研究院科技项目(GZYKS2018-02)
作者简介:*为通讯作者,林英超(1985-),博士,副研究员,主要从事烟草遗传育种研究工作,E-mail: linyingchao@outlook.com。王志红(1983-),主要从事烟草遗传育种研究工作,E-mail:491569877@qq.com
0 引言
【研究意义】氮素参与植物的许多代谢过程,其供应量是影响植物生长速率、形态建成及养分在体内运输和分配等的重要因素(Hortensteiner and Fel-ler,2002)。当前农业生产活动中不合理的氮肥投入导致作物氮素利用率下降、土壤氮素残余过多,在造成资源浪费和经济损失的同时,还引发了多种环境问题(姬景红等,2017;周丽平等,2018)。海藻糖是由两分子葡萄糖通过α,α-1,1糖苷键连接而成的化学性质极为稳定的非还原性双糖,广泛存在于细菌、真菌以及无脊椎动物中,对多种生物活性物质具有非特异性保护作用,在调控植物营养缺乏、干旱等逆境胁迫反应中具有重要作用(Paul et al.,2008)。海藻糖可能是调节植物基因表达和生长发育的重要信号因子。因此,明确海藻糖对植物氮素代谢的调控作用及其作用机制,对提高植物氮素利用率具有重要的实践意义。【前人研究进展】海藻糖在细胞质内合成,影响叶绿体内淀粉的合成、胁迫环境下叶绿体的生物学功能及光合作用结构的发育(Kolbe et al.,2005;Lunn et al.,2006);拟南芥的一些海藻糖-6-磷酸磷酸酶(TPPs)定位于叶绿体内,而T6P转运蛋白横跨叶绿体膜,证明海藻糖与叶绿体及其内部光合色素代谢及功能等存在密切关系(Fragoso et al.,2009)。Garcia等(1997)研究表明,较高浓度的外源海藻糖可有效缓解盐胁迫导致的叶绿素含量降低。Pellny等(2004)研究表明,在烟草植株中过量表达海藻糖合成基因虽导致其植株发育不良、叶片较小且颜色发暗,但可提高叶片的光合作用能力,延缓叶片衰老。Lin等(2017)发现海藻糖能提高氮素不足环境下烟草幼苗叶片的叶绿素含量和光合作用速率。可见,海藻糖对叶片发育、叶绿体结构,特别是光合色素等植物光合系统的发育具有重要影响(Wingler and Paul,2013;Yadav et al.,2014;Figueroa and Lunn,2016)。【本研究切入点】目前,针对低氮下海藻糖对植物叶绿素代谢的调控活动,以及对叶肉细胞叶绿体发育的影响尚无研究报道。【拟解决的关键问题】以烟草幼苗为试验材料,采用盆栽法,探讨外源海藻糖对低氮培养条件下叶绿素合成前体物质、叶绿素降解及叶绿体结构的影响,以期揭示海藻糖调控低氮下植物氮素代谢的作用机制,为提高植物氮素利用效率提供參考。
1 材料与方法
1. 1 试验材料
供试材料为烤烟品种K326,种子由贵州省烟草科学研究院提供。
1. 2 试验方法
试验设4个处理,分别为:T1,对照组;T2,对照+海藻糖组;T3,低氮组;T4,低氮+海藻糖组。
烟草幼苗采用常规育苗方法,播种30 d后选取生长一致的幼苗移栽到以珍珠岩为培养基质的培养盆(口径×低径×高度=12.0 cm×8.8 cm×10.8 cm)中,并随机分成以上4组,每组15株,分别浇灌不同的营养液。参照Kavanová等(2008)的研究结果,霍格兰营养液根据NO3-水平分为1.0 mmol/L NO3-(低氮组)和7.5 mmol/L NO3-(对照组,正常氮素供应)。营养液的其他成分组成为:对照组含2.5 mmol/L Ca(NO3)2、2.5 mmol/L KNO3、0.4 mmol/L KCl和0.4 mmol/L CaCl2;低氮组含1.0 mmol/L KNO3、0.7 mmol/L K2SO4和2.0 mmol/L CaCl2;另各组均含有的微量元素包括125.0 µmol Fe-ethylenediaminetetraacetic acid、46.0 µmol H3BO3、9.0 µmol MnSO4、1.0 µmol ZnSO4、0.3 µmol CuSO4、0.1 µmol Na2MoO4、1.0 mmol/L MgSO4、0.18 mmol/L KH2PO4、0.21 mmol/L K2HPO4和0.5 mmol/L NaCl。在前期预备试验的基础上,自处理之日起,每2 d于18:00向烟草植株均匀喷施特定浓度的海藻糖(8.0 mmol/L),每次喷施剂量为5 mL/株。
1. 3 测定指标及方法
1. 3. 1 叶绿素酶活性测定 处理后第7和14 d分别取上数第一张完全展开叶,按照植物叶绿素酶Elisa试剂盒(GTX,美国)产品说明书进行叶绿素酶活性测定,叶绿素酶活性单位为μmol/(g·min)。
1. 3. 2 叶绿素合成前体物质测定 处理开始,分别于第0、2、7和14 d取上数第一张完全展开叶进行5-氨基酮戊酸(ALA)、胆色素原(PBG)、尿卟啉原(URO)、原卟啉(Proto)、镁原卟啉(Mg-Proto)和原叶绿素酸酯(Pchl)含量测定。ALA的提取及含量测定参照Dei(1985)的方法,PBG含量测定及URO的提取和含量测定参照Bogorad(1962)的方法,Proto、Mg-Proto和Pchl含量测定参照Rebeiz等(1975)、Lee等(1992)的方法。
1. 3. 3 叶绿素合成关键酶活性测定 自处理开始,分别于第0、2、7和14 d取上数第一张完全展开叶进行5-氨基酮戊酸脱水酶(ALAD)和尿卟啉原Ⅲ合成酶(UROS)活性测定。ALAD活性测定参考杨清等(2012)的方法,UROS活性测定参照范军和郭蔼光(2000)的方法。
1. 3. 4 取材及电镜样品制备 分别在处理后第14 d取烟株幼苗的中部完全展开叶片,切成长度1.0~1.5 cm、宽度约0.5 cm的小块,置于pH 6.8的戊二醛固定液中(v/v=2.5%)固定2 h(4 ℃),用pH 6.8的0.1 mol/L磷酸缓冲液冲洗2次后,分别用乙醇和Epon 812包埋剂进行梯度脱水、包埋。切片由ULTRACUTE型超薄切片机完成,最后利用JEM-1200EX透射电镜进行观察和拍照。
1. 4 统计分析
试验数据采用SPSS 17.0进行统计分析,用单因素方差分析(One-way ANOVA)分析平均数间的差异显著性;利用Sigmaplot 10.0制图。
2 结果与分析
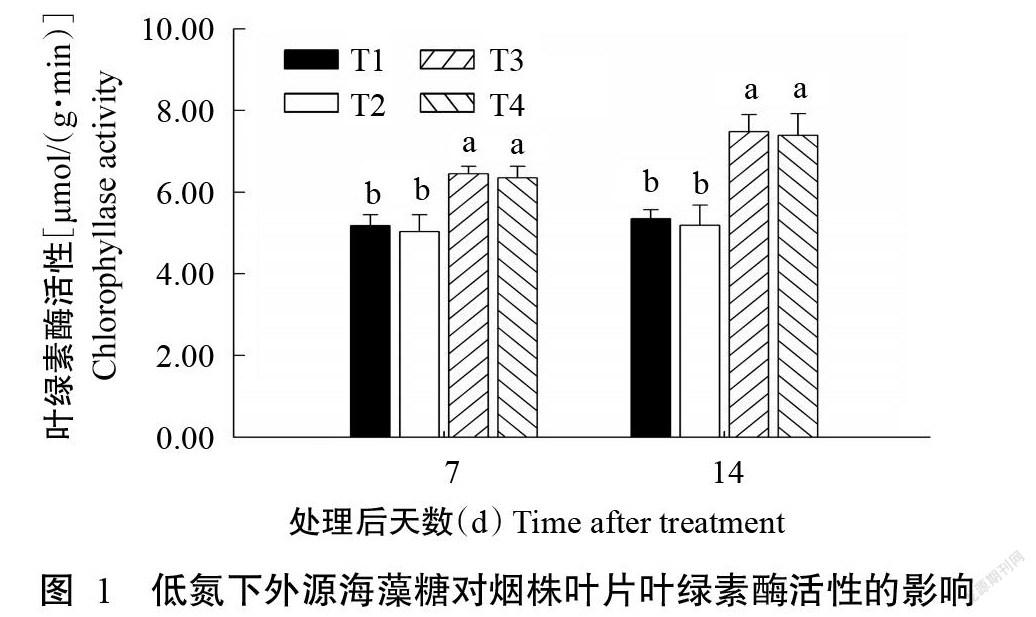
2. 1 低氮下外源海藻糖对烟株叶片叶绿素酶活性的影响
由图1可知,与正常氮素供应环境(T1、T2)相比[(分别为5.18和5.03 μmol/(g·min)],低氮处理(T3、T4)在短时间内(处理后7 d)即可显著提高烟株叶片内的叶绿素酶活性(P<0.05,下同),分别达6.45和6.31 μmol/(g·min)。直至处理后14 d,低氮组(T3、T4)叶片内的叶绿素酶活性均显著高于正常氮素供应的对照组(T1)。然而,在氮素供应相同的植株中,是否喷施外源海藻糖对烟株叶片内叶绿素酶活性的变化无显著影响(P>0.05,下同)。
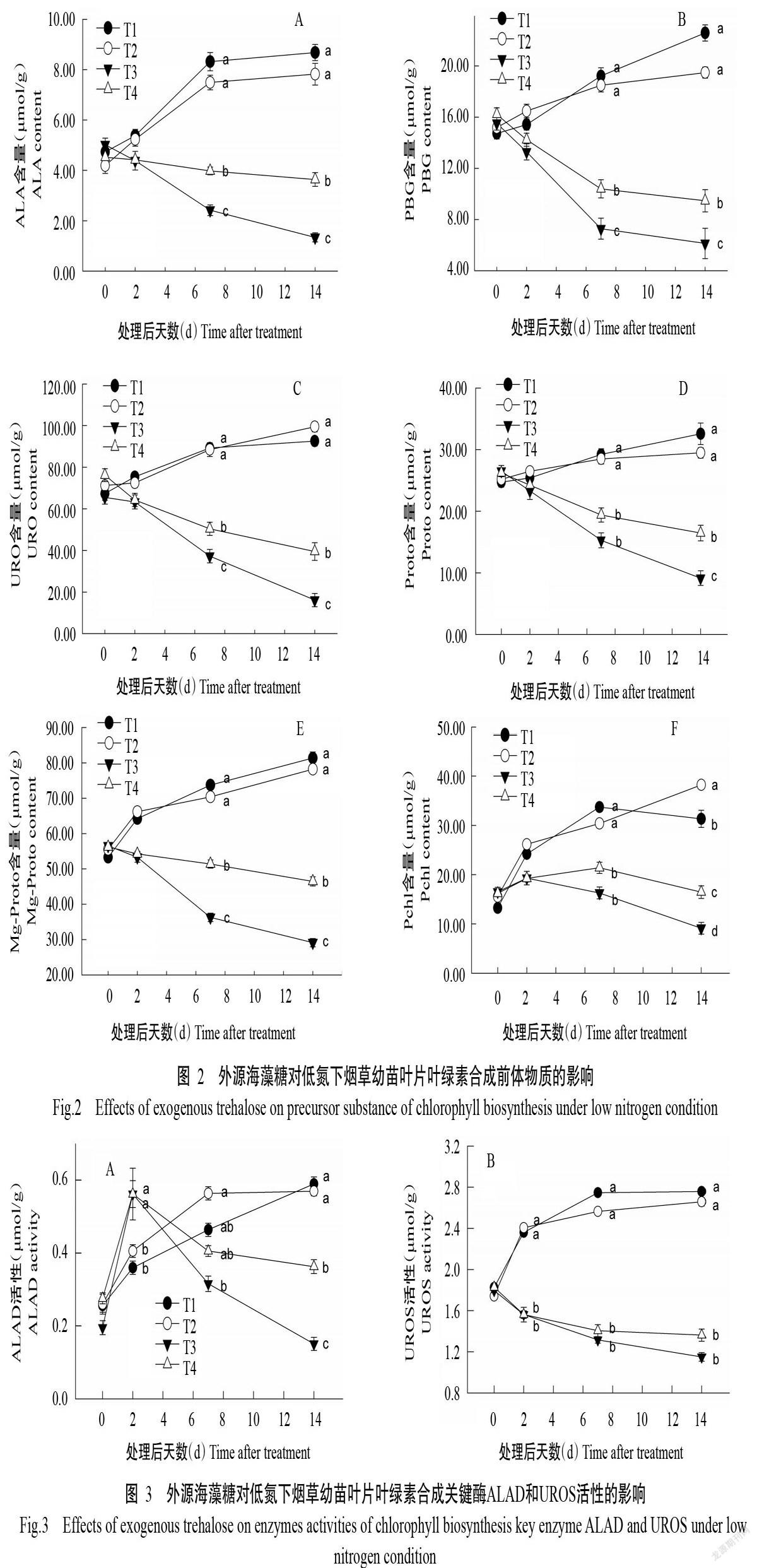
2. 2 低氮下外源海藻糖对烟株叶片叶绿素合成前体物质的影响
由图2-A可知,在整个试验过程中,正常氮素供应环境(T1、T2)下的烟株叶片中ALA含量随处理后天数的增加不断提高,且添加外源海藻糖并未显著改变其含量;处理后14 d,低氮处理(T3、T4)显著降低了ALA含量(分别为1.34和2.42 μmol/g),但低氮下喷施外源海藻糖(T4)可有效抑制ALA含量的降低。
由图2-B~图2-E可看出,与ALA含量变化相似,生长在正常氮素供应环境(T1、T2)下的烟株,其叶片中PBG、URO、Proto和Mg-Proto含量也随处理后天数的增加不断提高,且短期内(处理后2 d)外源海藻糖并未显著改变其含量。处理后14 d,低氮处理(T3)显著降低了叶片内各叶绿素合成前体物质含量,PBG、URO、Proto和Mg-Proto含量分别为6.13、16.15、9.43和29.26 μmol/g。而低氮下喷施外源海藻糖(T4)可有效缓解氮素缺失引发的叶绿素合成前体物质含量的降低,各叶绿素合成前体物质含量分别上升到9.32、39.47、16.28和46.53 μmol/g。
由图2-F可看出,在正常氮素供应环境(T1)下培养的烟株中,叶片内的Pchl含量随着生长发育的进行逐渐提高,到一定阶段后略有降低,喷施外源海藻糖(T2)则可进一步提高其含量。低氮处理(T3)14 d后叶片Pchl含量(9.20 μmol/g)显著下降,但喷施外源海藻糖(T4)能有效抑制由此引发的下降,T4处理Pchl含量为16.73 μmol/g,显著高于T3处理。
2. 3 低氮下外源海藻糖對烟株叶片叶绿素合成关键酶活性的影响
由图3-A可看出,在正常氮素供应环境下,催化ALA向PBG转化的ALAD活性随着烟株生长发育的进行不断提高,外源海藻糖在短期内(处理后2 d)会提高其活性,与对照组(T1)相比,低氮处理(T3)显著提高了ALAD活性,但随着时间的延长,其活性急剧下降;而低氮下喷施外源海藻糖(T4)能显著提高ALAD活性。
由图3-B可看出,在正常氮素供应环境(T1、T2)下烟株叶片内UROS活性不断提高,外源海藻糖对其活性无显著影响。而低氮处理(T3)显著降低了叶片UROS活性,且喷施外源海藻糖(T4)也未显著提高其活性。
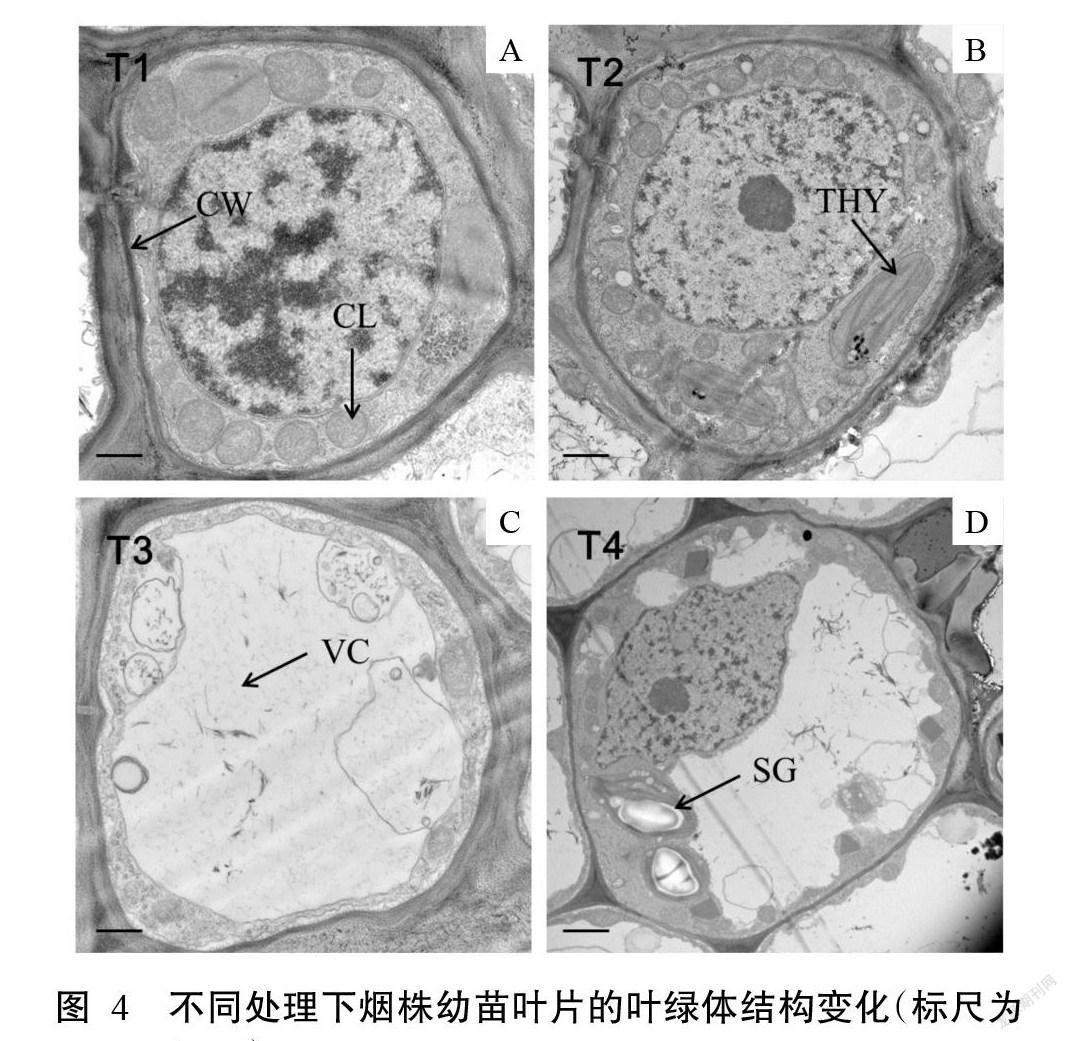
2. 4 低氮下外源海藻糖对烟株叶片叶绿体结构的影响
在对照组(T1)叶肉细胞中,大部分叶绿体靠近细胞外围分布,紧贴细胞壁周围,具有较饱满、完整的形态,同时可见清晰的基粒片层,膜系统结构也非常完整(图4-A)。在T2处理组叶肉细胞内,叶绿体的形态依然饱满、完整,基粒片层整齐有序,膜系统结构与对照组一样完整(图4-B)。随着低氮处理时间的延长,细胞内液泡体积增大,叶绿体几乎全部游离于细胞壁,结构破坏严重,膜系统几乎全部破碎,原来完整的结构已不存在,与细胞质几乎融为一体,内部的类囊体与片层结构均已消失(图4-C)。外源海藻糖改善了叶肉细胞叶绿体的完整性,但其仍然出现了部分中空现象,基粒片层也由紧密变得松散,膜边缘模糊(图4-D)。
3 讨论
有研究表明,外源海藻糖可有效缓解低氮导致的叶绿素含量降低(Lin et al.,2017)。然而,对于海藻糖的作用机制却知之甚少。在叶片衰老过程中叶绿素逐渐分解,其分解代谢反应的第一步即是叶绿素被叶绿素酶催化分解。本研究结果表明,在氮素供应相同的植株中,外源海藻糖并未显著改变叶绿素酶活性,说明外源海藻糖不是通过抑制叶绿素的分解而维持叶绿素水平。基于此,本研究又探讨了低氮下外源海藻糖对烟株幼叶叶绿素合成前体物质和关键酶活性的影响。叶绿素的生物合成涉及16步反应,其中任何一步发生变化均会导致叶绿素含量的变化(史典义等,2009;苗晗等,2010)。ALA的合成与转化是叶绿素合成的关键节点(Gough et al.,2003;Bollivar,2006;王平荣等,2009),直接决定叶绿素的合成与含量。本研究中,外源海藻糖显著提高了低氮下烟株叶片内叶绿素合成前体物质ALA的含量,保证了足够的ALA转化合成PBG,与喻敏等(2006)研究发现ALA向PBG转化合成途径受阻导致桑树斑叶突变体叶绿素含量降低的结论一致。此外,低氮处理组中外源海藻糖同样显著提高了烟株叶片的PBG、URO、Proto、Mg-Prot和Pchl含量,证明其叶片中叶绿素合成代谢处于较高水平,最终提高了叶片叶绿素水平与光合作用效率。类似的研究结果在葫芦科植物中也有发现,郝树芹等(2009)报道西葫芦银叶病发病叶片中URO Ⅲ向Proto Ⅳ的合成受阻造成叶绿素合成降低,并最终影响叶片的光合作用效率。
低氮处理显著降低了叶片的ALAD和UROS活性,外源海藻糖则提高了两者的活性。因ALAD和UROS分别催化ALA向PBG转化和PBG向UROⅢ转化,因此这可能与其对应的底物含量有关系,即低氮环境下的烟株幼苗中,外源海藻糖提高了ALA含量与ALAD活性,同时也提高了叶绿素合成速率。低氮下外源海藻糖提高了叶绿素合成前体物质含量与叶片内叶绿素的合成速率,进一步解释了外源海藻糖促进低氮下烟株幼苗氮素代谢效率的机制(Lin et al.,2017)。
叶绿体是植物进行光合作用的场所,植物能否正常生长最终取决于光合性能的好坏,完整的叶绿体结构是保证植物进行正常光合的前提。干旱胁迫下海藻糖合成能保护叶绿体(Lee et al.,2003;Wingler and Paul,2013)。本研究结果表明,低氮处理下烟草叶绿体结构破坏严重,已失去自身完整结构,光合作用功能大幅下降。在甘薯、甘蔗等植物中也有类似报道(袁丹等,2017)。而施加外源海藻糖后,其叶肉细胞内叶绿体结构得到改善,叶片光合作用功能亦有改善(Lin et al.,2017),对于海藻糖的这种功能,其他物种中尚未见报道。
综上所述,低氮下外源海藻糖对烟株幼苗叶片叶绿素的分解无显著影响,但却可显著提高叶绿素合成前体物质含量及部分关键酶的活性。同时,相比于低氮环境下培养的烟株,外源海藻糖也改善了叶片的叶绿体结构。这可能是低氮下外源海藻糖提高烟株幼苗叶片叶绿素含量与光合作用速率的根本原因所在。本研究丰富了海藻糖生物学功能的相关知识,同时为通过生物技术手段提高植物氮素利用率提供了理论依据,但对于海藻糖调控叶绿素合成代谢与叶绿体发育的作用机制还有待进一步深入研究。
4 结论
在低氮环境下施加外源海藻糖能提高烤烟幼苗叶片的叶绿素含量,其原因不在于海藻糖可抑制叶绿素的降解,而在于海藻糖能促进叶绿素的合成并维持叶绿体结构的完整性。
参考文献:
范军,郭蔼光. 2000. 小麦尿卟啉原Ⅲ合酶的分离和纯化[J]. 西北农业大学学报,28(1):11-15. [Fan J,Guo A G. 2000. Isolation and purification of uroporphyrinogen Ⅲ synthase from wheat leaf[J]. Acta Agriculturae Boreali-Occidentalis,28(1):11-15.]
郝树芹,刘世琦,张自坤,崔慧如,段吉峰,陈强. 2009. 西葫芦银叶病发病叶片叶绿素代谢及其荧光特性[J]. 园艺学报,36(6):879-884. [Hao S Q,Liu S Q,Zhang Z K,Cui H R,Duan J F,Chen Q. 2009. Characteristics of chlorophyll metabolism and chlorophyll fluorescence in the slvered leaf of summer squash[J]. Acta Horticulturae Sinica,36(6):879-884.]
姬景紅,李玉影,刘双全,佟玉欣,任桂林,李杰,刘颖,张明怡. 2017. 控释尿素对春玉米产量、氮效率及氮素平衡的影响[J]. 农业资源与环境学报,34(2):153-160. [Ji J H, Li Y Y, Liu S Q, Tong Y X,Ren G L,Li J,Liu Y,Zhang M Y. 2017. Effects of controlled-release urea on grain yield of spring maize,nitrogen use efficiency and nitrogen balance[J]. Journal of Agricultural Resources and Environment,34(2):153-160.]
苗晗,顾兴芳,张圣平,王晓武,方智远,张振贤. 2010. 黄瓜黄绿叶突变体光合色素变化及相关基因差异表达[J]. 中国农业科学,43(19):4027-4035. [Miao H,Gu X F,Zhang S P,Wang X W,Fang Z Y,Zhang Z X. 2010. Changes of the photosynthetic pigment and differential expression of the correlated genes in a chlorophyll-deficient cucumber mutant(Cucumis sativus L.)[J]. Scientia Agricultura Sinica,43(19):4027-4035.]
史典义,刘忠香,金危危. 2009. 植物叶绿素合成、分解代谢及信号调控[J]. 遗传,31(7):698-704. [Shi D Y,Liu Z X,Jin W W. 2009. Biosynthesis,catabolism and related signal regulations of plant chlorophyll[J]. Hereditas,31(7):698-704.]
王平荣,张帆涛,高家旭,孙小秋,邓晓建. 2009. 高等植物叶绿素生物合成的研究进展[J]. 西北植物学报,29(3):629-636. [Wang P R,Zhang F T,Gao J X,Sun X Q,Deng X J. 2009. An overview of chlorophyll biosynthesis in higher plants[J]. Acta Botanica Boreali-Occidentalia Sinica,29(3):629-636.]
杨清,艾沙江·买买提,王志霞,刘国杰. 2012. DA-6对桃树叶片叶绿素合成途径的调控研究[J]. 园艺学报,39(4):621-628. [Yang Q,Maimaiti A,Wang Z X,Liu G J. 2012. Effects of DA-6 on chlorophyll biosythesis pathway in peach leaves[J]. Acta Horticulturae Sinica,39(4):621-628.]
喻敏,胡承孝,王運华. 2006. 钼对冬小麦叶绿素含量变化的影响[J]. 麦类作物学报,26(2):113-116. [Yu M,Hu C X,Wang Y H. 2006. Effect of molybdenum on the cata-bolism of chlorophyll in winter wheat cultivars[J]. Journal of Triticeae Crops,26(2):113-116.]
袁丹,祝开,李佳慧,杨丽涛,农友业,李杨瑞. 2017. 施氮量对甘蔗叶绿体超微结构和光合速率的影响[J]. 南方农业学报,48(7):1190-1195. [Yuan D,Zhu K,Li J H,Yang L T,Nong Y Y,Li Y R. 2017. Effects of nitrogen application rate on chloroplast ultrastructure and photosynthetic rate in sugarcane[J]. Journal of Southern Agriculture,48(7):1190-1195.]
周丽平,杨俐苹,白由路,卢艳丽,王磊. 2018. 夏玉米施用不同缓释化处理氮肥的效果及氮肥去向[J]. 中国农业科学,51(8):1527-1536. [Zhou L P,Yang L P,Bai Y L,Lu Y L,Wang L. 2018. Effects of different slow-released nitrogen fertilizers on summer maize and nitrogen fate in the field[J]. Scientia Agricultura Sinica,51(8):1527-1536.]
Bogorad L. 1962. Porphyrin synthesis[J]. Methods in Enzymology,5:885-895.
Bollivar D W. 2006. Recent advances in chlorophyll biosynthesis[J]. Photosynthesis Research,89(3):1-22.
Dei M. 1985. Benzyladenine-induced stimulation of 5-aminolevulinic acid accumulation under various light intensities in levulinic acid-treated cotyledons of etiolated cucumber[J]. Physiologiae Plantarum,64(2):153-160.
Figueroa C M,Lunn J E. 2016. A tale of two sugars:Trehalose 6-phosphate and sucrose[J]. Plant Physiology,172(1):7-27.
Fragoso S,Espíndola L,Páez-Valencia J,Gamboa A,Camacho Y,Martínez-Barajas E,Coello P. 2009. SnRK1 isoforms AKIN10 and AKIN11 are differentially regulated in arabidopsis plants under phosphate starvation[J]. Plant Physiology,149(4):1906-1916.
Garcia A B,Engler J D A,Iyer S,Gerats T,Van Montagu M,Caplan A B. 1997. Effects of osmoprotectants upon NaCl stress in rice[J]. Plant Physiology,115(1):159-169.
Gough S R,Westergren T,Hansson M. 2003. Chlorophyll biosynthesis in higher plants. Regulatory aspects of 5-aminolevulinate formation[J]. Journal of Plant Biology,46 (3):135-160.
Hortensteiner S,Feller U. 2002. Nitrogen metabolism and remobilization during senescence[J]. Journal of Experimental Botany,53(370):927-937.
Kavanová M,Lattanzi F A,Schnyder H. 2008. Nitrogen deficiency inhibits leaf blade growth in Lolium Perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates[J]. Plant,Cell and Environment,31(6):727-737.
Kolbe A,Tiessen A,Schluepmann H,Paul M,Ulrich S, Geigenberger P. 2005. Trehalose 6-phosphate regulates starch synthesis via posttranslational redox activation of ADP-glucose pyrophosphorylase[J]. Proceedings of the Natio-nal Academy of Sciences of the United States of America,102(31):11118-11123.
Lee H J,Ball M D,Parham R,Rebeiz C A. 1992. Chloroplast biogenesis 65:Enzymic conversion of protoporphyrin Ⅸ to Mg-protoporphyrin Ⅸ in a subplastidic membrane fraction of cucumber etiochloroplasts[J]. Plant Physiology,99(3):1134-1140.
Lee S B,Kwon H B,Kwon S J,Park S C,Jeong M J,Han S E,Byun M O,Daniell H. 2003. Accumulation of trehalose within transgenic chloroplasts confers drought toleran-ce[J]. Molecular Breeding,11(1):1-13.
Lin Y C,Zhang J,Gao W C,Chen Y,Li H X,Lawlor D W,Paul M J,Pan W J. 2017. Exogenous trehalose improves growth under limiting nitrogen through upregulation of nitrogen metabolism[J]. BMC Plant Biology,17(1):247.
Lunn J E,Feil R,Hendriks J H M,Gibon Y,Morcuende R,Osuna D,Scheible W R,Carillo P,Hajirezae M R,Stitt M. 2006. Sugar-induced increases in trehalose 6-phosphate are correlated with redox activation of ADP-glucose pyrophosphorylase and higher rates of starch synthesis in Arabidopsis thaliana[J]. Biochemistry Journal,397:139-148.
Paul M J,Primavesi L F,Jhurreea D,Zhang Y. 2008. Trehalose metabolism and signaling[J]. Annual Review of Plant Biology,59:417-441.
Pellny T K,Ghannoum O,Conroy J P,Schluepmann H,Smeekens S,Andralojc J,Krause K P,Goddijn O,Paul M J. 2004. Genetic modification of photosynthesis with E. coli genes for trehalose synthesis[J]. Plant Biotechno-logy Journal,2(1):71-82.
Rebeiz C A,Matteis J R,Smith B B,Rebeiz C C,Dayton D F. 1975. Chloroplast biogenesis. Biosynthesis and accumulation of protochlorophyll by isolated etilio-plasts and developing chloroplast[J]. Archives of Biochemistry and Biophysics,171(2):549-567.
Wingler A,Paul M. 2013. The role of trehalose metabolism in chloroplast development and leaf senescence[C]//Biswal B,Krupinska K,Biswal U. Plastid development in leaves during growth and senescence.
Yadav U P,Ivakov A,Feil R,Duan G Y,Walther D,Giavalisco P,Piques M,Carillo P,Hubberten H M,Stitt M,Lunn J E. 2014. The sucrose-trehalose 6-phosphate(Tre6P)nexus:Specificity and mechanisms of sucrose signalling by Tre6P[J]. Journal of Experimental Botany,65(4):1051-1068.
(責任编辑 王 晖)
