生物炭和益生菌对桉树幼苗生物量及其林下土壤微生物活性的影响
2019-09-10任涵黄宝灵康凯丁玮吕成群
任涵 黄宝灵 康凯 丁玮 吕成群
摘要:【目的】研究施用益生菌和不同浓度生物炭对桉树幼苗生物量及其林下土壤微生物活性的影响,为调控桉树生长的土壤理化环境提供参考依据。【方法】以桉树幼苗为研究对象,进行2种浓度(20.0和40.0 t/ha)生物炭+5×1010 CFU/mL益生菌水平的野外栽培试验,测定分析各处理桉树幼苗的生长量和干生物量、林下土壤微生物数量、土壤氮素含量和土壤酶活性。【结果】单独施用20.0 t/ha生物炭可显著提高桉树幼苗的茎、叶生物量和总生物量(P<0.05,下同),单独施用5×1010 CFU/mL益生菌能显著降低桉树幼苗的树高、冠幅、地径、叶生物量和总生物量;单独施用5×1010 CFU/mL益生菌或20.0 t/ha生物炭均能显著降低桉树幼苗林下土壤的过氧化氢酶(CAT)活性,而5×1010 CFU/mL益生菌与20.0 t/ha生物炭混施可显著增加桉树幼苗林下土壤真菌数量。因子分析及相关性分析结果表明,土壤放线菌数量与土壤因子[硝态氮(NO3--N)、微生物量碳(MBC)和微生物量氮(MBN)]呈顯著正相关,即微生物数量可反映桉树幼苗林下土壤营养状况和微生物数量;低浓度生物炭处理在各公因子上的得分和排名最高,表明施用适宜浓度生物炭能提升桉树幼苗林下土壤元素的固持能力和微生物数量。【结论】土壤微生物数量与土壤养分含量、酶活性及微生物量碳氮含量等关系密切,施用20.0 t/ha生物炭可显著提高桉树幼苗的根、茎、叶生物量,同时能提高其对林下土壤营养元素的固持能力和微生物量碳氮含量。
关键词: 桉树;益生菌;生物炭;微生物;土壤酶;营养元素
中图分类号: S792.39;S714.2 文献标志码: A 文章编号:2095-1191(2019)08-1785-07
The impact of biochar and probiotics on eucalyptus seedlings biomass and soil microbial activity under the forest
REN Han, HUANG Bao-ling, KANG Kai, DING Wei, LYU Cheng-qun*
(Forestry College, Guangxi University, Nanning 530004, China)
Abstract:【Objective】The objective of this study was to investigate the impact of biochar and eucalyptus probiotics on eucalyptus seedling biomass and soil microbial activity under the forest, and provide a reference for the optimum soil physicochemical environment regulation for eucalyptus growth. 【Method】Eucalyptus seedlings were research targets. Two concentrations(20.0 and 40.0 t/ha) of biochar+5×1010 CFU/mL probiotics were used to conduct field cultivation test. Growth, dry biomass, soil microbial activity under the forest, soil nitrogen content and soil enzyme activity were detec-ted and analyzed. 【Result】Single application of 20.0 t/ha biochar significantly increased stem and foliar biomass(P<0.05,the same below), and single application of 5×1010 CFU/mL probiotics significantly decreased seedling height,crown dia-meter,ground diameter,foliage biomassand total biomass. Catalase(CAT) activity in soil under eucalyptus forest was signi-ficantly decreased by 5×1010 CFU/mL probiotics and low-level concentration(20.0 t/ha) of biochar.Fungi quantity under eucalyptus forest were significantly increased by mixed application of 5×1010 CFU/mL probiotics and 20.0 t/ha biochar. The factorialanalysis and correlation analysis demonstrated that soil actinomyces quantity was significantly positively correla-ted to soil factor(NO3--N),microbial biomass carbon(MBC) and microbial biomass nitrogen(MBN),indicating that soil microbial quantity was able to reflect soil nutrient condition and microbial biomass. What was more,low concentration of biochar treatment ranked and scored the highest on all common factors,indicating that a suitable concentration of biochar increased the retention capacity of soil nutrient and soil microbial biomass under eucalyptus forest. 【Conclusion】Soil microbial quantity is highly related to soil available nutrient content,enzyme activity, MBC and MBN. The biomass of eucalyptus root, stem and leaf can be significantly increased by 20.0 t/h biochar, meanwhile the capacity of soil nutrient retention, and soil microbial carbon and nitrogen concentrations are improved.
Key words: eucalyptus; probiotics; biochar; microbial; soil enzyme; nutrient element
0 引言
【研究意义】生物炭是一种在缺氧或绝氧环境中高温裂解有机质的固态物质,可作为土壤理化性质改良剂和二氧化碳封存剂(Lehmann et al.,2006),是近年来农林、环境和新能源等诸多领域关注的焦点。生物炭主要由碳、氢和氧及少量氮和硫等元素组成,其中碳元素占60%以上,具有高度羧酸醋化及芳香化结构,化学性质极其稳定。生物炭对土壤化学性质的影响主要在于其对土壤pH、盐基饱和度和阳离子交换量等方面的效应(Chan et al.,2008)。植物根际益生菌(PGPR)可促进植物生长和吸收矿质营养元素及抑制有害微生物生长,现已广泛应用于农业生产和植物修复(Compant et al.,2010)。桉樹是我国三大速生树种之一,因具有生长快速、种类繁多、抗逆性强等特性使其成为目前世界上最的重要纸浆原材料(朱育峰等,2018)。桉树也是广西喀斯特地区、广东和福建等沿海地区的重要经济树种(文晓萍等,2008;朱育峰等,2018),但随着桉树人工林面积的不断扩大,社会对其影响生态环境的负面评价越来越多,包括桉树种植导致的林地土壤退化、区域水资源量下降和林下生物多样性降低等问题(平亮和谢宗强,2009)。Khan等(2000)研究表明,PGPR能通过提高植物根系与植物体的元素交换而降低土壤中对植物体有害的有机物含量。因此,探讨植物益生菌和生物炭对桉树生长及其林下土壤微生物活性的影响,对提高桉树林下土壤氮素利用率和改善桉树苗木生长的土壤环境具有重要意义。【前人研究进展】Glaser等(2002)、Chan等(2008)研究表明,生物炭表面丰富的官能团可提高土壤阳离子交换量(CEC)和土壤盐基饱和度,增加可利用磷和盐基阳离子含量进而提高作物产量。Welbaum Gregory(2004)研究发现,在一些林木根际施加从菌根或根际土壤分离得到的益生菌可显著改善苗木的生长环境、增加苗木对生物和非生物胁迫的抗性及提高苗木的生长速度。文晓萍等(2008)将根瘤菌接种至台湾相思和巨尾桉,结果发现根瘤菌能显著提升苗木的苗高、地径、生物量及土壤含氮量。Laird(2008)研究认为,生物炭进入土壤后,通过氧化作用其表面会形成羧基和酚基等对阳离子具有较强吸附能力的基团,增加对阳离子如NH4+的吸附进而缓解淋溶作用。Subramanian等(2015)研究认为,氮作为植物—土壤生态系统中的必需元素是由于氮是形成氨基酸、蛋白质和叶绿素的重要组分。程效义等(2016)研究显示,施用生物炭可增强土壤保持养分的能力和土壤养分的利用效率。Pham等(2017)在温室条件下将从水稻根际分离到的固氮菌Pseudomonas stutzeri A15施加到水稻幼苗,结果显示,施加益生菌的水稻幼苗生长状况明显优于空白对照和化肥对照组。【本研究切入点】目前,已有大量关于益生菌和生物炭应用于农林业生产的研究报道,但将二者同时应用于桉树幼苗及其对林下土壤理化性质和微生物影响的研究鲜见报道。【拟解决的关键问题】对尾叶桉(Eucalypt urophylla×E. grandis)幼苗混施桉树益生菌和不同浓度的生物炭,探讨生物炭+益生菌对桉树幼苗生长、林下植被生物量、林下土壤微生物数量和土壤—植物氮素循环的影响,为调控桉树生长的土壤理化环境提供科学依据。
1 材料与方法
1. 1 试验地概况
试验于2018年1—4月在广西国有高峰林场长客分场(东经108°21′,北纬22°58′)进行。样地地处亚热带,年均气温21.6 ℃,年均降水量800~1600 mm,空气湿度70%~80%,年均霜期5 d。供试土壤为赤红壤,成土母质有花岗岩和砂页岩风化物,酸度高,pH 4.5~5.5(水土比2.5∶1),有机质和全氮含量中等偏低,磷和钾含量欠丰富。
1. 2 试验材料
生物炭购自河南泰然有机肥企业,该产品是以小麦秸秆为原料,经高温裂解分离而成。其主要技术指标:生物质活性炭含量≥50%,pH 8.0。益生菌由广西大学林学院微生物实验室黄宝灵研究员从桉树根际土壤中分离纯化,并由上海美吉生物医药科技有限公司鉴定为巨大芽孢杆菌属,菌株编号DU07,在GenBank上的登录号为MK391000。通用引物为Y1(5'-TGGCTCAGAACGAACGCTGGCGGC-3')和Y2(5'-CCCACTGCTGCCTCCCGTAGGAGT-3'),委托上海美吉生物公司合成。供试所用尾叶桉DH32-29为其无性系组培苗,由广西东门林场苗圃提供。
1. 3 试验方法
1. 3. 1 试验设计 参考Gaskin等(2008)的方法,设5个处理:不施用益生菌和生物炭[M0B0,对照(CK)]、单独施用生物炭20.0 t/ha(M0B20)、单独施用益生菌5×1010 CFU/mL(MB0)、混施5×1010 CFU/mL益生菌+20.0 t/ha生物炭(MB20)和混施5×1010 CFU/mL益生菌+40.0 t/ha生物炭(MB40)。样地总面积约667 m2 (20.0 m×33.3 m),每处理面积约115 m2,25~30个重复,采用随机区组设计。处理间设1.0 m宽缓冲带以减少相互影响。
1. 3. 2 测定指标及方法 2018年1月从每处理样地随机抽取3个点采集0~10 cm表层土样并混合均匀得到一个混合样,带回实验室后分成两份,一份置于4 ℃冰箱储存,用于微生物相关指标测定,另一份风干过筛用于测定土壤养分含量和土壤酶活性。土壤微生物数量采用平板稀释法进行测定;土壤无机氮(硝态氮和铵态氮,用NO3--N和NH4+-N表示)含量使用CaCl2浸提法测定;土壤经H2SO4和HClO4消煮后用连续流动分析仪(AA3)测定全氮(TN)含量,在全自动酶标仪(Infinite 200)上700 nm波长处测定全磷(TP)含量,在火焰光度计上测定全钾(TK)含量;土壤微生物生物量碳氮(MBC和MBN)含量采用氯仿熏蒸结合K2SO4浸提,以总有机碳分析仪(MULTIN/C3100)进行测定。参考关松荫(1986)的方法,土壤蛋白酶(Protease)活性采用茚三酮比色法测定,蔗糖酶(Sucrase)和纤维素酶(Cellulase)活性采用3,5-二硝基水杨酸比色法测定,过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定。每次进行土壤采集时,每处理随机抽取3株幼苗进行树高和地径测量,并做好标记带回实验室,105 ℃杀青30 min,65 ℃烘干至恒重,用以测定根茎叶的干生物量。
1. 4 统计分析
试验数据采用Excel 2016进行统计分析;以Pearson系数对5个处理的桉树幼苗生物量、土壤微生物数量、土壤氮素含量和土壤酶活性进行相关性分析和绘图。
2 结果与分析
2. 1 施用生物炭和益生菌对桉树幼苗生长量的影响
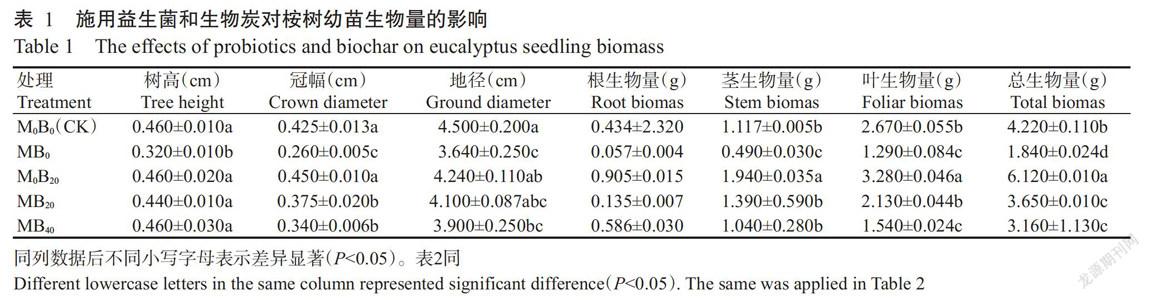
由表1可知,各处理桉树幼苗的根生物量差异不显著(P>0.05,下同);M0B20处理桉树幼苗的树高、冠幅和地径与CK无显著差异,但根生物量明显高于CK,茎和叶的生物量及总生物量分别较CK显著升高73.68%、22.85%和45.02%(P<0.05,下同);MB0处理桉树幼苗的树高、冠幅、地径、茎生物量、叶生物量和总生物量较CK显著降低30.43%、38.82%、19.11%、56.13%、51.68%和56.40%,說明单独施用益生菌短期内会显著降低桉树幼苗的生长量和茎、叶生物量及总生物量;MB20处理桉树幼苗的冠幅和总生物量较CK显著降低11.76%和13.51%,其他指标与CK差异不显著;MB40处理桉树幼苗的冠幅、地径、叶生物量和总生物量分别较CK显著降低20.00%、13.33%、42.32%和25.12%,树高和茎生物量与CK差异不显著;MB20和MB40处理桉树幼苗的树高、冠幅及茎生物量和总生物量均显著高于MB0处理,地径、根生物量、叶生物量明显高于MB0处理,说明桉树幼苗施用生物炭可在短期内迅速改良其林下土壤水分、营养元素和通气条件等,从而改变桉树幼苗根系对水肥的利用速率;混施20.0或40.0 t/ha生物炭+益生菌相比于单独施用益生菌均能显著提高桉树幼苗的树高、冠幅及茎生物量和总生物量。
2. 2 施用生物炭和益生菌对桉树幼苗林下土壤酶活性的影响
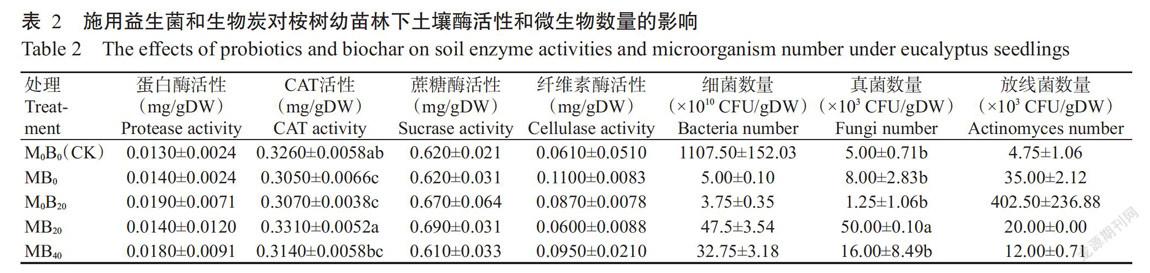
由表2可知,MB0和M0B20处理的土壤CAT活性显著低于CK,MB20和MB40处理的土壤CAT活性与CK无显著差异;M0B20、MB0和MB40处理的土壤CAT活性均显著低于MB20处理;M0B20、MB0、MB20、MB40处理及CK间的蛋白酶活性、蔗糖酶活性和纤维酶活性无显著差异。说明低浓度(20.0 t/ha)生物炭与益生菌混施可显著提升桉树幼苗林下土壤CAT的酶促反应速度,但生物炭与益生菌混施对土壤蔗糖酶、蛋白酶和纤维素酶活性无显著影响。
2. 3 施用生物炭和益生菌对桉树幼苗林下土壤微生物数量的影响
从表2可看出,MB20处理桉树幼苗林下土壤的真菌数量显著多于CK及其他处理,M0B20、MB0和MB40处理及CK桉树幼苗林下土壤的真菌数量间差异不显著;各处理林下土壤细菌和放线菌数量在CK与各处理间差异均不显著。说明低浓度(20.0 t/ha)生物炭与益生菌混施可显著促进桉树幼苗林下土壤真菌生长繁殖,而对细菌和放线菌的繁殖无显著促进作用。
2. 4 施用生物炭和益生菌对桉树幼苗林下土壤MBC、MBN和养分含量的影响
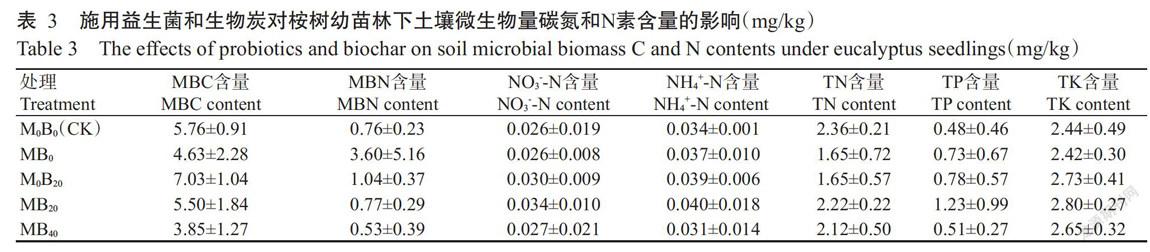
由表3可知,施用生物炭和益生菌对桉树幼苗林下土壤MBC、MBN、NO3--N、NH4+-N和TN含量无显著影响,但相较于CK,MB20处理可提高MBN、NO3--N、NNH4+-N、TP和TK含量,M0B20处理可提高MBC、MBN、NO3--N、NH4+-N、TP和TK含量。说明短期内桉树幼苗林下土壤微生物量和土壤养分对施用生物炭和益生菌的响应不显著。
2. 5 土壤营养元素、微生物量碳氮和酶活性的相关性
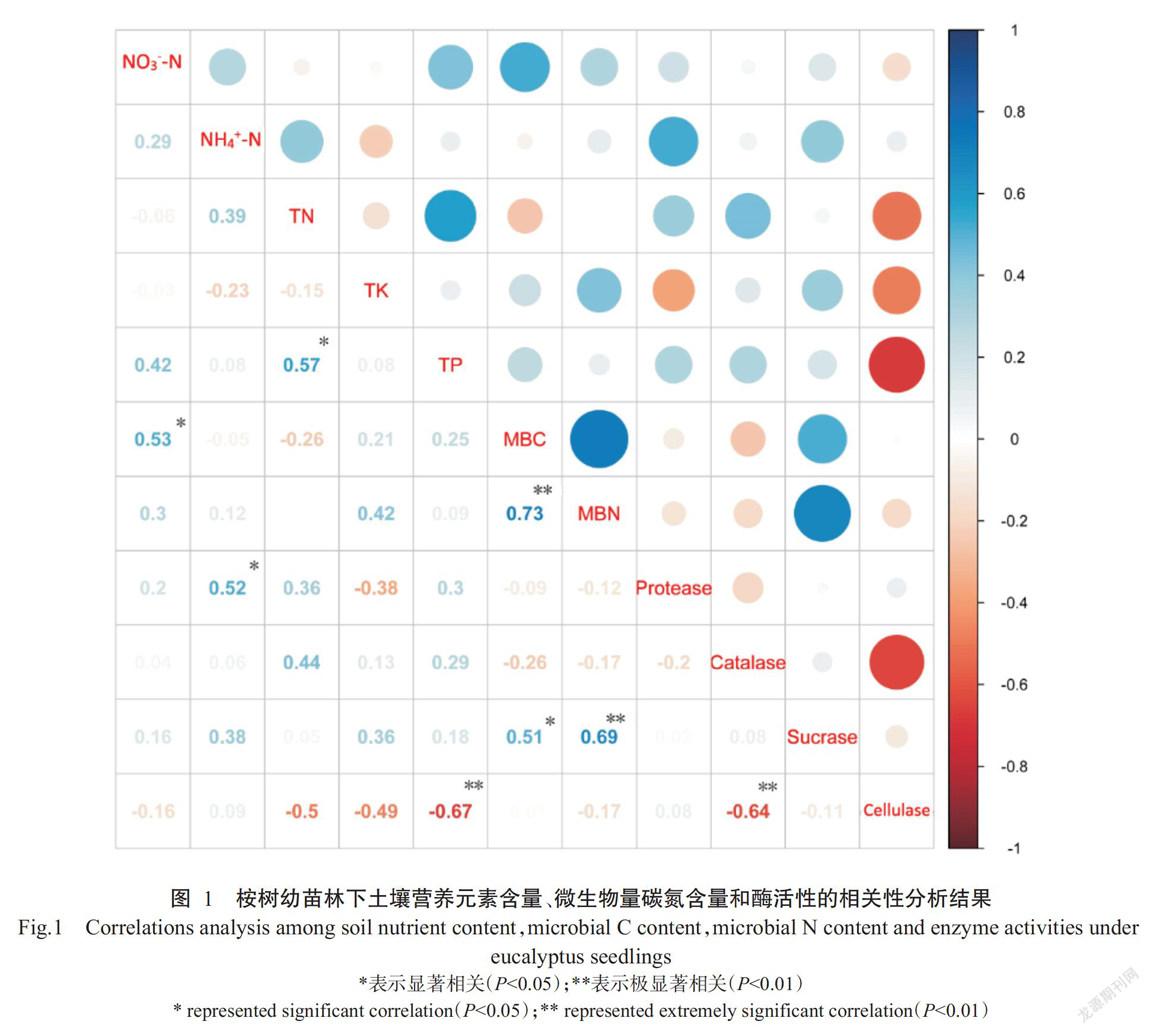
从图1可看出,NO3--N含量与MBC含量呈显著正相关(R2=0.53),NH4+-N含量与蛋白酶活性呈显著正相关(R2=0.52),TN含量与TP含量呈显著正相关(R2=0.57),TP含量与纤维素酶活性呈极显著负相关(P<0.01,下同;R2=-0.67),MBC含量与MBN含量呈极显著正相关(R2=0.73),MBC含量和MBN含量分别与蔗糖酶活性呈极显著和显著正相关(R2分别为0.69和0.51),土壤CAT活性与纤维素酶活性呈极显著负相关(R2=-0.64)。说明土壤微生物可直接利用的碳源主要来源于地上凋落物和土壤有机质。
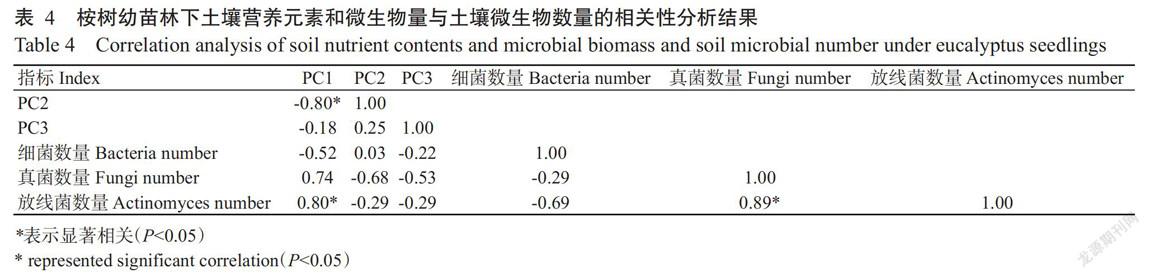
对桉树幼苗林下土壤微生物量碳氮和N素含量7个因素提取公因式,提取的3个主成分PC1(第一主成分)、PC2(第二主成分)和PC3(第三主成分)可分别解释33.231%、26.36%和17.99%的方差,合计能解释75.58%的方差(P=0.014)。PC1主要代表NO3--N、MBC和MBN因子,其荷载分别为0.734、0.857和0.703;PC2主要代表TN、TK和TP因子,其荷载分别为0.892、0733和0.775;PC3主要代表NH4+-N因子,其荷载为0.595。由表4可知,公因子PC1与放线菌数量呈显著正相关,与PC2呈显著负相关,与PC3和细菌数量呈负相关,与真菌数量呈正相关,但相关性不显著;PC2与PC3和细菌数量呈正相关,与真菌数量和放线菌数量呈负相关,但相关性不显著;PC3与细菌数量、真菌数量和放线菌数量呈负相关,但相关性不显著;细菌数量与真菌数量和放线菌数量呈负相关,但相关性不显著;真菌数量与放线菌数量呈显著相关。因此,放线菌数量可表征土壤因子中NO3--N、MBC含量和MBN含量的动态变化。将各处理桉树幼苗林下的土壤营养元素含量和微生物量碳氮含量代入以下方程计算其总得分,得到PC(M0B0)=1.24,PC(MB0)=0.98,PC(MB40)=1.09,PC(M0B20)=1.45,PC(MB20)=1.18。
PC1=0.36×NO3--N含量+0.096×NH4+-N含量-
0.15×TN含量+0.068×TK含量+0.066×TP
含量+0.42×MBC含量+0.34MBN含量
PC2=-0.31×NO3--N含量+0.079×NH4+-N含量+
0.57×TN含量+0.17×TK含量+0.52×TP
含量-0.098×MBC含量+0.035×MBN含量
PC3=0.35×NO3--N含量+0.49×NH4+-N含量-
0.024×TN含量-0.604×TK含量-0.12×TP
含量-0.003×MBC含量-0.15×MBN含量
PC=0.44×PC1+0.35×PC2+0.21×PC3
综上所述,施用低浓度(20.0 t/ha)生物炭相对于CK和其他处理均能明显提高桉树幼苗林下土壤养分和微生物量碳氮含量,且桉树幼苗林下土壤环境因子NO3--N、MBC和MBN含量与放线菌数量呈显著正相关。
3 讨论
本研究结果表明,与CK相比,单独施用生物炭可显著提高桉树幼苗的茎叶生物量和总生物量,单独施用益生菌则显著降低桉树幼苗的生物量(根生物量除外)和生长量,与覃小红等(2012)对桉树幼苗的研究结果不一致,但与李明等(2015)对水稻的研究结果相似。覃小红等(2012)研究发现,施用益生菌对桉树幼苗生物量和生长量无显著影响,其原因是桉树幼苗生长初期根系生长不发达,供给益生菌生长繁殖所需碳源和能源的根际分泌物较少,益生菌在幼苗生长初期固氮作用不明显,供给幼苗直接利用的土壤氮素不足。李明等(2015)研究认为,施用生物炭在短期内可迅速改良水稻土的水分状况、营养元素含量和通气条件,从而改变水稻根系对水肥的利用速率。本研究中,混施益生菌+20.0 t/ha生物炭桉树幼苗的冠幅和叶生物量显著低于CK,其他指标与CK差异不显著;混施益生菌+40.0 t/ha生物炭桉树幼苗的冠幅、地径、叶生物量和总生物量显著低于CK,树高与CK差异不显著,可能与施用生物炭短期内迅速改变土壤持水率、养分因子和pH,从而改变益生菌生长环境,降低益生菌固氮效率有关(Muhammad et al.,2014)。
本研究中,单独施用益生菌桉树幼苗林下土壤的CAT活性显著低于CK,与李媛媛(2015)研究认为土壤CAT主要来源于植物根系分泌物及土壤细菌和真菌,在根系生长不发达的土壤中CAT活性相对较弱的观点一致。土壤蛋白酶作为土壤氮素转化的主要水解酶,其活性与土壤可利用氮素水平直接相关。王晓峰等(2015)研究表明,蛋白酶和谷氨酰胺酶等氮转化酶的提升均有利于土壤氮素固持,本研究中土壤NH4+-N含量与蛋白酶活性呈显著正相关的研究结果与其一致。本研究结果显示,MBC含量与NO3--N含量呈显著相关,与王艳芳等(2018)对旱作花生的研究结果相似;MBC含量与MBN含量呈显著正相关,与符鲜等(2018)对套作小麦—玉米土壤的研究结果一致。
本研究中,各处理桉树幼苗林下土壤的细菌数量和放线菌数量间均无显著差异,但CK的细菌数量明显多于其他处理,放线菌数量明显少于其他处理。究其原因可能是高温时生物炭挥发的浓缩物是极易被土壤放线菌分解的碳源(Ogawa and Okimori,2010),但大量施用生物炭会降低土壤细菌对酚酸类碳源的利用能力(胡瑞文等,2018),从而使细菌和放线菌数量呈相反的变化趋势;土壤真菌数量表现为MB20处理显著高于CK和其他处理,其原因是生物炭的多孔隙结构能为真菌菌丝附着提供良好的栖息环境,同时添加的益生菌兼具固氮、解磷、解钾功能,能增加土壤供给真菌生长利用的营养元素,但施用高浓度生物炭会使磷成为固氮菌生长繁殖的限制因子而降低固氮菌的固氮量,与Rondon等(2007)的研究结果一致。韩建刚和李占斌(2011)研究表明,真菌数量随单独施用生物炭量的增加而减少,其原因是土壤细菌和放线菌能在短期内吸收利用生物炭表面提供的有机碳氮从而快速、大量繁殖,进而抑制真菌繁殖。
本研究结果表明,桉树幼苗林下土壤环境因子NO3--N、MBC和MBN含量与放线菌数量呈显著正相关,说明土壤微生物数量与微生物量碳氮含量和土壤养分含量间具有统一性,同时证实微生物数量可作为判断土壤有效养分水平和微生物生物量的科学依据,与卢成阳等(2013)对土壤微生物、微生物生物量和土壤有效养分的研究结果一致。从不同处理在公因子上的排名可知,施用低浓度(20.0 t/ha)生物炭相对于CK和其他处理均能明显提高土壤养分和微生物量碳氮含量,体现了施用适宜浓度生物炭对土壤营养元素的固持作用和对微生物生长繁殖的促进作用(张千丰和王光华,2012)。因此,在考虑土壤养分变化和桉树幼苗生长对施用生物炭和益生菌的响应时,应该充分考虑土壤养分与土壤微生物间的联系特征及其耦合关系,以保障土壤生态系统朝着更健康、更完备的方向发展。
4 结论
桉树幼苗林下土壤的微生物数量与土壤养分含量、酶活性及微生物量碳氮含量等关系密切,施用20.0 t/ha生物炭可显著提高桉树幼苗的根、茎、叶生物量,同时能提高其对林下土壤营养元素的固持能力和微生物量碳氮含量。
参考文献:
程效义,刘晓琳,孟军,兰宇,刘遵守,杨旭,黄玉成,曹婷,陈温福. 2016. 生物炭對棕壤NH3挥发、N2O排放及氮肥利用效率的影响[J]. 农业环境科学学报,35(4):801-807. [Cheng X Y,Liu X L,Meng J,Lan Y,Liu Z S,Yang X,Huang Y C,Cao T,Chen W F. 2016. Effects of biochar on NH3 volatilization,N2O emission and nitrogen fertili-zer use efficiency in brown soil[J]. Journal of Agro-Environment Science,35(4):801-807.]
符鲜,杨树青,刘德平,刘月. 2018. 施氮水平对河套灌区套作小麦—玉米土壤微生物量碳、氮的影响研究[J]. 生态环境学报,27(9):1652-1657. [Fu X,Yang S Q,Liu D P,Liu Y. 2018. Effects of nitrogen application on soil microbial biomass carbon and nitrogen of intercropping wheat-corn in Hetao irrigation area[J]. Ecology and Environmental Sciences,27(9):1652-1657.]
关松荫. 1986. 土壤酶及其研究方法[M]. 北京:农业出版社. [Guan S Y. 1986. Soil enzyme and the research methods[M]. Beijing: Agricultural Press.]
韩建刚,李占斌. 2011. 紫色土丘陵区不同土地利用类型小流域氮素流失规律初探[J]. 水利学报,42(2):160-165. [Han J G,Li Z B. 2011. Process characteristics of nitrogen loss by runoff in different land use watersheds in purple soil hilly region[J]. Journal of Hydraulic Engineering,42(2):160-165.]
胡瑞文,刘勇军,周清明,刘智炫,黎娟,邵岩,刘卉. 2018. 生物炭对烤烟根际土壤微生物群落碳代谢的影响[J]. 中国农业科技导报,20(9):49-56. [Hu R W,Liu Y J,Zhou Q M,Liu Z X,Li J,Shao Y,Liu H. 2018. Effects of bio-carbon on the carbon metabolism of rhizosphere soil microbial communities in flue-cured tobacco[J]. Journal of Agricultural Science and Technology,20(9):49-56.]
李明,李忠佩,刘明,江春玉,吴萌. 2015. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学,48(7):1361-1369. [Li M,Li Z P,Liu M,Jiang C Y,Wu M. 2015. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil[J]. Scientia Agricultura Sinica,48(7):1361-1369.]
李媛媛. 2015. 采煤塌陷地泥浆泵复垦土壤微生物多样性及土壤酶活性研究[D]. 武汉:中国矿业大学. [Li Y Y. 2015. Microbial diversity and enzyme activity of soil reclaimed by hydraulic dredge pump in coal-mining subsidence areas[D]. Wuhan:China University of Mining and Techno-logy.]
卢成阳,彭晚霞,宋同清,曾馥平,杨钙仁,张浩,鹿士杨,杜虎. 2013. 喀斯特峰丛洼地不同生态系统土壤微生物与养分的耦合关系[J]. 生态学杂志,32(3):522-528. [Lu C Y,Peng W X,Song T Q,Zeng F P,Yang G R,Zhang H,Lu S Y,Du H. 2013. Coupling relationships between soil microbe and soil nutrient under different ecosystems in depression between karst hills[J]. Chinese Journal of Eco-logy,32(3):522-528.]
平亮,谢宗强. 2009. 引种桉树对本地生物多样性的影响[J]. 应用生态学报,20(7):1765-1774. [Ping L,Xie Z Q. 2009. Effects of introducing eucalyptus on indigenous biodiversity[J]. Chinese Journal of Applied Ecology,20(7):1765-1774.]
覃小红,黄宝灵,韦善华,吕成群,杨远彪,张辉. 2012. 固氮菌对桉树促生作用及其影响因素试验[J]. 林业实用技术,(8):3-5. [Qin X H,Huang B L,Wei S H,Lü C Q,Yang Y B,Zhang H. 2012. The effect of azotobacter on eucalyptus growth and affecting factor experiment[J]. Practical Forestry Technology,(8):3-5.]
王晓峰,刘红,张磊,罗珍,袁兴中,岳俊生,蔚建军. 2015. 澎溪河消落带典型植物群落根际土壤无机氮形态及氮转化酶活性[J]. 中國环境科学,35(10):3059-3068. [Wang X F,Liu H,Zhang L,Lou Z,Yuan X Z,Yue J S,Yu J J. 2015. Inorganic nitrogen forms and related enzyme activity of rhizosphere soils under typical plants in the littoral zone of Pengxi River[J]. China Environmental Science,35(10):3059-3068.]
王艳芳,李继伟,闫新伟,悦飞雪,刘领. 2018. 施用生物炭对旱作花生生长和产量构成及土壤酶活性的影响[J]. 河南科技大学学报(自然科学版),39(3):66-70. [Wang Y F,Li J W,Yan X W,Yue F X,Liu L. 2018. Effects of biochar amendments on peanut growth and yield composition and soil enzyme activity[J]. Journal of Hennan University of Science and Technology(Natural science),39(3):66-70.]
文晓萍,黄宝灵,吕成群,黄勇,莫雅芳,石前. 2008. 巨尾桉接种根瘤菌试验效果初探[J]. 西北林学院学报,23(6):118-121. [Wen X P,Huang B L,Lü C Q,Huang Y,Mo Y F,Shi Q. 2008. Research for the effect of rhizobia inoculation on the Eucalyptus grandis×E. urophy-lla[J]. Journal of Northwest Foresty University,23(6):118-121.]
张千丰,王光华. 2012. 生物炭理化性质及对土壤改良效果的研究进展[J]. 土壤与作物,1(4):219-226. [Zhang Q F,Wang G H. 2012. Research progress of physiochemical properties of biochar and its effects as soil amendments[J]. Soil and Crop,1(4):219-226.]
朱育峰,肖智华,彭晚霞,杜虎,宋敏,刘永贤. 2018. 广西不同龄级桉树人工林植物多样性和群落结构动态变化特征[J]. 中南林业科技大学学报,38(12):38-44. [Zhu Y F,Xiao Z H,Peng W X,Du H,Song M,Liu Y X. 2018. Dynamics of plant diversity and community structure of Eucalyptus plantation at different ages class in Guangxi[J]. Journal of Central South University of Forestry & Technology,38(12):38-44.]
Chan K Y,Van Zwieten L,Meszaros I,Downie A,Joseph S. 2008. Using poultry litter biochars as soil amendments[J]. Australian Journal of Soil Research,46:437-444.
Compant S,Clement C,Sessitsch A. 2010. Plant growth-promoting bacteria in the rhizo and endosphere of plants:Their role,colonization,mechanisms involved and prospects for utilization[J]. Soil Biology and Biochemistry,42(5):669-678.
Gaskin J W, Steiner C, Harris K,Das K C,Bibens B. 2008. Effect of low-temperature pyrolysis conditions on biochar for agricultural use[J]. Trans of the ASBE,51(6):2061-2069.
Glaser B,Lehmann J,Zech W,Khoo C S,Hayes W J. 2002. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal-A review[J]. Biology and Fertility of Soils,35(4):219-230.
Khan A G,Kuek C,Chaudhy T M,Khoo C S,Hayes W J. 2000. Role of plants,mycorrhizae and phytochelators in heavy metal contamina-ted land remediation[J]. Chemosphere,41(1-2):197-207.
Laird D A. 2008. The charcoal vision:A win-win-win scena-rio for simultaneously producing bioenergy,permanently sequestering carbon,while improving soil and water qua-lity[J]. Agronomy Journal,100(1):178-181.
Lehmann J,Gaunt J,Rondon M. 2006. Bio-char sequestration in terrestrial ecosystems-A review[J]. Mitigation and A-daptation Strategies for Global Change,11(2):403-427.
Muhammad N,Dai Z,Xiao K,Meng J,Brookes P C,Lin X,Wang H,Wu J J,Xu J M. 2014. Changes in microbial community structure due to biochars generated from di-fferent feedstocks and their relationships with soil chemical properties[J]. Geoderma,226(1):270-278.
Ogawa M,Okimori Y. 2010. Pioneering works in biochar research,Japan[J]. Australian Journal of Soil Research,48(6-7):489-500.
Pham V T K,Rediers H,Chequire M G K,Nguyen H H,Mot R D,Vanderleydon J,Spaepen S. 2017. The plant growth-promoting effect of the nitrogen-fixing endophyte Pseudomonas stutzeri A15[J]. Archives of Microbiology,199(3):513-517.
Rondon Marco A,Lehmann Johannes,Ramírez Juan,Hurtado Maria. 2007. Biological nitrogen fixation by common beans(Phaseolus vulgaris L.) increases with bio-char additions[J]. Biology and Fertility of Soils,43(6):699-708.
Subramanian P,Kim K,krishnamoorthy R,Sundaram S,Sa T. 2015. Endophytic bacteria improve nodule function and plant nitrogen in soybean on co-inoculation with Bradyrhizobium raponicum MN110[J]. Plant Growth Regulation,76(3):327-332.
Welbaum G E,Sturz A V,Dond Z M,Nowak J. 2004. Mana-ging soil microorganisms to improve productivity of agro-ecosystems[J]. Journal Critical Reviews in Plant Sciences,23(2):175-193.
(責任编辑 思利华)
