利用基因组编辑技术定点突变IPA1基因创制水稻新株型材料
2019-09-10刘华清孙庆山杨绍华周淑芬王锋
刘华清 孙庆山 杨绍华 周淑芬 王锋




摘 要:【目的】水稻株型改良是提高水稻产量的一个有效途径。水稻理想株型基因IPA1是一个调控水稻株型的关键基因,利用基因组编辑技术(TALENs技术)定点突变水稻IPA1基因,了解IPA1基因不同序列变异的株型效应,为进一步利用IPA1基因创制实用型水稻新株型材料奠定基础。【方法】利用TALENs技术定点突变优良恢复系明恢86的IPA1基因,通过测序鉴定突变体,种植于标准小区,调查分析其株型相关性状。【结果】利用TALENs技术获得了8种不同序列突变的水稻ipa1突变体,并通过转基因植株自交结合PCR分析筛选到去除了TALENs表达框,获得4种不含外源转基因成分的纯合突变体材料(IPA1基因表达区分别缺失2、4、16、23 bp)。表型分析发现,IPA1基因突变能够显著改变水稻的株高、有效穗数、穗长及穗粒数等性状。与野生型比较,缺失移码突变体株高降低7.9%~11.4%,有效穗数增加46.9%~68.4%,穗长短24.2%~29.3%,穗粒数减少31%~34%,结实率和千粒重差异不明显。【结论】利用TALENs技术定点突变水稻IPA1基因能够明显改变水稻株高、有效穗数、穗长及穗粒数等主要性状,产生水稻新株型。
关键词:水稻;IPA1基因;基因组编辑;突变体;新株型
中图分类号:S 511;S 330;Q 812文献标识码:A文章编号:1008-0384(2019)08-867-06
Abstract: 【Objective】 The site-directed mutagenesis on grain-yield-related IPA1 to modifying the morphological characteristics of a rice plant for breeding purpose was studied. 【Method】 Minghui 86, a rice elite restorer, was used in the study. The primary gene that governs the gain yield of the rice plant, IPA1, was edited using the transcription activator-like effector nucleases (TALENs) to generate mutated plants for subsequent identification by gene sequencing and cultivation on standard plots to verify results of the mutagenesis. Eight transgenic rice plants that differed in ipa1 sequences had the TALENs boxes cleaved for self-crossing followed by screening with PCR analysis to arrive at 4 mutants with 2bp, 4bp, 16bp or 23bp segment deleted in their IPA1 genes. 【Result】A phenotypic analysis on the 4 mutants free of exogenous transgenic elements confirmed that the site-directed mutagenesis on IPA1 had significantly altered the plant height, effective panicle number, panicle length, and grain number per panicle of the mutated rice plants. Compared with the wild-type Minghui 86, the plant height of the mutants was decreased by 7.9% to 11.4%, the effective panicle number increased by 46.9% to 68.4%, the panicle length shortened by 24.2% to 29.3%, the number of grains per panicle reduced by 31% to 34%, but the seed setting rate and 1000-grain weight were not changed significantly. 【Conclusion】 The site-directed mutagenesis applying TALENs on IPA1 could significantly modify the plant height, effective panicle number, panicle length, and grain number per panicle on the new rice plant. The technique could be applied for the breeding program on rice to increase grain yield.
Key words:rice (Oryza sativa L.); IPA1 gene; genomic editing; mutant; new plant architecture
0 引言
【研究意義】提高水稻产量一直是水稻育种研究的重要内容。前人研究表明,理想株型与杂种优势利用相结合是提高水稻产量的有效途径[1-2]。改良水稻株型实质是协调水稻产量相关性状——有效穗数、穗粒数和粒重等主要性状之间的关系。传统杂交育种方法改良水稻产量相关性状存在的不确定性和盲目性,大大限制了水稻高产育种水平的提高。大量水稻产量相关性状基因的克隆及相关生物技术的应用,特别是近几年发展起来的基因组编辑技术的应用,为定向改良水稻株型和产量相关性状创造了条件,也提供了一条有效途径。【前人研究进展】基因组编辑技术(genome editing)是一种在基因组水平上对DNA序列进行改造的遗传操作技术。其基本原理是利用序列特异性核酸酶(sequence-specific nucleases,SSNs)锚定基因组特定的位点,产生DNA双链断裂,激活细胞自身修复机制,进行非同源末端连接或同源重组修复。在修复过程中会发生基因序列改变,从而实现基因定点缺失、定点插入或替换等突变,从而达到定点改造基因组的目的[3]。目前用于基因组编辑的序列特异性核酸酶(SSNs)主要有3类:锌指核酸酶(Zinc finger nuclease, ZFN)、类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease, TALEN)和CRISPR/Cas9(Clustered regularly interspaced short palindromic repeats/CRISPR-associated 9)系统。近年来,随着基因组编辑技术的发展和完善,基因组编辑技术开始广泛应用于作物遗传及育种种质创新研究[4]。【本研究切入点】水稻理想株型基因Ideal Plant Architecture 1(IPA1)是决定株型的关键调节因子,编码SPL14蛋白,是一个SPL转录因子家族成员, 其表达主要受miRNA156调节[5-6]。当miRNA156在基因IPA1上的识别位点发生突变时,干扰miRNA156调控IPA1 mRNA的降解,使IPA1表达量增高,导致水稻植株的分蘖数减少,株高和穗粒数增加,形成所谓的分蘖少、穗大、株型好的 “理想株型”[5-7]。但由于不同的生态环境及育种目标,对株型的要求有所差异,使得理想株型的应用受到很大限制。通常,水稻多穗型品种较少蘖、大穗型品种有更好的适应性。本研究从创制与理想株型相反的水稻株型材料入手,探讨创制多穗型水稻株型的方法,并了解其株型特征。【拟解决的关键问题】基于基因组编辑技术在基因定向突变方面的有效性,本研究利用TALENs技术,定点突变明恢86背景下的IPA1基因,创制一批IPA1基因突变体,获得与理想株型相反的水稻株型材料,为水稻株型改良提供新的遗传变异材料。
1 材料与方法
1.1 材料
本研究所用受体水稻品种明恢86,是一个优良的籼型三系杂交稻恢复系[8]。所用菌株由本实验室保存; TALEN 左臂骨架载体、TALEN 右臂骨架载体、植物表达载体p1300M等质粒载体均由上海斯丹赛生物技术有限公司提供。
1.2 方法
1.2.1 基因序列的获取及靶位点的设计和选择
利用粳稻日本晴基因组上IPA1基因的序列信息(NCBI:http://www.ncbi.nlm.gov/),考虑IPA1基因序列较长,设计了两对分段扩增引物(IPA1-F1:GCT ACA GTC TCC TTC CCA CC, IPA1-R1:CAG GCA AGT CAC ATC ACT CAA C;IPA1-F2:CAC AGC AGC AGT GGA TAG GAI,PA1-R2:CGC ATT ATT ATT CAT CAC AGG GA),通过PrimeSTAR HS DNA Polymerase PCR扩增体系,扩增获得明恢86中IPA1基因全长序列,与日本晴进行比对分析。
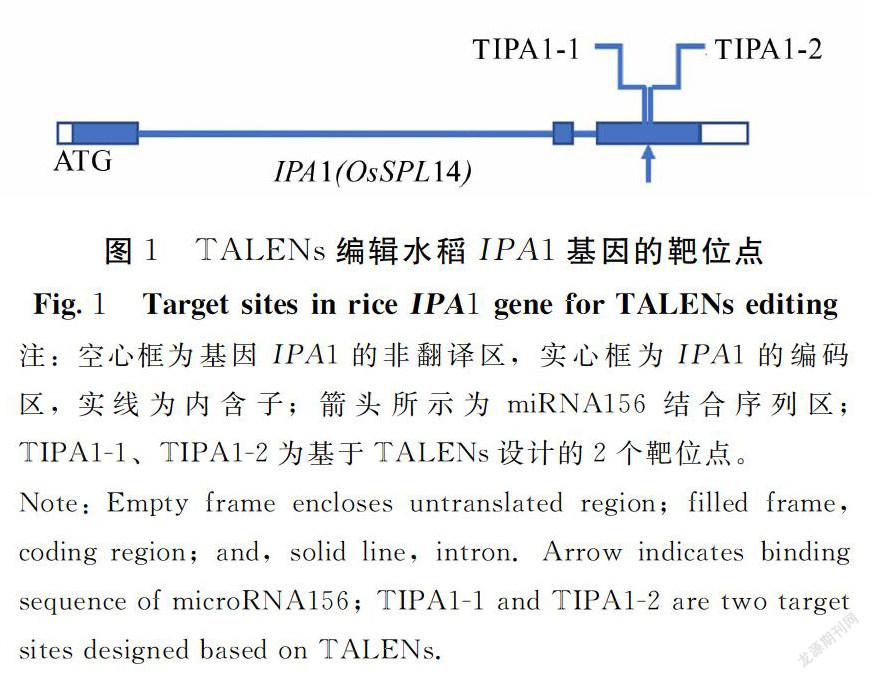
靶位点的设计和选择是利用相关TALENs靶位点设计辅助网站(或www.talendesign.org/)获得基因可供选择的靶位点,综合基因特点选择最优靶位点[9]。
1.2.2 载体构建及转基因植株的获得
合适靶位点选取后,明确TALEN左臂、右臂识别序列,根据上海斯丹赛公司提供的试剂盒使用说明书及模块组合方法,首先分别合成左、右臂识别元件及其连接的FokI核酸酶的表达载体。在由上海斯丹赛生物技术有限公司提供的TALEN 左臂骨架载体、TALEN 右臂骨架载体的基础上添加识别靶位的TALE蛋白的表达元件。验证正确后,再将左、右臂识别元件及其连接的FokI核酸酶的表达元件连接到植物表达载体p1300M上,并通过测序确定,构建完整的TALENs表达载体。将构建好的表达质粒导入农杆菌LBA4404,采用本实验室创建的高效农杆菌介导籼稻胚性愈伤转化方法[10 ],获得转基因再生植株。
1.2.3 水稻遗传转化苗阳性植株筛选
检测TALENs表达载体框是否成功插入到再生水稻基因组中,本研究通过TALENs表达载体框引物(TF:5- TGA CCG AGT TCA AGT TCC-3′;TR:5′-TTG CGG GAC TCT AAT CA-3′)PCR分析遗传转化苗的总DNA,能够扩增出392 bp特异性条带的为阳性转化植株。
1.2.4 靶位点序列突变检测
TALENs载体遗传转化阳性植株的靶位点序列分析采用PCR扩增,然后测序分析。扩增引物(ITF: GCA GTG GCG GGA TAT GGT;ITR:ATC GTG TTG CTG GTT TGG)基于靶位点两侧序列设计。对于测序后确定的突变体,当靶位点序列缺失或插入4 bp以上时,后代追踪突变位点采用PCR结合聚丙烯酰胺凝胶(2%)电泳分析,而不是测序分析,以提高效率,减少费用。
1.2.5 突变体的相关表型分析
IPA1是影响株型的重要基因,突变体的表型分析主要从株高、穗数、穗粒数、千粒重、穗长等方面考察表型。因穗数受环境影响较大,所以在突变体周围种植保护行,以尽量减少环境造成的误差。所有的田间调查数据都进行3次重复,并用DPS 7.05数据处理软件分析。
2 结果与分析
2.1 目标基因序列分析及靶位点选择
为了准确利用基因组编辑技术编辑籼稻恢复系明恢86的理想株型基因IPA1,需要了解明恢86中IPA1基因序列信息。因此,利用PCR扩增明恢86背景下IPA1基因序列,测序后比对发现,明恢86中IPA1基因序列与日本晴的一致。
依据相关文献[5-7],基因IPA1是水稻分蘖数的一个负调控因子,其表达序列区有一个miRNA156结合位点,该结合位点序列发生碱基替换突变时,基因IPA1的表达产物增加,引起水稻株型的变化。为了解该miRNA156结合位点区发生强突变对水稻株型的影响,本研究TALENs的靶位点选择在miRNA156结合的位点附近(图1)。依据TALENs靶序列设计原则,本研究设计了2个TALENs靶位(表1),分别利用这2个靶序列构建了相应的TALENs表达载体TIPA1-1和TIPA1-2,以期增加获得期望突变的概率。
2.2 农杆菌介导转化和阳性再生克隆的筛选
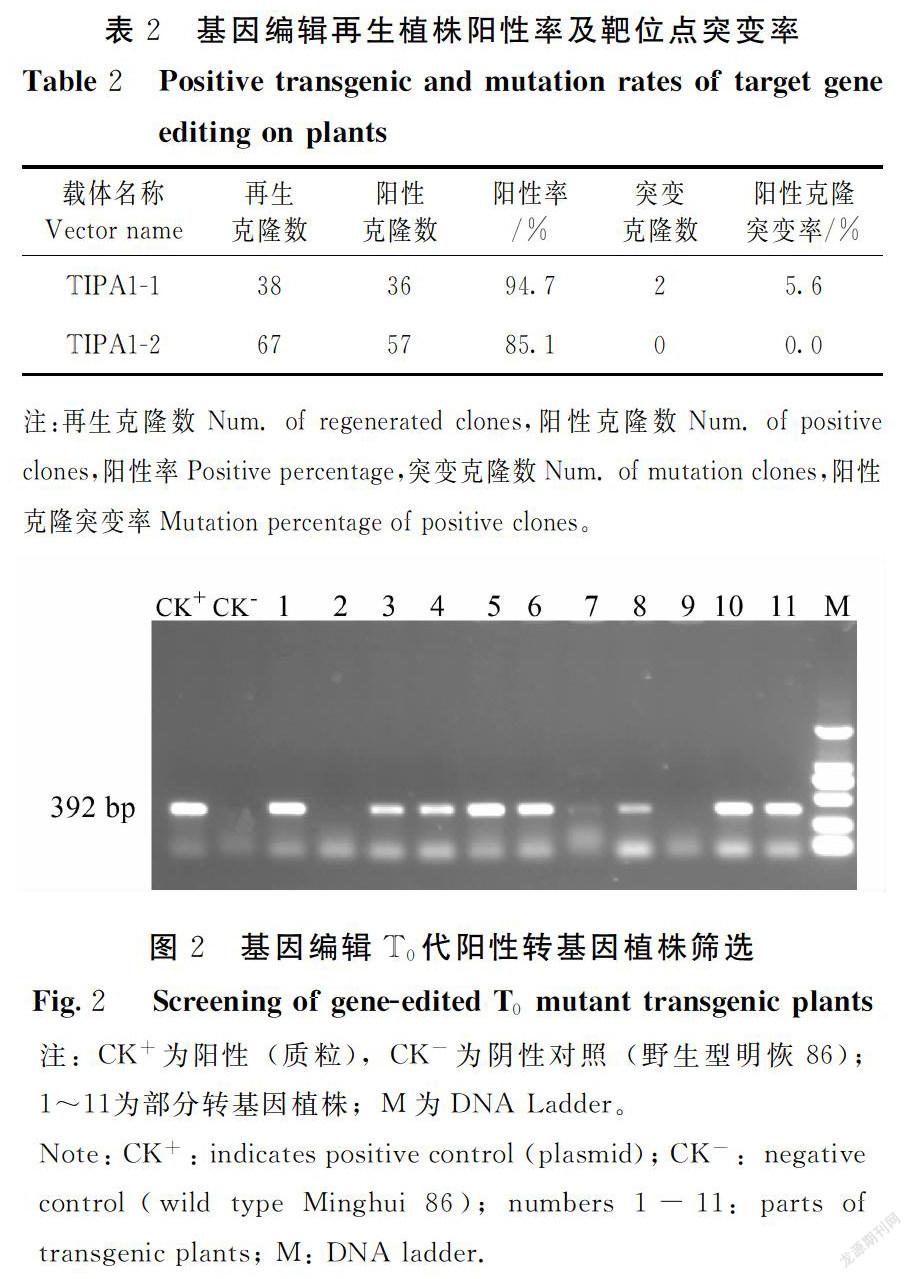
将所构建的TALENs载体(TIPA1-1和TIPA1-2)分别经农杆菌介导转化水稻愈伤组织,获得转基因再生植株。PCR检测发现,不同的载体转基因后代的阳性克隆率有所不同。总的看TALENs载体的阳性克隆率较高,TIPA1-1和TIPA1-2的阳性克隆率分别为94.7%和85.1%(表2、图2)。
2.3 转基因植株中靶位点序列检测
对TALENs载体获得T0代阳性转基因植株,用引物ITF/ITR扩增IPA1基因的靶位點区,测序发现TIPA1-1载体转基因阳性克隆中只有2个克隆的植株靶位点有突变,阳性植株突变率约5.6%;而TIPA1-2载体转基因后代中未检测到靶位点的突变(表2)。进一步将TIPA1-1和TIPA1-2的抗性愈伤组织进行继代培养,连续继代后分化,结果发现:TIPA1-1新的再生植株中出现新突变(原来无突变克隆)或新的突变类型(原有突变克隆),并出现纯合突变和大片段缺失的类型;连续继代两代后即出现缺失16 bp的纯合突变和缺失180 bp的大片段缺失突变体。在TIPA1-1继代分化苗中筛选到31株突变体,突变类型有8种(图3)。而在TIPA1-2继代分化苗中仍未筛选到靶位点突变植株,推测TIPA1-2的TALENs蛋白可能缺少活性。
2.4 不含转基因成分突变体植株筛选
将上述目标基因序列突变的T0代植株进行自交,获得T1代种子,种植成T1代植株。利用载体引物对这些T1代植株中的转基因成分进行PCR分析,筛选出不含转基因成分的T1代植株(图4)。
再利用测序(单碱基变异)或聚丙烯酰胺凝胶电泳(多碱基缺失或插入)对不含转基因成分植株中靶位点序列进行分析,获得不含外源转基因成分的纯合或杂合靶基因突变体(图5)。进一步对纯合突变体的农艺性状进行选择可获得水稻新种质。
2.5 IPA1-TALENs转基因植株后代表型观察及新株型材料创制
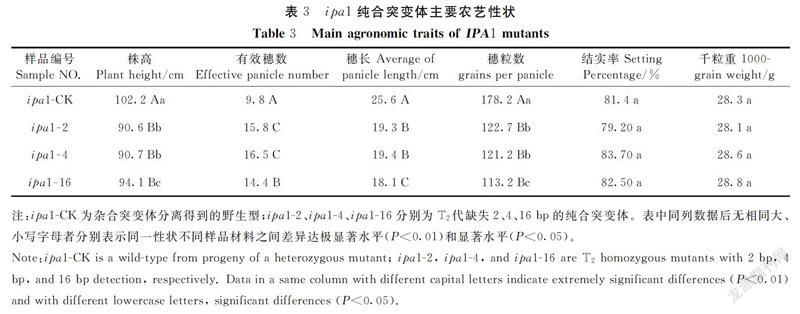
选择不含外源转基因成分的3种突变体(缺失2、4、16 bp移码突变体)观察田间表型。田间调查结果发现,这3种突变体的表型变化一致,株高相对野生型显著降低,而分蘖数显著增多(图6)。
对考种数据进行分析发现,IPA1基因突变能够显著改变水稻的株高、有效穗数、穗长及穗粒数。在明恢86遗传背景下,缺失移码突变体的株高为90.6~94.1 cm、有效穗数为14.4~16.5个· 株-1、穗长为18.1~19.4 cm、穗粒数为113.2~122.7粒、结实率为79.20%~83.70%、千粒重为28.1~28.8 g。与野生型比较,突变体的株高降低7.9%~11.4%,有效穗数增加46.9%~68.4%,穗长变短24.2%~29.3%,穗粒数减少31%~34%,结实率和千粒重差异不明显(表3)。由此可见,利用TALENs基因组编辑技术定点突变水稻IPA1基因能够明显改变水稻株高、有效穗数、穗长及穗粒数等性状,产生与野生型不同的水稻新株型。
3 讨 论
20世纪90年代, Khush等提出水稻“新株型”(理想株型)概念,其特征是少分蘖、植株较矮、穗粒数较多、茎秆强壮、根系发达并抗多种病虫害等[18-19],但依此理念早期进行的水稻新株型育种实践效果并不理想[20-21]。水稻理想株型育种虽然进展缓慢,但有关理想株型相关基因的分子遗传学研究取得一系列重要进展,特别是围绕水稻理想株型关键基因IPA1的功能及调控机制研究[5-6,22-24],为水稻理想株型育种注入了新的活力。本研究通过基因组编辑技术定向突变了IPA1基因,在优良恢复系明恢86的背景下创制了一批ipa1基因移码突变体,表型观察发现:其植株显著矮化,分蘖显著增多,穗粒数显著减少,是一些与理想株型特征完全不同的株型变异。
目前生产上应用的每一种水稻株型都有缺陷,这是因为水稻产量构成因子(有效穗数、穗粒数和千粒重)间存在一定的负相关,增加水稻产量实质是它们彼此之间协调或折中的结果。早期的理想株型材料中,IPA1表达量增加,可显著增加穗粒数、但也显著减少了分蘖数,使得理想株型的增产效应并不明显[20-21 ]。对超级稻甬优12的最新研究发现,控制IPA1的表达水平可以适度调节理想株型性状,从而有可能获得理想产量[22]。当然,实际生产上应用的水稻品种产量形成的遗传机理要复杂得多,不仅仅是IPA1基因,也涉及其他相关基因及其互作效应[25-26]。本研究通过基因编辑突变IPA1基因后产生了一系列多穗型株型突变体,但这些突变体的产量效应,特别是与不同不育系配组后的杂种表现,以及与其他产量构成性状基因(如穗粒数基因、粒重基因等)的关系还有待进一步研究。
参考文献:
[1]袁隆平.杂交水稻超高产育种[J]. 杂交水稻,1997, 12(6):1-3.
YUAN L P.Hybrid rice breeding for super high yield[J].Hybrid Rice,1997, 12(6):1-3.(in Chinese)
[2]杨守仁. 水稻超高产育种问题探讨[J].中国农学通报, 1990,6(3):5-8.
YANG S R. Discussion on rice breeding for super high yield[J].Chinese Agricultural Science Bulletin, 1990,6(3):5-8.(in Chinese)
[3]GAJ T, GERSBACH C A, BARBAS III C F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering[J]. Trends Biotechnol, 2013, 31: 397-405.
[4]王福軍,赵开军. 基因组编辑技术应用于作物遗传改良的进展与挑战[J].中国农业科学, 2018, 51(1):1-16.
WANG F J, ZHAO K J.Progress and challenge of crop genetic improvement via genome editing[J].Scientia Agricultura Sinica, 2018, 51(1):1-16.(in Chinese)
[5]JIAO Y, WANG Y, XUE D,et al. Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J]. Nat Genet, 2010, 42(6): 541-544.
[6]MIURA K, IKEDA M, MATSUBARA A, et al.OsSPL14 promotes panicle branching and higher grain productivity in rice[J]. Nat Genet,2010,42:545-549.
[7]LU Z, YU H, XIONG G,et al. Genome-wide binding analysis of the transcription activator ideal plant architecture1 reveals a complex network regulating rice plant architecture[J]. Plant Cell, 2013, 25(10): 3743-3759.
[8]張建新, 郑家团, 谢华安,等.水稻新株型明恢86及其系列组合的选育研究[J]. 江西农业大学学报, 2000, 22 (4):485-490.
ZHANG J X, ZHENG J T, XIE H A, et al. Breeding of the rice ideal plant type minghui86 and its combinations[J]. Acta Agriculturae Universitis Jiangxiensis, 2000, 22 (4):485-490.(in Chinese)
[9]HEIGWER F, KERR G, WALTHER N,et al. E-TALEN: a web tool to design TALENs for genome engineering[J].Nucleic Acids Res,2013,41: e190.
[10]苏军,胡昌泉,翟红利,等.农杆菌介导籼稻明恢86高效稳定转化体系的建立[J]; 福建农业学报,2003,18(4):209-213.
SU J, HU C Q, ZHAI H L,et al.Establishment of a highly efficient and stable tranf orming system mediated by Agrobacterium tumefacien in indica rice[J].Fujian Journal of Agricultural Sciences,2003,18(4):209-213.(in Chinese)
[11]YOSHIDA S.Physiological aspects of grain yield[J]. Annu Rev Plant Physiol,1972,23:437-464.
[12]DONALD C M.The breeding of crop ideotypes[J]. Euphytica,1968,17:385-403.
[13]HAMBLIN J. The ideotype concept: Useful or outdated\[M\]//BUXTON D R, SHIBLES R, FORXBERG R A, et al.International Crop Science I. Madison: Crop Science Society of America, Inc Press, 1993:589-597.
[14]REYNOLDS M P, ACEVEDO E, SAYRE K D,et al. Yield potential in modern wheat varieties: its association with a less competitive ideotype[J]. Field Crops Res,1994,37:149-160.
[15]DONALD C M. A barley breeding program based on an ideotype[J]. J Agric Sci,1979,93:261-269.
[16]RASMUSSON D C. A plant breeder’s experience with ideotype breeding[J]. Field Crops Res,1991,26: 191-200.
[17]KOKUBUN M. Design and examination of soybean ideotypes[J]. Japan Agric Res Quart,1988,21:237-243.
[18]PENG S, KHUSH G S, CASSMAN K G. Evolution of the new plant ideotype for increased yield potential\[M\]//CASSMAN K G. Breaking the Yield Barrier. Los Ba os: International Rice Research Institute Press, 1994:5-20.
[19]KHUSH G S. Breaking the yield frontier of rice[J]. GeoJournal ,1995,35:29-332.
[20]PENG S. KHUSH G S, VIRK P,et al.Progress in ideotype breeding to increase rice yield potential[J]. Field Crops Res,2008,108: 32-38.
[21]MARSHALL D R. Alternative approaches and perspectives in breeding for higher yields[J]. Field Crops Res, 1991,26: 171-190.
[22]ZHANG L, YU H, MA B,et al. A natural tandem array alleviates epigenetic repression of IPA1 and leads to superior yielding rice[J]. Nat Commun, 2017, 8:14789.
[23]WANG J, YU H, XIONG G,et al. Tissue-specific ubiquitination by IPA1 INTERACTING PROTEIN1 modulates IPA1 protein levels to regulate plant architecture in rice[J]. Plant Cell ,2017,29:697-707.
[24]SONG X,LU Z, YU H.et al. IPA1 functions as a downstream transcription factor repressed by D53 in strigolactone signaling in rice[J]. Cell Res, 2017, 27:1128-1141.
[25]LI M, LI X, ZHOU Z, et al. Reassessment of the four yield-related genes Gn1a, DEP1, GS3, and IPA1 in rice using a CRISPR/Cas9 system[J]. Front Plant Sci,2016,7:377.
[26]ORDONIO R L,MATSUOKA M.New path towards a better rice architecture[J].Cell Res, 2017, 27:1189-1190.
(责任编辑:杨小萍)
