羊乳低聚糖超高效液相色谱-质谱鉴定中样品前处理方法及液相色谱条件优化
2019-09-06张书文逄晓阳王军辉吕加平
张 艳,芦 晶,张书文,逄晓阳,王军辉*,吕加平,*
(1.合肥工业大学食品与生物工程学院,安徽 合肥 230009;2.中国农业科学院农产品加工研究所,北京 100193)
乳汁提供了初生哺乳动物生长发育的全部营养需要,其含有丰富的蛋白质、脂肪、乳糖及微量的低聚糖,低聚糖虽然含量少却对幼小动物发育具有重要的生理活性[1]。乳低聚糖是由3~10 个单糖通过糖苷键共价连接的碳水化合物聚糖,构成乳低聚糖的单糖包括葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、N-乙酰葡糖胺(N-acetylglusamine,GlcNAc)、岩藻糖(fucose,Fuc)、N-乙酰神经氨酸(N-acetylneuraminic acid,NeuAc)和N-羟乙酰神经氨酸(N-glycolylneuraminicacid,NeuGc)[2]。大多数的乳低聚糖是以乳糖为核心的结构[3]。
研究发现,乳低聚糖作为益生元能有效促进肠道内有益菌双歧杆菌的生长,防止致病菌的附着,而降低腹泻的风险[2,4-5]。乳低聚糖根据末端连接方式的不同,分为酸性乳低聚糖(含有NeuAc和NeuGc)和中性乳低聚糖(含有N-乙酰基葡萄糖)[6-7]。研究证明,乳低聚糖可以调节肠道微生物菌群和提高免疫功能,唾液酸化的低聚糖可以作为Gal的来源用于合成半乳糖脑苷脂,唾液酸用于脑灰质中的神经节苷脂以及糖蛋白合成,促进大脑发育[8-9]。人乳中含有200余种低聚糖[10],然而,由于大小、电荷和结构的差异性,迄今为止,只有低分子质量的人乳低聚糖可以通过化学方法合成[11-12]。因此,寻找具有类似于人乳低聚糖生物活性的替代品并应用于婴儿配方食品已引起众多研究者的关注[13-14]。羊乳是婴幼儿配方粉的重要乳基料之一,有研究表明羊乳中低聚糖含量约为0.25~0.30 g/L,是牛乳低聚糖含量的8 倍左右[15],因此,羊乳被认为是潜在的母乳低聚糖替代物资源。羊乳中低聚糖的分离与检测技术研究已有较多报道,其中研究较为全面和先进的是美国加州大学戴维斯分校的科学与技术系[16-19]。但由于该实验室采用了特殊的分离柱,使其他单位难以参考或使用,限制了我国或其他国家对乳低聚糖种类和结构的研究,因此,建立有效、通用的羊乳低聚糖检测手段对我国羊乳低聚糖研究具有重要意义。
乳汁中乳糖含量在碳水化合物中的比例超过80%,而游离乳低聚糖含量只占4%左右,在实验鉴定中,由于高含量的乳糖几乎完全掩盖了低丰度低聚糖的检测信号,因此,需要对样品中的低聚糖进行纯化富集处理,减少乳糖等杂质的干扰,提高检测的灵敏度,在质谱鉴定中具有重要意义[20-21]。乳糖和乳低聚糖的分子质量较为接近,分离、富集乳低聚糖和提高检测灵敏度已成为国内外研究的一个难题,另外,乳低聚糖中同分异构体的分离较为困难,只有通过保留时间才能将其分开,所以超高效液相色谱条件的优化显得尤为重要。
本研究对比4 种富集方法对乳糖去除率和低聚糖保留率的影响,采用市售的氨基色谱柱结合Q-Exactive Focus质谱仪对富集的羊乳低聚糖进行超高效液相色谱条件优化分析,建立普适的羊乳低聚糖测定的可行方法,为我国羊乳低聚糖研究提供有效的检测手段。
1 材料与方法
1.1 材料与试剂
羊乳采自北京市某羊厂泌乳期2 个月的萨能羊;乙腈、甲醇(均为色谱级) 美国Fisher公司;甲酸铵(色谱级) 美国Sigma公司;无水乙醇、三氟乙酸(trifluoroacetic acid,TFA)等其他试剂均为国产分析纯。
1.2 仪器与设备
ACQUITY UPLC氨基色谱柱(2.1 mm×100 mm,1.7 μm)、Sep-Pak C18柱(500 mg/4 mL) 美国Waters公司;ME55精密电子天平 梅特勒-托利多仪器(上海)有限公司;JD-3电子天平 沈阳龙腾电子有限公司;ZLS-4真空离心浓缩机 北京金瑞博科技发展有限公司;TECAN SPARK20M酶标仪 上海贸易有限公司;ICS-3000离子色谱仪 美国戴安公司;石墨化碳柱(150 mg/4 mL) 美国Grace公司;Q Exactive Focus液相色谱组合四极杆Orbitrap质谱仪 美国赛默飞公司。
1.3 方法
1.3.1 羊乳低聚糖检测样品蛋白质去除率的测定
取7 mL羊乳,在4 ℃、10 000/min条件下离心30 min,去除上层的脂肪和底部少量的蛋白质,取出中间层转移到离心管中[22]。加入无水乙醇的比例分别为1∶2、1∶4、1∶6,反应温度分别为4、-20 ℃和-80 ℃,反应时间分别为2、4 h和12 h,反应结束后4 ℃、4 000×g离心30 min取上清液,用BCA试剂盒于波长562 nm测定蛋白质的含量[23],最后计算蛋白质的去除率。
1.3.2 羊乳低聚糖的提取
按照1.3.1节优化方法脱脂乳,并用ZLS-4真空离心浓缩仪浓缩备用。
1.3.3 羊乳低聚糖的富集
1.3.3.1 Sep-Pak C18和石墨化碳柱法
首先用5 mL的甲醇平衡Sep-Pak C18柱,然后用10 mL(0.1% TFA)超纯水溶液冲洗Sep-Pak C18柱[24]。将上述的浓缩液浓缩干燥,溶于400 μL(0.1% TFA)超纯水溶液,然后加到Sep-Pak C18柱中。收集洗脱液,将洗脱液再次加入Sep-Pak C18柱中(此步骤重复2 次)。最后用3 mL(0.1% TFA)超纯水溶液冲洗Sep-Pak C18柱,收集洗脱液,此洗脱液即为羊乳寡糖的样品。
羊乳低聚糖的除盐,采用石墨化碳柱,除盐步骤包括:活化、平衡、加样、脱盐、洗脱等。首先,采用3 倍柱体积80%的乙腈溶液(0.1% TFA)和超纯水分别活化和平衡石墨化碳柱。将Sep-Pak C18柱的洗脱液上样,收集洗脱液(流速0.5~1.0 mL/min),此步骤重复2 次。用3 倍柱体积的超纯水冲洗柱子,吸附柱底PGC填料上的低聚糖,以便于除盐。最后用0.5 mL 10%乙腈溶液(0.1% TFA)、20%乙腈溶液(0.1% TFA)、40%乙腈溶液(0.1% TFA)将低聚糖分步洗脱,分别收集洗脱液备用。
1.3.3.2 超滤膜包法
按照说明书,将压力表、蠕动泵、储槽和小型膜包(截留分子质量1 000 Da,膜面积50 cm2)准确连接。打开压力计,使压力控制在40 psi,在储槽中倒入蒸馏水,用pH试纸检测滤液的酸碱性,当溶液呈现中性时,停止冲洗[25]。倒出剩余的蒸馏水,加入50 mL脱脂、去蛋白的低聚糖检测样品进行超滤,取超滤4、5 h和6 h的截留液各1 mL放置在-80 ℃冰箱中备用。
1.3.3.3 透析法
将脱脂、去蛋白浓缩样品加入到截留分子质量为1 000 Da的透析袋中,放置4 ℃冰箱24 h,每隔8 h换1 次水,换3 次水后,透析袋内溶液不再增加,倒出溶液放置-80 ℃冰箱备用[26]。
1.3.3.4 葡聚糖凝胶层析法
葡聚糖凝胶层析分离原理主要是分子筛作用,在分离的整个过程中,低聚糖在凝胶颗粒中不断扩散和受到排阻作用,根据分子质量的大小将其分离[26]。
将Sephadex-G10凝胶放置在烧杯中浸泡12 h,然后加入层析柱中(3.6 cm×60 cm),使用超纯水流速为5 mL/2 min预压12 h。将脱脂、脱蛋白浓缩样品加入Sephadex-G10凝胶柱中,采用超纯水为洗脱液,流速为5 mL/2 min,最终低聚糖被缓慢洗脱下来。用自动部分收集器收集馏分,每2 min收集1 管。最后用苯酚硫酸法检测收集管中有无低聚糖,将含有低聚糖的收集管放入-80 ℃冰箱中备用[27]。
1.3.4 乳糖的定量分析
采用C a r b o P a cTMP A 2 0糖分离柱(3 mm×150 mm),流动相A为超纯水,流动相B为250 mmol/L NaOH溶液,流速0.4 mL/min,柱温35 ℃,检测器为金电极脉冲安培检测器。梯度洗脱条件:0~40.1 min,7.2%~100% A;40.2~45 min,100% A;45.1~55 min,100%~7.2% A。使用此方法对乳糖进行定量分析,再进一步分析低聚糖峰面积的变化,选择一种乳糖的去除率较高和低聚糖损失较少的分离、富集方法。
1.3.5 超高效液相色谱条件
ACQUITY UPLC氨基色谱柱(2.1 mm×100 mm,1.7 μm);柱温35 ℃;流速0.2 mL/min;流动相A为乙腈;流动相B为10 mmol/L甲酸铵溶液;洗脱程序:0~20 min,95%~78% A;20~35 min,78%~73% A;35~38 min,73~62% A;38~45 min,62%~50% A。
1.3.6 质谱条件
采用Q-Exactive Focus质谱仪,使用电喷雾离子源;正离子模式,喷雾电压3.8 kV;负离子模式,喷雾电压3.4 kV。鞘气压力25 arb;辅气压力8 arb;加热温度350 ℃;毛细管温度320 ℃。在正负离子模式下对m/z300~2 000的低聚糖进行一级离子扫描。
1.4 数据处理
低聚糖通过GlycoPeakfinder工具在一级质谱的质量误差小于10×10-6进行匹配查找,采用Orignal 8.0软件绘制图表。
2 结果与分析
2.1 羊乳低聚糖检测样品蛋白质去除率测定结果
由表1可知,当脱脂乳与无水乙醇的比例为1∶6,反应温度在-20 ℃,反应时间为2 h时,蛋白质去除率达到88.55%。与其他4 组相比,此组蛋白质去除率最高,但仅比第2组的蛋白质去除率增加了1.54%。考虑到原料的节省问题,本实验选择脱脂乳与无水乙醇的比例1∶2、反应温度-20 ℃、反应时间4 h作为最优的反应条件。
2.2 羊乳低聚糖检测样品中乳糖去除率测定结果

表2 羊乳低聚糖中乳糖去除率Table 2 Removal rate of lactose from goat milk oligosaccharides
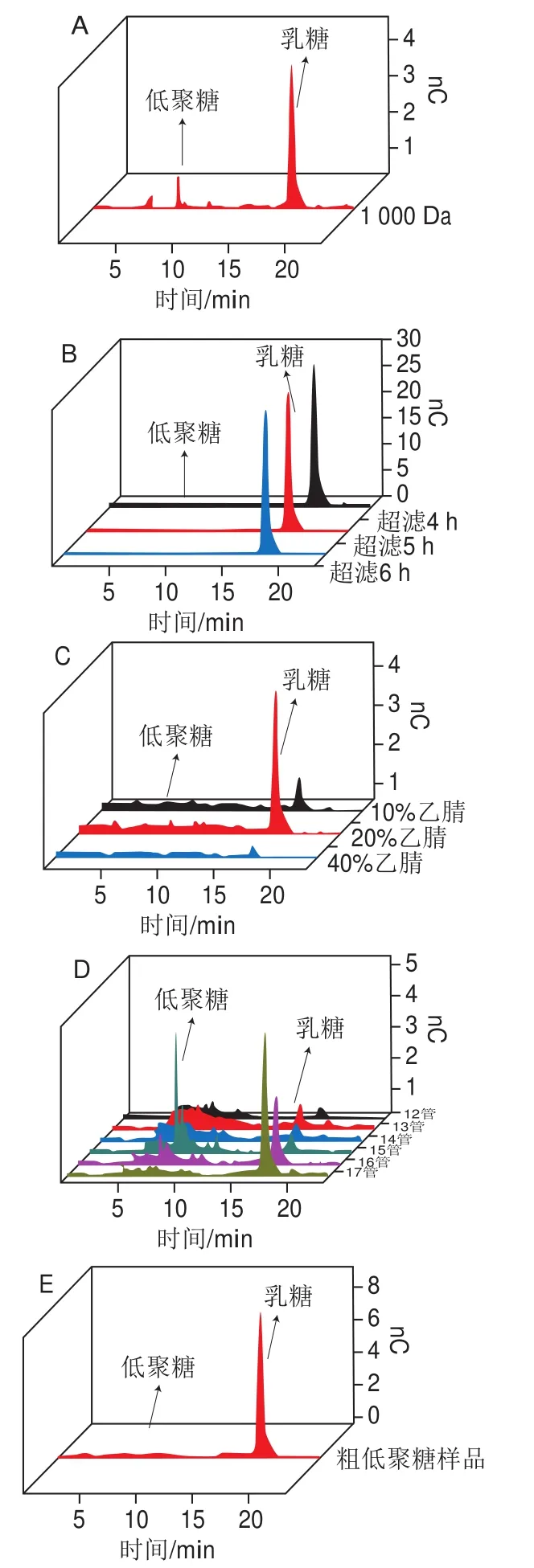
图1 通过透析(A)、超滤膜包(B)、Sep-Pak C18和石墨化碳柱(C)、葡聚糖凝胶层析(D)和未除乳糖的低聚糖粗样品(E)乳糖和低聚糖的含量变化Fig. 1 Contents of lactose and oligosaccharides in purified extracts by dialysis (A), ultrafiltration membrane package (B), sequential Sep-Pak C18 and graphitized column chromatography (C) and Sephadex chromatography (D), and crude extract samples (E)
由表2可知,透析法乳糖去除率最高,达到99.5%,但是由图1A可知,乳糖峰面积远大于低聚糖峰面积,因此乳糖含量远大于低聚糖含量(乳糖的出峰时间在18.10 min左右,低聚糖的出峰时间在5~15 min左右(图1B))。这可能是由于透析的过程中,小分子质量的低聚糖随乳糖透析出去,从而使低聚糖含量降底。
对于超滤膜包法,超滤时间分别为4、5 h和6 h时乳糖去除率分别为34.8%、36.2%、38.4%。3 个不同的时间段,乳糖去除率均比较低。结合图1B可知,离子色谱峰中仅可以看到乳糖峰,可能低聚糖含量较低,被乳糖峰覆盖,所以超滤膜包法分离效果较差。
通过Sep-Pak C18和石墨化碳柱法,采用40%乙腈溶液冲洗的洗脱液乳糖去除率较高,达到98.9%。10%乙腈溶液、20%乙腈溶液冲洗的洗脱液乳糖去除率分别为96.4%、84.1%,结合图1C可知,此方法获得的低聚糖峰较小,可能因为大部分低聚糖留在柱子未随过柱液体流出。所以此方法不适合低聚糖分离。
而葡聚糖凝胶层析法乳糖去除率(12~17管收集液混合)高达98.7%,由图1D可知,低聚糖峰较为明显且个数较多,一方面说明乳糖大部分被分离,仅有小部分乳糖残留在低聚糖溶液中。另一方面说明低聚糖损耗较少,大部分低聚糖被洗脱下来。根据低聚糖分子质量大小,大分子低聚糖先被洗脱,小分子质量低聚糖后被洗脱下来,由于乳糖为二糖,因此,乳糖最后被洗脱下来。在图1D中,随着洗脱时间的延长,乳糖含量渐渐增加,当收集到17管时,乳糖含量骤增,在图中看不到低聚糖的峰,由苯酚-硫酸法测定糖含量(收集液100 μL,苯酚100 μL,浓硫酸500 μL),在12管时出现颜色变化,说明在12管时有低聚糖被洗脱下来,因此洗脱液收集12~17管。使用葡聚糖凝胶层析分离乳糖较为理想,因此葡聚糖凝胶层析的洗脱液用于后续超高效液相色谱-Q-Exactive Focus质谱仪分析。
2.3 超高效液相色谱条件的确定
对羊乳寡糖进行超高效液相色谱条件的优化,根据本实验室以前的研究基础,初次设定流动相的洗脱条件为:梯度洗脱,0~18 min,95%~68% A;18~30 min,68%~62% A;30~38 min,62%~50% A。如图2A所示,18~22 min之间的峰并没有分开。为了更直观地观察研究液相色谱条件优化,选取其中的一个低聚糖作为优化对象。Hex2Neu5Ac1-1和Hex2Neu5Ac1-2异构体在正负离子模式下并没有分开(图3A)。参照高效液相色谱分离的原则和XBridge氨基柱的特点进行后续的超高效液相色谱条件的优化,梯度洗脱条件为:0~18 min,95%~74% A;18~30 min,74%~69% A;30~38 min,69%~62% A;38~45 min,62%~50% A。优化结果见图2B,总离子图谱中保留时间在20~27 min之间的峰没被分开,但可以看出其他保留时间的峰被明显分开,Hex2Neu5Ac1-1和Hex2Neu5Ac1-2异构体在正负离子模式下,2 个峰相交的面积明显减少(图3B1),说明优化效果显著。因此,继续进行高效液相色谱条件优化,优化的结果见图2C,总离子流图中的峰在所有保留时间基本被分开,Hex2Neu5Ac1-1和Hex2Neu5Ac1-2异构体明显被分开,且效果较好(图3C)。最终梯度洗脱条件为:0~20 min,95%~78% A;20~35 min,78%~73% A;35~38 min,73%~62% A;38~45 min,62%~50% A。

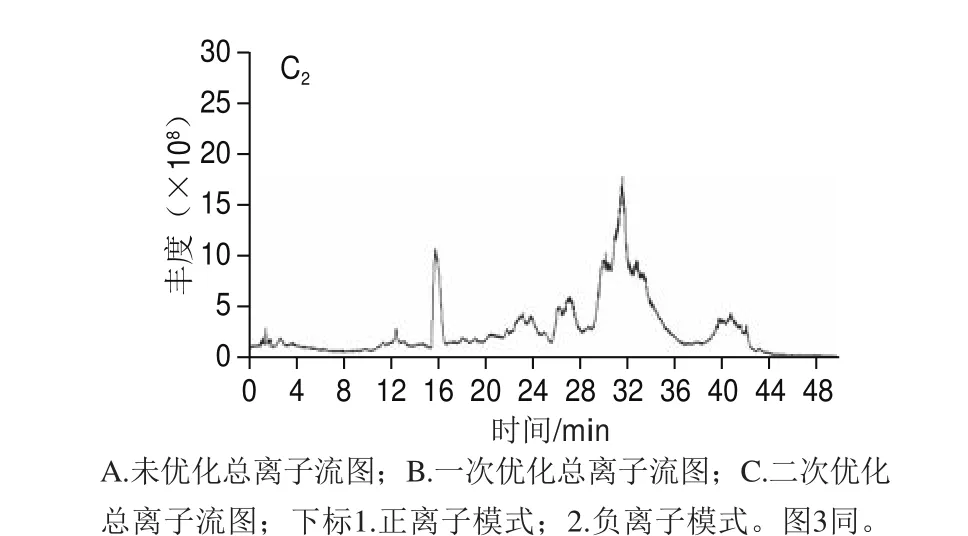
图2 羊乳中低聚糖的总离子流图Fig. 2 TIC chromatograms of goat milk oligosaccharides under positive and negative ion modes
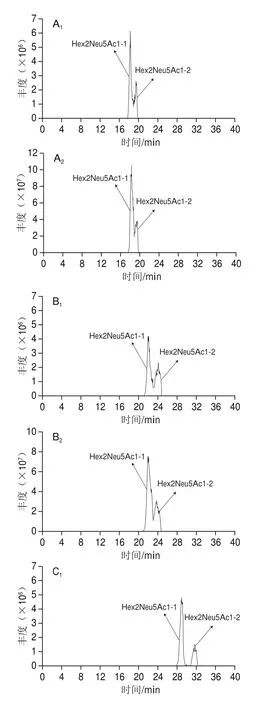
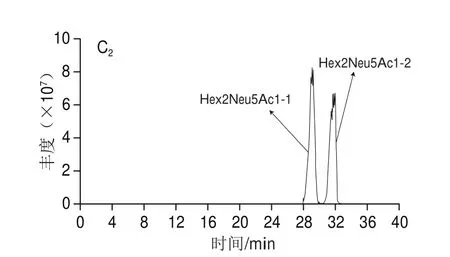
图3 羊乳中低聚糖Hex2Neu5Ac1的异构体总离子流图Fig. 3 TIC chromatograms of Hex2Neu5Ac1 isomers in goat milk under positive and negative ion modes
2.4 质谱分析
将羊乳低聚糖用优化好的流动相条件通过Q-Exactive Focus质谱仪进行测定。本实验在正负离子模式条件下同时进行,低聚糖的质量扫描范围为m/z300~2 000。正离子模式的电离方式有3 种:[M+Na]+、[M+H]+和[M+NH4]+,负离子模式的电离方式有1 种:[M-H]+。质量精度为10×10-6,构成羊乳低聚糖的单糖包括Glc、Gal、GlcNAc、Fuc、Neu5Ac和Neu5Gc,同时根据一级质谱的质荷比(m/z)可以筛选出低聚糖的单糖组成[22]。
每个样品设置3 个重复,丰度值取3 次的平均值,样品的重复性较好,在3 次重复实验中检测到低聚糖的个数相同,且丰度值相差不大,相对标准偏差在1%~10%的范围内,说明仪器的精密度与实验的重复性较好。
由表3可知,富集前低聚糖样品在正负离子条件下共鉴定出29 种,在正离子模式下鉴定出23 种低聚糖,而在负离子模式下鉴定出16 种低聚糖,2 种模式下同时鉴定出10 种低聚糖,由被检测的低聚糖个数可知,只有同时在正负离子模式下才能鉴定出更多的低聚糖种类。由表4可知,采用葡聚糖凝胶层析法富集后的低聚糖样品,共鉴定出62 种低聚糖,相比富集前样品多鉴定出33 种低聚糖。Martín-Ortiz等[28]研究表明,在正离子模式、低聚糖的电离方式为[M+Na]+条件下鉴定出49 种羊乳低聚糖。本实验方法大大提高了羊乳低聚糖鉴定的种类。富集前乳糖的丰度为14 342 113,富集后乳糖的丰度为666 062,乳糖的含量减少了95%,从而降低了乳糖在低聚糖鉴定过程的影响。富集前后丰度含量最高的低聚糖为Hex2Neu5Ac1,相似的结论出现在Martín-Ortiz等[28]在山羊初乳的研究中,鉴定出含量最高的低聚糖为Hex2Neu5Ac1。在表3和表4中分别鉴定出11 种和13 种同分异构体,这说明了优化的条件能较好地分离羊乳中的同分异构体,一方面证明了此实验优化了一种有效、通用的低聚糖分离的条件,另一方面为低聚糖同异构体的研究提供了理论的依据。
由于低聚糖的含量和电离差异性,富集前后鉴定出低聚糖种类并不完全相同,但在富集前后共鉴定出14 种结构相同的低聚糖。一方面,富集前鉴定出的低聚糖在富集后基本被鉴定出(22/29),另一方面,富集后比富集前多鉴定出33 种低聚糖,因此,葡聚糖凝胶层析法适用于羊乳中乳糖的分离。
富集前的低聚糖样品鉴定出3 种不同的岩藻糖dHex1Hex2、dHex1Hex3-1和dHex1Hex3-2,占鉴定出总糖比例的10.34%,而富集后的低聚糖样品鉴定出5 种不同的岩藻糖dHex1Hex3-1、dHex1Hex3-2、dHex1Hex6、dHex1Hex7和dHex1Hex7HexNAc1,占总糖比例的8.06%。Martín-Ortiz等[28]的研究也得出相似结果,采用纳流液相色谱-串联飞行时间质谱在羊乳的成熟乳中仅检测出4 种岩藻糖dHex1Hex3HexNAc1的同分异构体,占被检测出总糖的8.16%,而在山羊初乳中检测出3 种低聚糖dHex1Hex1HexNAc1、dHex1Hex3HexNAc1和dHex1Hex2,仅占被检测出总糖的3.85%[20,28]。原因可能是地域、天气、饮食、年龄、羊品种以及检测方法等差异性,使检测到的低聚糖的结构和种类有很大的区别。而在人乳低聚糖中含有较多比例的岩藻糖,其中大部分可以作为益生元和阻止细菌黏附肠上皮细胞的有效抑制剂[2,29]。在本实验中共检测到6 种不同的岩藻糖,存在羊奶中的这些岩藻型低聚糖是一种潜在提高肠道健康的功能性食品。

表3 富集前样品检测到的29 种羊乳低聚糖结构Table 3 Structural analysis of 29 milk oligosaccharides before enrichment

表4 富集后样品检测到的62 种羊乳低聚糖结构Table 4 Structural analysis of 62 milk oligosaccharides after enrichment
由表3和表4可知,富集前后酸性低聚糖分别占鉴定出总低聚糖的41.38%和58.07%,非岩藻型中性低聚糖分别占鉴定出总低聚糖的48.28%和33.87%。在Martín-Ortiz等[28]的研究中,在山羊乳中非岩藻型中性低聚糖为总糖的51.3%,酸性低聚糖为总糖的44.9%。在本研究中,Neu5Ac占酸性低聚糖的比例为66.67%。在前期研究中,报道了更高比例Neu5Ac的酸性低聚糖[30]。
3 结 论
本实验采用4 种前处理方法去除羊乳中的乳糖,由离子色谱图和乳糖的去除率可知,葡聚糖凝胶层析法可以有效去除乳糖并保留低聚糖。采用葡聚糖凝胶层析法在正负离子模式下鉴定出62 种低聚糖,相比富集前鉴定出的29 种低聚糖,多鉴定出33 种低聚糖,取得预期结果。液相色谱优化的最终条件为0~20 min,95%~78% A(乙腈);20~35 min,78%~73% A;35~38 min,73~62% A;38~45 min,62%~50% A。本实验脱除乳糖的方法简单可行、检测低聚糖方法精确,可用于羊乳低聚糖的分离和鉴定。
