典型离子对碳钢CO2腐蚀的影响
2019-09-02唐德志陈宏健解红军
谷 坛 唐德志 ,2 王 竹 陈宏健 解红军
1.中国石油天然气股份有限公司规划总院 2.北京市凌怡科技有限公司 3.北京科技大学新材料技术研究院
0 引言
在油气开采过程中,油气田管材要面临产出液侵蚀、流体冲刷、应力等因素的混合作用,其腐蚀失效已经成为制约油气开采的主要原因之一。通常认为影响碳钢腐蚀的因素主要有温度、流速、pH值、CO2分压和溶液成分等。目前已有大量的文献针对温度、流速、pH值、CO2分压等对腐蚀的影响机制进行了讨论,而针对典型离子对CO2环境下碳钢腐蚀作用的研究则相对较少[1-17]。
在实际油气田环境中,溶液介质中往往存在多种离子,其中以Cl-、HCO3-、SO42-、Na+、Ca2+等最为常见。目前的研究表明,Cl-可以直接参与到材料的阳极溶解过程,加速材料的阳极溶解;Cl-容易在点蚀坑内富集,促进Cl-催化机制的进行,加速点蚀坑内Fe基体的腐蚀,增加材料的点蚀风险[10,18-20]。唐娴等[21]发现含Cl-溶液中SO42-的加入能够使316L不锈钢钝化区变宽,使点蚀电位变正,维钝电流密度降低,进而提高316L的耐点蚀能力。但是在点蚀发生后,随着SO42-浓度的升高,点蚀内部和边缘形态表现出更为复杂的趋势,蚀坑的周长面积比明显增大。张春婉等[22]用动电位极化法和交流阻抗谱(Electrochemical Impedance Spectroscopy,EIS)研究了J55钢在不同浓度NaHCO3溶液中的腐蚀行为,发现随着NaHCO3含量的增加,阳极极化曲线上的钝化现象越来越明显,EIS中容抗弧的半径也逐渐增大,说明材料抗均匀腐蚀的能力增强,均匀腐蚀速率减小。周永璋等[23]采用动电位极化法、扫描电镜(Scanning Electron Microscope,SEM)和 X 射线衍射(X-ray Diffraction,XRD)等方法,研究了Q235钢在不同介质环境下的腐蚀机理,结果表明中Cl-、SO42-对腐蚀速率影响较大,而HCO3-、Ca2+影响较小;随着Cl-、SO42-浓度的增大实验钢的腐蚀速率增大,随着HCO3-浓度的增大,实验钢的腐蚀速率先增大后减小,Ca2+能够导致碳钢腐蚀速率降低。从以上的分析可以看出,目前针对油气田典型离子对碳钢腐蚀行为的影响并未得出统一的认识,特别是CO2环境下油气田典型离子对碳钢腐蚀影响的认识更加缺乏。笔者主要通过失重法,同时结合极化曲线、EIS、XRD以及pH值分析,研究了Cl-、SO42-、Ca2+、HCO3-等几种油气田典型离子对碳钢在CO2环境下腐蚀行为的影响,以期为石油化工等行业的防腐工作提供帮助。
1 实验
1.1 实验材料
实验材料为油气开采过程中广泛使用的N80钢。实验用N80钢取自油田现场,其化学组成如表1所示。
1.2 实验溶液
实验溶液为 0.25 mol/L 的 NaCl、Na2SO4、CaCl2及NaHCO3溶液。配制溶液时,使用蒸馏水或去离子水和符合国家标准或行业标准中的分析纯级别的试剂。配制好的溶液在使用前每升溶液要用流速为100 mL/min的高纯CO2进行除氧处理,处理时间不少于12 h,然后密封待用。
1.3 电化学测试
电化学测试采用三电极体系,参比电极为Ag/AgCl电极(KCl填充液浓度为 0.1 mol/L),辅助电极为铂电极,工作电极为N80钢,电化学试样工作面的面积为1 cm2。实验前,将电化学试样用水磨砂纸逐级打磨至1200号,然后用丙酮除油,用去离子水清洗,用无水乙醇脱水,之后冷风吹干待用。
电极安装完毕后,将除氧后的实验溶液转移至电化学池中,继续通入CO2气体以去除转移过程中混入的氧,待除氧完毕溶液升温至60 ℃、气压稳定在0.5 MPa后开始进行电化学测试。首先进行开路电位测量,待开路电位稳定(波动范围稳定在±10 mV 以内)后进行EIS测试,测试的频率范围为100 kHz ~ 10 mHz,采用的扰动信号是幅值为 5 mV 的正弦波。之后进行动电位极化曲线测试,测试电位范围为350~400 mV,扫描速率为0.5 mV/s。测试完成后,采用ZSIMPWIN软件对EIS测试结果进行拟合分析。
1.4 腐蚀模拟实验
为分析饱和CO2环境下不同离子对N80腐蚀速率的影响,设计了腐蚀模拟实验,用于表征离子对腐蚀速率和腐蚀产物的作用。实验试样尺寸为20 mm× 20 mm × 3 mm,每组实验至少取 4 个平行试样。实验前将试样用水磨砂纸逐级打磨至2000号,然后依次用丙酮除油,去离子水和无水乙醇清洗,冷风吹干。将准备好的试样、溶液置于反应釜中,用CO2气体除氧并饱和后,设定目标温度为60 ℃。达到实验条件后开始计时,维持 168 h后实验结束。

表 1 实验用 N80 钢的化学组成表 1)
待实验结束后取出试样,用去离子水清洗,酒精脱水,冷风吹干。利用XRD进行腐蚀产物分析。根据ISO 8407:2009[24]推荐的方法将腐蚀产物膜去除,用失重法测量平行试样的平均腐蚀速率。
2 结果与讨论
2.1 失重法及极化测试
图1显示了60 ℃下,N80钢在含不同离子的CO2饱和溶液中浸泡168 h后测得的平均腐蚀速率。从图1可以看出,CO2饱和的NaCl溶液中N80钢试样腐蚀速率为5.5 mm/a,Na2SO4溶液环境下N80钢的腐蚀速率略有下降,在CaCl2溶液中腐蚀速率降低至4.3 mm/a,在NaHCO3溶液中腐蚀速率降低至1.4 mm/a。图2为60 ℃下N80钢在含不同离子的CO2饱和溶液中浸泡168 h后腐蚀产物的XRD图谱。由图2可知,不同离子条件下形成的腐蚀产物成分基本相同,均为FeCO3,这说明实验中添加的不同离子不会影响腐蚀产物的物相成分。
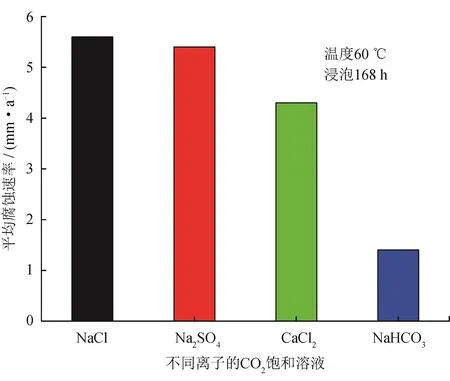
图1 N80钢在含不同离子的CO2饱和溶液中的平均腐蚀速率图

图2 N80钢在含不同离子的CO2饱和溶液中的腐蚀产物XRD图谱

图3 N80钢在含不同离子的CO2溶液中测得的极化曲线图
图3 为60 ℃、0.5 MPa压力下N80钢在含不同离子的CO2溶液中测得的极化曲线。由图3可知,N80钢在NaCl环境中的极化曲线与在Na2SO4环境中的极化曲线基本重合,说明两种环境下N80的腐蚀速率基本相同,这与失重法得到的结论一致。在CaCl2或者NaHCO3溶液中,极化曲线左移,腐蚀电流密度降低,说明此时材料的耐蚀能力增强。同时可以看出,在Na2SO4和CaCl2溶液中N80钢极化曲线阳极区及阴极区斜率几乎未发生变化,仍然呈现以阴极控制为主的反应过程;在NaHCO3溶液中N80钢极化曲线阳极部分斜率明显增大,阳极电流密度降低,这表明在NaHCO3溶液中材料的阳极反应同样受到抑制,这与文献中的结论一致。Wang等[25]发现Ca2+可以降低腐蚀产物膜的孔隙率,从而降低材料的腐蚀速率。王海等[26]、张军等[27]发现随着HCO3-浓度增大,碳钢的阳极极化曲线斜率增大,高于某一临界值时可以发生钝化现象;Xu等[28]认为在0.5 mol/L的 HCO3-溶液中碳钢表面可以直接形成一层致密的产物膜导致其腐蚀速率得到明显控制。上述文献结果均表明HCO3-对于CO2腐蚀具有较为明显的抑制作用,其原因在于能够提高腐蚀产物膜的致密性和保护性。
2.2 溶质离子对溶液pH值的影响分析
为分析不同溶液中pH值的情况,利用水化学分析软件计算实验环境下不同离子添加量时溶液pH值的变化,其结果如图4所示。从图4可以看出,相同的CO2饱和溶液,添加4种盐后,溶液pH值表现出不同的变化趋势。其中,添加NaCl溶液的pH值持续降低,在离子浓度为3.24 mol/kg时,pH=3.38,相比离子浓度为0 mol/kg(曲线起点)位置,降低了0.3。添加Na2SO4溶液的pH值在很小的添加量时,升高到4.1左右,但随着添加量的增加,pH值达到稳定区。添加CaCl2溶液的pH值在初期随着CaCl2的增多而降低,当离子浓度为4.07 mol/kg时,pH值增大,当离子浓度继续增大,pH值再次下降。添加NaHCO3的溶液,在很小的添加量下,pH值即迅速升高,随着添加量增大,pH值的增加趋势变缓,在离子浓度为1.56 mol/kg(曲线终点)时,pH=7.26,达到计算范围内的最大值。

图4 不同离子浓度的CO2溶液pH值图
为了验证计算结果的可信度,进行了实验室pH值实测实验。实验溶液中,加入对应的离子后,实测得到NaCl、Na2SO4、CaCl2以及NaHCO3溶液的pH值分别为3.62、4.05、3.58和6.50,这与软件计算得到的结果基本相同。
加入CaCl2后,溶液pH值与NaCl溶液基本相同,这说明Ca2+对腐蚀的抑制作用并非通过改变溶液pH值。加入Na2SO4和NaHCO3后溶液pH值上升,然而由于Na2SO4溶液的pH值相对于NaCl变化不大,所以两种溶液环境下腐蚀速率差别不大;而NaHCO3溶液的pH值显著高于其他3种溶液,这可能是导致材料在该介质环境下体现出低腐蚀速率的原因之一。
2.3 交流阻抗谱分析
图5为60 ℃、0.5 MPa压力下,N80钢在不同离子的CO2溶液中测得的EIS图谱。由图5可知,在饱和CO2环境下,NaCl溶液中阻抗弧半径最小,呈现高频容抗、中低频感抗和低频容抗弧。高频容抗弧通常认为与腐蚀产物膜有关,感抗弧与基体表面的吸附过程相关[7],低频容抗弧与双电层的电荷传递过程有关。CaCl2溶液中,高频容抗弧半径增大,感抗弧半径减小,这可能是因为加入Ca2+后腐蚀产物变得致密,腐蚀产物膜保护性增强导致。NaHCO3溶液中,容抗弧半径增大,同时中低频的感抗弧消失,这可能是因为在NaHCO3介质中N80的腐蚀产物膜致密性显著提升。以下将对EIS图谱中的高频容抗及中低频感抗弧变化进行分析讨论。

图5 N80钢在不同离子的CO2溶液中测得的EIS图谱
N80钢在CO2环境中的阳极过程主要为Fe的溶解反应:

设腐蚀产物覆盖度为θ,则上述反应速率分别为:

式中I1表示式(1)的电流密度,A/m2;F表示法拉第常数,96 500 C/mol;k1表示式(1)的平衡常数,无量纲;α1表示式(1)的电子传递系数,无量纲;E表示极化电位,V;R表示气体常数,8.314 J/(mol·K);T表示环境温度,K;I2表示式(2)的电流密度,A/m2;k2表示式(2)的平衡常数,无量纲;C1表示浓度,mol/L;α2表示式(2)的电子传递系数,无量纲;v3表示式(3)的反应速率,mol/(L·s);k3表示式(3)的平衡常数,无量纲。

式中t表示时间,s;K表示转换当量系数。对 进行对θ的二次求导,即:

说明体系满足稳定性条件。假设:

那么

阳极反应总的电流密度IF=I1+I2,假设:

那么

阴极反应为H+、H2CO3、HCO3-的还原过程,其中H+的放电过程为反应的控制步骤:

式中Hads表示原子态的H,设其吸附覆盖率为γ,上述反应速率为:

式中 I4表示式(15)的电流密度,A/m2;k4表示式(15)的平衡常数,无量纲;C2表示氢离子的浓度,mol/L;α4表示式(15)的电子传递系数,无量纲;v5表示式(16)的反应速率,mol/(L·s);k5表示式(16)的平衡常数,无量纲。
γ的变化速率(Ψ)为:

对Ψ进行对γ的二次求导,即

同样满足稳定性条件。假设:

总反应的法拉第电流为IF=I4,假设:
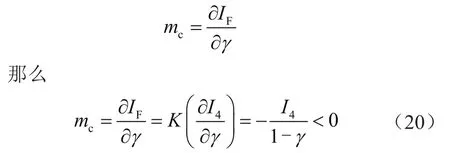
在NaCl、Na2SO4环境下,腐蚀产物疏松多孔,此时θ+γ<<1,可以认为阳极反应生成的腐蚀产物覆盖作用与吸附氢的覆盖作用互不干扰,因而交流阻抗中表现为容抗弧和感抗弧同时存在。CaCl2溶液中,由于Ca2+能够参与腐蚀产物的生成[25],从而有利于提高腐蚀产物的保护性,因此此时容抗弧减小;CaCl或者NaHCO溶液中,由于此时溶液中23浓度增大,腐蚀产物的沉积过程更易进行,试样表面更容易被腐蚀产物完整覆盖,此时Hads的吸附覆盖率几乎为零,因而此时感抗弧消失。
3 结论
1)在饱和CO2环境下,Cl-和溶液中N80钢的腐蚀速率基本相同,相比之下,在Ca2+和HCO3-溶液中材料的腐蚀速率更低。Ca2+主要通过降低腐蚀产物膜中的孔隙率从而抑制材料的腐蚀;HCO3-的加入一方面会显著提高溶液的pH值,导致环境腐蚀性降低,另一方面有助于提高腐蚀产物膜的完整性和保护性,因而在HCO3-溶液中N80的腐蚀速率最低。
2)在饱和CO2环境下,加入CaCl2后,溶液pH值与NaCl溶液基本相同,这说明Ca2+对腐蚀的抑制作用并非通过改变溶液pH值。Na2SO4溶液的pH值相对于NaCl变化不大,NaHCO3的溶液pH值最高。
3)在饱和CO2环境下,NaCl、Na2SO4和CaCl2溶液中的交流阻抗谱均由高频容抗弧、中低频感抗弧和低频容抗弧组成,其中高频容抗弧与腐蚀产物覆盖有关,感抗弧的出现与H+的吸附过程有关。由于HCO3-溶液中更易形成FeCO3沉淀,这使得此溶液环境下腐蚀产物覆盖完整,因而测试得到的交流阻抗谱中感抗弧消失。
