日本高松冢古坟微生物病害及其防治研究概述
2019-08-08武发思朱非清汪万福段育龙冯虎元
武发思, 朱非清, 汪万福,, 段育龙, 田 恬, 冯虎元
(1. 国家古代壁画与土遗址保护工程技术研究中心(敦煌研究院),甘肃酒泉 736200; 2. 细胞活动与逆境适应教育部重点实验室(兰州大学),甘肃兰州 730000; 3. 古代壁画保护国家文物局重点科研基地(敦煌研究院),甘肃酒泉 736200; 4. 甘肃莫高窟文化遗产保护设计咨询有限公司,甘肃酒泉 736200; 5. 甘肃省极端环境微生物资源与工程重点实验室(中国科学院西北生态环境资源研究院),甘肃兰州 730000)
0 引 言
高松冢古坟位于日本奈良县奈良盆地南部的高市郡明日香村(国营飞鸟历史公园内),该地区地处纪伊半岛中央、近畿地区中南部,区内多山,属温带季风性气候。1970年9月因在此地修筑道路,奈良考古研究所开展紧急文物调查时发现了古坟[1-2]。古坟建造于飞鸟时代末期(藤原京时期694年—710年,相当于我国盛唐时期),周边有钦明陵、天武·持统陵、文武陵等。古坟呈馒头形,底部直径约18 m,高约5 m,系版筑夯土。古坟自发现便开展了一系列研究和原址保护工作,遗憾的是最终解体搬迁异地保护(图1)。

图1 高松冢古坟丘部全貌Fig.1 View of the whole Takamatsuzuka Tumulus before and after dismantlement
1972年3月21日,开启石室后发现珍贵壁画。石室系横穴式石椁,由凝灰岩石块堆砌而成,内部南北纵深26.55 cm,东西横宽104.5 cm,上下高113.4 cm。石室内壁画绘制于灰泥层上,数厘米厚,其艺术风格与陪葬于唐高宗乾陵的永泰公主墓壁画相似,画面由飞鸟美人图、星宿图以及四神图等内容组成(图2)。壁画色彩富丽,线条精致,与之前在日本熊本、大分、福冈等地发现的粗犷简约的壁画不同,为二战后日本考古界最大发现,为研究唐代中日文化交流提供了重要资料[3-4]。日本政府在石室开启后随即成立了“高松冢古坟应急保护对策委员会”,对其进行科学调查和学术研讨。1973年4月,高松冢古坟被认定为日本特别史迹,1974年被日本文化厅认定为国宝。发掘初至20世纪90年代,石室壁画虽出现过微生物问题,但最终得以控制;墓室微环境相对稳定,壁画保存较好。2000年后,由于接合部顶部的加固施工、控制温湿度的设备老化及施工事故等,石室微生态平衡发生不可逆的破坏,霉菌大量增殖、爆发,最终不得不放弃原址保护,并于2005年6月决定解体搬迁[2,5]。

图2 高松冢古坟内壁画Fig.2 Wall painting images named Asuka Beauty and Gragon of Takamatsuzuka Tumulus
微生物病害是影响高松冢古坟壁画保存最主要的原因之一,自发掘至解体搬迁的30多年间,针对石室壁画保护、生态环境治理及恢复等方面进行了一系列研究和工程实践,积累了宝贵经验也汲取了惨痛教训。本工作以高松冢古坟微生物病害调查和防治研究为例,总结分析古坟壁画微生物群落组成、演替以及防治措施实施效果,以期为墓葬壁画的原址保护提供参考和借鉴。
1 高松冢古坟保护历程回顾
高松冢古坟曾在公元12或13世纪遭过盗掘。考古人员1972年从原盗洞向里挖掘发现壁画后,日本文化厅随即邀请法国和意大利的专家对古坟的保护方案和修复方法进行了探讨研究,最终决定原址保护。维持石室内温度、湿度相对稳定成为重点工作,在古坟石室前相继建立了前室A、前室B、准备室和机械室,并将盗洞口作为石室的出入口(图3)。为恢复和维持石室考古发掘前的原始环境条件,1974—1976年在石室南侧增设了温度、湿度控制设备。
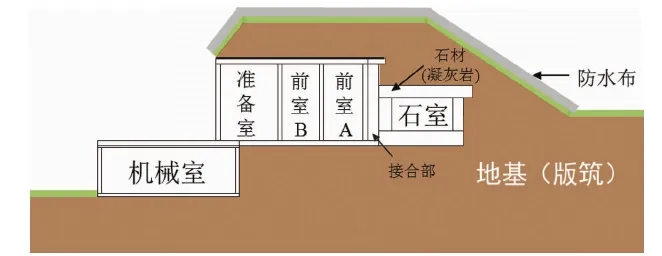
图3 设置保存设施后的高松冢古坟结构图Fig.3 Structure diagram of Takamatsu Tumulus after installation of preservation facilities
高松冢古坟的微生物病害历经多个阶段(表1)。20世纪80年代初,石室内爆发了霉菌病害,经杀菌剂处理和环境干预措施后,至21世纪石室内微环境基本稳定,霉菌蔓延得到控制,高松冢古坟成为该时期墓葬壁画原址保护的国际典范。然而,2001年接合部土体崩落,随即使用树脂实施加固工程,而树脂是一种极易受微生物侵蚀的高分子材料,此次修复成为霉菌再次爆发的重要原因之一;2005年日本文化厅决定放弃原址保护,实施冷却措施将石室降至恒温10 ℃,为石室解体搬迁作准备;2007年7月为控制古坟温度的隔热覆屋完成,同年8月21日石室壁画解体搬迁完毕,进行异地保护修复至今[2,6-9]。

表1 高松冢古坟生物病害档案记录[2,5]Table 1 Biodeterioration records of Takamatsuzuka Tumulus
2 石室内病害微生物群落特征及其侵蚀机理
2.1 真菌
针对高松冢古坟真菌病害开展了大量研究。古坟石室开启后,石室内温度、湿度及含氧量等发生改变,原有的微环境平衡被打破,出现了黑色和绿色的菌斑,其中黑色菌斑以真菌为主,包括链格孢属(Alternaria)、枝孢属(Cladosporium)和黑孢属(Nigrospora);绿色菌斑为绿色木霉(Tricodermaviride)。基于灭菌棉签采集样品经培养鉴定的真菌分属于矛束孢属(Doratomyces)、镰刀菌属(Fusarium)、枝孢属、毛霉属(Mucor)、木霉属(Trichoderma)、青霉属(Penicillium)等[10-12]。1976年,在古坟前室分离到镰刀菌属、木霉属、轮枝菌属(Vertillium)、青霉属和枝孢属菌株;同年温湿度控制设施建设完成,开始石室壁画修复,人为干预改变了石室内微环境。
1980年,在加固壁画时,使用了丙烯酸乳液及防止颜料层剥落的薄纸后,出现大量白色和灰色菌斑,矛束孢属激增。1981年,石室壁画彩色画面外长满了白色颗粒状菌落。1982年后,因使用杀菌剂并实施石室内环境控制,菌落减少。1985年至21世纪初,霉菌活动不明显,形成新的微环境平衡。其中,1986年研究发现石室壁画上原有的优势菌种Dratomycessp.消失[5,7,10]。1994—2000年,石室内无明显菌落,但入口处塑料盖板上每年都会出现直径为数毫米的白色霉斑,经鉴定为青霉属、曲霉属(Aspergillus)、镰刀菌属和木霉属,成为石室内优势菌[8,13]。这一时期石室内生态环境保持了最理想的“平衡状态”。
2001年后这种平衡被再次打破。受封土堆上植物根系影响,雨水渗入接合部,土体开始崩落,工程人员紧急开展加固修复工作。加固接合部崩塌土体时使用了环氧树脂(AER-2400)、硅酸盐树脂(OH100,Site SX)等有机材料,加固部位随后出现了青霉属、曲霉属和镰刀菌属等微生物,并波及到壁画。2001年12月研究发现,在接合部出现青霉属、曲霉属、木霉属和柱孢属(暗色)等真菌;石室壁画表面发现柱孢属(暗色系)、青霉属、曲霉属(暗色)、枝顶孢属(Acremonium)、镰刀菌属(褐色)和木霉属,在此之前并没有检测到枝孢属或其他不明真菌。修复中发现,褐色霉菌表面的绵状菌丝去除后,壁面上还是会有色素沉积,黑色霉菌的假根侵入壁画,难以物理清除。
2004年,调查中首次发现凝胶状生物膜[5,7,10],同年在壁画上采集的黑色斑点样本于2011年被确定为主要由枝顶孢属中Acremoniummasseei和Acremoniummurorum组成[14]。2005年,基于28S rRNA序列的系统发生关系分析,鉴定出来源于古坟的多种真菌,分属于镰刀菌属、木霉属和青霉属;其中镰刀菌24种,多为腐皮镰刀菌(Fusariumsolani),少部分为尖孢镰刀菌(F.oxysporum)或燕麦镰刀菌(F.avenaceum)和三线镰刀菌(F.tricinctum)复合体[15]。2006年确定生物膜为真菌和细菌混生体,同年5月在壁画表面发现暗色系的枝顶孢属菌株,其最适生长温度为25 ℃,在10 ℃仍可生长并产生孢子[9]。在拉斯科洞穴中出现的藻类生物膜是导致微生物病害爆发的主要诱因,而高松冢古坟生物膜的构成以真菌和细菌为主[16]。
2007年,石室解体前使用了封固壁画颜料层的羟丙基纤维素(HPC)和甲基纤维素(MC),抗菌性研究发现甲基纤维素抗菌性较弱[17-18]。2009年,基于18S rDNA序列的DGGE和克隆文库分析,从石室石材接缝和坟丘样品中鉴定出子囊菌门、担子菌门、接合菌门和壶菌门真菌。子囊菌门的散囊菌目(Eurotiales)、肉座菌目(Hypocreales)、刺盾炱目(Chaetothyriales)、柔膜菌目(Helotiales)和酵母菌目(Saccharomycetales)占很高比例,与分离培养法得到的结果一致[19]。散囊菌目和肉座菌目在高松冢其他位置样品中亦有较高比例,刺盾炱目只在石室内及附近发现,酵母菌目在石室内比例高。
2010年,通过对2004年5月至2009年2月从石室内及周边约300个样品中分离出真菌1 400余株。鉴定出青霉属菌株(Penicilliumpaneum)为石室内优势病害菌之一;从2005年坟丘部冷却以来,随着石室内温度下降,优势菌木霉属和镰刀菌属被枝顶孢属所代替。2004至2010年,源自于高松冢426个菌株,经鉴定主要为无性型真菌(Anamorphic)、青霉属、木霉属和镰刀菌属,石室西壁飞鸟美人附近黑色污染为暗色系枝顶孢属菌种(sect.Gliomastixsp.);生物膜内主要为假丝酵母属(Candida)和毕赤酵母属(Pichia)酵母[19-21]。
从高松冢古坟分离出的菌株中,霉菌Fusariumsp.,酵母Pichiamembranifaciens,细菌Ochrobactrumsp.存在生成大量乙酸的潜质,导致周围pH值下降,其中P.membranifaciens引起pH值下降最快,这与壁画的腐蚀劣化有很大关系;当使用单一碳源乙醇时,乙酸的生成量会增加,常被用作杀菌剂的乙醇在稀释到1%浓度时会成为微生物的营养源,基于有机药剂的微生物防治存在很大风险[22]。
2012年,从石室壁画表面生物膜、植物根系及结合部土壤和石材间隙中分离出8株鬃毛状的真菌,被鉴定为Kendrickiellaphycomyce,石室灰泥层和石材成为这类真菌的培养基。利用GYC琼脂培养基研究该菌种的理化特性发现,该菌种可溶解褐色颜料和碳酸钙,造成生物侵蚀[23]。最新研究发现了另一种造成石室灰泥层生物侵蚀的真菌,经鉴定为Sagenomellastriatispora[24]。
另外,从石室土壤和白色菌落中分离出两种无叶绿素微藻,经鉴定为非光合作用的原壁菌属Protothecatumulicolasp.nov.,为微藻类新种[25]。
2018年最新研究发现了Cladophialophora属的两株菌株,退化的灰泥层和石墙是其适宜生长的营养源和栖息地,这类真菌对石室生物退化有潜在危险[26]。
2.2 细菌
高松冢古坟发现的主要细菌有放线菌属(Actinomycetes)、链霉菌属(Streptomyces)、芽孢杆菌属(Bacillus)、苍白杆菌属(Ochrobactrum)和嗜麦芽窄食单胞菌属(Stenotrophomonas),其中嗜麦芽窄食单胞菌是壁画上黑色斑点和生物膜内主要菌种之一[27-29]。近年来又发现了一些新菌种,如在古坟搬迁时采集的样本中发现了葡糖醋杆菌属(Gluconacetobacter),在壁画表面发现了Bordetellamuralis,其可能普遍存在于土壤或水中[30-31];在白虎画面上采集的样品中分离出一种革兰氏阴性的厌氧菌,经分子鉴定为原小单孢菌科(Promicromonosporaceae)的Krasilnikoviellamuralisgen.nov.,sp.nov.[29,32];及从石室分离出的放线菌门微杆菌属菌种Microbacteriumtumbaesp.nov.[33]。高松冢古坟中的主要菌群为芽孢杆菌属和苍白杆菌属,从芽孢杆菌属分离出的菌株中B.toyonensis以及B.simplex会生成溶解壁画灰泥层中碳酸钙的有机酸(主要为乙酸),但其可在用于壁画修复的高分子材料上、含有用于杀菌的乙醇或异丙基酚等有机溶剂(1%浓度)的培养基上生长;苍白杆菌属分离菌株会形成黏稠的菌落,是构成石室内凝胶状生物膜的主要菌群;这些微生物对灰泥层和修复材料的退化有很大关系[34]。研究表明,古坟内细菌丰度较低,不是造成微生物病害的主要因素。
2.3 其他生物
2002年10月,在石室内发现大量蜈蚣和蚂蚁等节肢动物,坟丘上的枯树及雨水下渗可能是其出现原因之一[7]。木川等(2004)研究了真菌与石室内发现的壁虱(节肢动物)之间的关系,确定壁虱会以霉菌为食获取营养后大量繁殖,壁虱活动的地方有孢子散落[5],加大了微生物病害爆发的风险。近年利用PCR-DGGE技术检测发现,墓室石材及壁画上也存在蓝藻和绿藻生物序列[12]。
3 防治措施及效果评价
3.1 抑菌剂筛选及应用
针对高松冢古坟不断改变的病害菌,曾使用了多种杀灭剂(表2)。1977年,首次在石室中放置多聚甲醛进行气化杀菌。1978年,使用福尔马林∶乙醇(1∶9)混合液处理霉菌,但石室内的多聚甲醛由于凝结水作用出现溶化和不完全气化状况,此阶段灭菌效果不明显,菌斑呈增长趋势[5]。1980年,试用福尔马林溶液、乙醇、噻苯唑(TBZ)和三氯乙烯去除霉菌,其中噻苯唑无灭菌效果。1986年,发现放线菌在福尔马林熏蒸时表现出抗性[7]。

表2 高松冢古坟的病害微生物防治情况[7-8,10]Table 2 Control records of microbial diseases of Takamatsuzuka Tumulus[7-8,10]
针对壁画霉菌,2001年使用了甲醛熏蒸法和乙醇(70%)喷洒杀灭。在接合部试用杀菌剂Coatside123进行杀菌。同年3月,接合部霉菌大肆爆发,又试用了Coatside159-乙醇制剂杀菌,9月开始监测接合部和古坟周围空气微生物,在确认其浓度足够低之后,再进行石室内微生物调查,利用Coatside123和Coatside159-乙醇制剂灭菌,其中 Coatside123与树脂(B-72)混合后使用。2001年,对多聚甲醛熏蒸法处理霉菌时气化后实际进入石室内浓度进行了定量分析,并对该方法进行重新讨论[7-8,10,35]。2004年对凝胶状生物膜进行多聚甲醛熏蒸和乙醇杀菌。2005年使用异丙基酚(Isopropylphenol)代替乙醇(70%)处理石室内生物膜[8,10]。
针对暗色系枝顶孢属真菌,2006年试用高浓度(99.5%)乙醇和3%的福尔马林,在对环境控制设备进行消毒时使用了苯扎氯铵,并使用异丙基酚、乙醇和福尔马林(3%)处理了黑色的生物膜[9]。在对杀菌剂效果评价中,发现乙醇比较有效,浓度在3%以上福尔马林有效;针对石室中优势青霉菌,乙醇比异丙醇有效,福尔马林仅在高浓度时有效。针对枝顶孢属真菌,3种抑菌剂均有效[11]。考虑到操作安全性,乙醇是最有效的灭菌剂。在解体搬迁前用5%DDAC(氯化二烷基二甲基铵)对所用的木材进行了约30周的处理,以减少污染石室壁画的微生物来源[36]。
在异地保存后,高松冢生物病害防治研究还在继续。在2010年筛选针对石室周边、霉菌的杀灭剂时发现,乙醇不会驯化任何霉菌而产生抗药性,异丙基酚(IPA)也没有驯化作用,多聚甲醛(PFA)的效果很不稳定,对一部分霉菌有驯化倾向,噻苯唑长期使用有驯化作用[37],表明乙醇和异丙基酚有助于控制石室内微生物滋生。
3.2 环境控制
微生物的生长繁殖通常会受到周围环境因素的影响。坟丘周围是以真砂土(花岗岩风化后形成)为主体的地基覆盖,石室地板下是凝灰岩粉末填筑的地基;在发掘的过程中发现坟丘内部有因地震造成的龟裂和地面开裂的迹象,成为虫类和雨水进入坟丘内的主要途径[38]。古坟发掘前石室内温度为(13.4±0.9)℃,年内浮动小。发掘后温度为(14.7±7.4)℃,年平均值上升了约1 ℃,年内波动变大。相对湿度在发掘前维持在近100%,发掘后8月、9月会下降至96.6%,5月、12月上升至99.3%。1979至2004年,室外平均气温上升了约1.2 ℃,石室内温度升高了2.9 ℃。影响石室温度上升的原因有全球气候变暖、机械室空调废热的排放及夏天高温期与室外的换气、每次进入石室检测期间的人为扰动等[39-41]。为此,在石室开启后不久,就设计并建设前室A、B以及准备室等缓冲设施[35]。在前室和准备室安装有温湿度控制、排除CO2气体以及循环无菌清洁空气的设备[7]。在一定时期内,这些设备在石室环境控制中发挥了重要作用。但后期出现的设备故障也成为微生物爆发的重要原因之一。在对高松冢水文地质的研究中,LI等建立了对高松冢地下环境水-热行为的3-D模拟预测,量化了墓室干-湿和冷凝过程,提出了维持本体和周边环境温度差异的稳定性,以保护墓室壁画[42];并研究了古坟壁画发掘前紧急保护措施的影响,表明水-热环境控制并未降低干-湿波动,而模拟分析显示表层覆土对于石室温湿度的保持最为有效[43]。
关于2000年后石室壁画霉菌大爆发的原因,有专家认为是坟丘上方附生植被改变造成的,建议铲除坟丘上的竹林和榉树林。2003年9~10月,清除了坟丘上部植被,并铺设防水布,这一举措虽然有效控制了坟丘部的浸水问题,但造成了石室内温度的上升[20,35]。2004年9月,清除了坟丘下方植被,并撤去防水布,架设覆屋(图4a)。在覆屋替换防水布后,石室温度逐渐下降,证明覆屋有遮蔽阳光和降低温度的效果[35,44]。
在未安装冷却管之前,石室温度曾达20 ℃,造成霉菌大量繁殖。2005年9月古坟的冷却管安装完毕并实施紧急冷却对策,石室温度控制在10 ℃,有效防止了壁画表面的干燥和结露,为之后石室解体工作做准备[7,44](图4b)。冷却管安装后一段时间,霉菌生长得到了抑制。2006年2月石室霉菌再次爆发[45],表明目前人为介入的手段很难控制石室内微生态环境。也有研究通过模拟实验计算分析发现,用一定厚度的土壤覆盖暴露的石室对于控制石室温度增加和内表面干燥效果较好[43]。

图4 高松冢古坟封土堆降温措施Fig.4 Cooling measures of covering house and cooling pipe at the outside heap of Takamatsuzuka Tumulus
3.3 其他干预措施
针对石室壁画上病害菌丝体,使用灭菌棉签和手术刀等工具进行机械清除。在石室解体搬迁后,将壁画保存于温度为21 ℃和相对湿度为55%的馆藏环境中,其中修复作业室位于周围有类似保温瓶构造的可调节温湿度的两层墙内,照明中使用了无紫外线的荧光灯[46]。因保存修复设施建于相对自然的环境中,从2008年3月开始定期对修复室空气微生物监测,并调查蜈蚣等动物入侵路线,严格实施温度、湿度管理,使用胶带封住修复作业室墙体和地板间接缝,以减少病害昆虫的入侵和伤害壁画[47]。高松冢壁画的维修工作目前开展的非常谨慎,近期研究表明,肽酶、溶菌酶和几丁质酶等可用于高松冢壁画微生物污染的清除[48]。借助新型的太赫兹成像技术,可精准诊断和定位壁画深层病害,为保护修复提供了重要依据[49]。
4 结 论
高松冢古坟石室开启后受到诸多外界因素影响,石室原有湿温度发生了剧烈变化,石室内微生态环境失衡。另外,地震活动导致结合部土体坍塌,加速了微生物污染。管理的不当、取样调查等人为扰动改变了石室内光照和营养贫乏的微生物环境,为微生物生长创造了适宜条件;有机保护材料和部分杀菌剂成为微生物新的营养源,微生物侵蚀成为古坟壁画安全保存的最大威胁。因原址保护能最大程度地保留古坟历史信息,相关研究人员为此不懈努力,古坟保护也曾成为国际上墓葬壁画原址保护的典范,但最终因持续恶化的微生物问题而不得不进行解体搬迁保护,留下了遗憾和对于文物保护的重新思考。
多年来高松冢古坟保护过程非常严格,但仍出现了诸多不可预料和不可逆转的问题,如全球气候变化、水分活动等因素的影响。截至目前,微生物病害防治仍是国际性难题。因此还需开展更为深入的研究;高松冢古坟保护带来诸多经验和教训,如采取人为干预措施时应更为严谨,在杀菌剂的选择和使用上要进行更多预试验,并从整个生态环境安全和平衡角度考虑防治措施是否得当。同时应改进微生物监测方法(如使用无菌机器人进入墓室采样),以减少人类在墓室内活动;并充分研究微生物群落动态演替和功能代谢特征,全面了解墓室及古墓葬周边生态环境,为制定可行的保护方案提供科学依据。文化遗产的生物退化问题普遍存在,人为介入的保护措施时效性通常有限,结合数字化技术的保护手段,在今后文物历史艺术信息的保存和展示中将发挥重要作用。
