miR-105靶向调控FUT4影响骨关节炎软骨细胞增殖和凋亡的研究
2019-07-22谢易魏杰龚泰芳
谢易 魏杰 龚泰芳
(十堰市太和医院骨科,湖北十堰442000)
骨关节炎(osteoarthritis,OA)是一种典型的与年龄相关的疾病,最常见于老年人[1]。其临床特征主要包括关节疼痛、压痛、肿胀及畸形,导致患者运动受限,严重危害老年人健康[2]。目前关于OA的发病机制尚不明确,但研究显示软骨细胞数量的减少以及软骨细胞外基质的降解引起软骨退变,是导致OA的潜在机制之一[3,4]。有研究指出,OA的严重程度与软骨细胞的凋亡数量密切相关[5],有效减少软骨细胞的凋亡对于OA的治疗和预防尤为重要。MicroRNA(miRNA)通过其靶基因 mRNA 3′非编码区(3′untranslated region,3′-UTR)在转录后调节靶基因,参与细胞增殖、凋亡、分化等多种生理过程[6]。研究显示miRNA参与维持软骨发育过程中的稳态及OA发病过程[7]。文献报道miR-105在OA患者来源的病理细胞中呈现低表达,而在正常细胞中高表达[8]。目前研究显示miR-105常见于各种癌症,并发挥抑癌作用[9,10],而在OA中的研究尚在探索中。miR-105是否参与OA的发病尚不清楚。因此,研究miR-105对从OA软骨中分离的软骨细胞增殖和凋亡的影响十分必要。岩藻糖基转移酶(fucosyltransferases,FUTs)是一种生物合成酶,参与机体信号转导、组织发育、炎症、癌症的进展和转移等多种生物过程[11]。有证据表明,FUTs控制类风湿性关节炎和幼年特发性关节炎的发展[12]。有文献称FUT4在OA病理细胞中的表达呈现较为显著的高表达[13],推测FUT4可能参与OA病理过程。本研究研究miR-105通过靶向结合FUT4对OA软骨细胞增殖和凋亡的影响及其作用机制,以期为治疗OA提供新的作用靶点和实验基础。
1 材料与方法
1.1 实验材料
无菌OA膝关节软骨组织样品(取自全膝关节置换手术患者,符合中华医学会骨科学分会OA诊断标准)和正常关节软骨组织样品(取自无OA或类风湿性关节炎的股骨、颈骨骨折全膝关节置换手术患者)置液氮中冷冻,-80℃储存备用。本研究经医院伦理委员会批准,所取样本的患者及家属均签署了知情同意书。
DMEM培养基和胰蛋白酶(美国Hyclone公司提供);青霉素钠和庆大霉素(上海生工工程有限公司提供);胎牛血清(杭州四季青生物材料有限公司提供);Lipofectamine 2000转染试剂、二甲基亚砜(dimethyl sulphoxide,DMSO)和Trizol提取试剂(美国Invitrogen公司提供);MTT、Annexin V-FITC凋亡检测试剂盒(日本TaKaRa公司提供);miR-105模拟物、miR-105模拟物对照、miR-105抑制剂、miR-105抑制剂对照及空质粒(广州锐博生物科技有限公司提供);M-MLV逆转录试剂盒及SYBR Premix Ex Taq检测试剂盒(大连宝生物工程有限公司提供);BCA蛋白浓度检测试剂盒(北京索莱宝科技有限公司提供);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)、ECL化学发光液、双荧光素酶报告基因检测试剂盒(碧云天生物技术研究所提供);SDS-PAGE(本实验室配制);FUT4小干扰RNA(small interfering RNA,siRNA)和siRNA对照(上海吉玛制药技术有限公司提供);FUT4互补脱氧核糖核酸(complementary DNA,cDNA)过表达载体(北京傲锐东源生物科技有限公司提供,有效性已由公司验证);FUT4抗体及二抗(美国Abcam公司提供);实验所用引物均由上海生工生物工程有限公司合成。
1.2 原代人关节软骨细胞分离和培养
参照唐新等[14]所述方法分离原代人软骨细胞,除去多余的结缔组织,切成约1 mm3切块,用含双抗(青霉素钠和庆大霉素)的PBS清洗数次,加入0.1%胰蛋白酶于37℃培养箱中消化30 min,然后用0.2%Ⅱ型胶原酶消化16 h,期间每5 h收集1次细胞。使用200目滤网进行分离,收集细胞以1000 rpm离心5 min,去上清,以含10%胎牛血清的DMEM培养基洗涤并重悬细胞。将细胞以1×105/ml密度接种于细胞培养瓶中,置于含有5%CO2饱和湿度的37℃恒温培养箱中培养。
1.3 Real-time PCR检测
采用Trizol法提取软骨细胞总RNA,采用MMLV逆转录试剂盒逆转录合成cDNA,实验SYBR Premix Ex Tap试剂盒进行荧光定量PCR扩增。以U6为内参计算miR-105相对表达水平,以GAPDH为内参计算FUT4相对表达水平,采用相对定量2-△△CT法计算细胞中miR-105和FUT4的相对表达水平。各引物的引物序列详见表1。

表1 各引物的引物序列
1.4 蛋白质免疫印迹(western blot,WB)检测
收集软骨细胞,提取细胞中总蛋白,采用BCA蛋白浓度检测试剂盒测定蛋白浓度,取等量蛋白行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),分离蛋白后采用半干法将蛋白转移至PVDF膜上,在5%牛血清白蛋白封闭1 h,加入FUT4一抗(1∶1000稀释),在4℃条件下孵育过夜,再加入二抗(1∶1500稀释),室温孵育2 h。采用电化学发光(electro chemi luminescence,ECL)液进行显影,在扫描仪中成像,以GAPDH灰度值为参照,分析FUT4蛋白相对表达水平。
1.5 软骨细胞转染和分组
将生长状态良好的OA软骨细胞接种于6孔板中,于37℃继续培养24 h,待细胞汇合度达50%~60%时进行转染,操作步骤参照Lipofectamine 2000转染试剂说明书进行。将转染miR-105模拟物的细胞记为miR-105 mimic组,转染miR-105模拟物对照的细胞记为NC-mimic组;转染miR-105抑制剂的细胞记为miR-105 inhibitor组,转染miR-105抑制剂对照的细胞记为NC inhibitor组;转染FUT4 cDNA过表达载体的细胞记为pc-FUT4组,转染FUT4 cDNA过表达载体对照的细胞记为pc-NC组;转染FUT4 siRNA的细胞记为si-FUT4组,转染空质粒的细胞记为si-NC组;共转染miR-105模拟物和FUT4 cDNA的细胞记为miR-105 mimic+pc-FUT4组,共转染miR-105模拟物和FUT4 cDNA对照的细胞记为miR-105 mimic+pc-NC组;共转染miR-105抑制剂和FUT4 siRNA的细胞记为miR-105 inhibitor+si-FUT4组,共转染miR-105抑制剂和FUT4 siRNA对照的细胞记为miR-105 inhibitor+si-NC组。
1.6 双荧光素酶报告基因实验
使用数据库TargetScan进行预测分析miR-105靶基因结合位点,结果发现miR-105和FUT4 3′-UTR存在靶向结合位点。扩增miR-105和FUT4 3′-UTR结合片段及突变序列,分别构建包含分别构建包含miR-105结合位点的FUT4 3′-UTR野生型质粒(FUT4 WT)和突变型质粒(FUT4 MUT)。取对数生长期的OA软骨细胞接种于96孔板中,接种密度为4×103/孔,待细胞汇合度达50%~60%时进行转染,操作步骤参照Lipofectamine 2000转染试剂说明书进行。共转染FUT4 WT与miR-105模拟物的细胞记为FUT4 WT+miR-105 mimic组,共转染FUT4 WT与miR-105模拟物对照的细胞记为FUT4 WT+NC mimic组;共转染FUT4 MUT与miR-105模拟物的细胞记为FUT4 MUT+miR-105 mimic组,共转染FUT4 MUT与miR-105模拟物对照的细胞记为FUT4 MUT+NC mimic组。转染24 h后,参照荧光素酶报告基因检测试剂盒说明书检测萤火虫荧光素酶荧光强度及海肾荧光素酶荧光强度,两者的比值表示荧光素酶相对活性。
1.7 MTT法检测细胞增殖能力
转染1~5 d后各组OA软骨细胞分别通过MTT法检测细胞增殖能力,在每孔细胞中加入50 μl MTT溶液,于37℃培养箱中继续培养4 h,然后每孔细胞中再加入200 μl DMSO,在酶标仪490 nm处测定每组细胞光密度值,以表示各组细胞增殖能力。
1.8 Annexin V/PI流式细胞术检测细胞凋亡率
转染后48 h的各组OA软骨细胞,以胰蛋白酶消化,PBS清洗,离心收集细胞,以结合缓冲液重悬细胞制成单细胞悬液,在细胞中依次加入5 μl Annexin VFITC和5 μl PI,避光孵育15 min后使用流式细胞仪检测,使用Cell Quest软件分析各组细胞凋亡率。
1.9 统计学方法
采用SPSS 21.0软件对实验数据进行统计学分析,以单因素方差分析比较多组间差异,以SNK-q检验比较两两组间差异,每组数据重复实验3次取均值,以P<0.05表示差异具有统计学意义。
2 结果
2.1 miR-105和FUT4在OA软骨细胞和正常软骨细胞中的表达情况
为研究miR-105和FUT4在OA软骨细胞中的作用,通过Real-time PCR检测人OA软骨细胞和人正常软骨细胞中miR-105和FUT4的表达水平,与正常软骨细胞相比较,OA软骨细胞中miR-105的表达量显著升高(图1A),FUT4 mRNA和蛋白的表达量显著下降(图1B、C),差异具有统计学意义(P<0.05)。Pearson相关性分析显示miR-105和FUT4的在骨关节炎软骨细胞和正常软骨细胞中的表达水平呈负相关(图1D)。
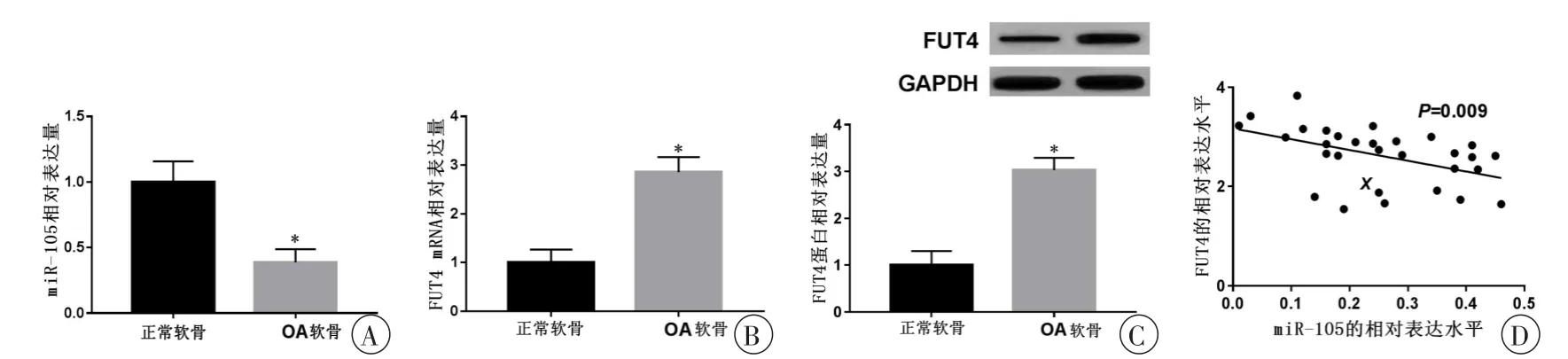
图1 人OA软骨细胞和人正常软骨细胞中miR-105和FUT4的表达水平
2.2 上调或下调miR-105对OA软骨细胞增殖和凋亡的影响
为研究miR-105对OA软骨细胞增殖和凋亡的影响,分别将miR-105模拟物及miR-105抑制剂转染到OA软骨细胞中,经Real-time PCR检测转染后miR-105的表达量显示转染miR-105模拟物后细胞中miR-105的表达量显著升高,转染miR-105抑制剂后细胞中miR-105的表达量显著降低,与各自对照组比较差异有统计学意义(P<0.05,图2A),提示转染miR-105模拟物或miR-105抑制剂能够上调或下调miR-105的表达。MTT法和Annexin V/PI流式细胞术分别检测转染后对细胞增殖和凋亡的影响,结果显示与NC mimic组比较,miR-105 mimic组细胞增殖能力显著升高,细胞凋亡率显著降低,差异具有统计学意义(P<0.05,图2B、C);与NC inhibitor组比较,miR-105 inhibitor组细胞增殖能力显著降低,细胞凋亡率显著升高,差异具有统计学意义(P<0.05,图2B、C),提示miR-105对OA软骨细胞具有促进增殖、抑制凋亡的作用。
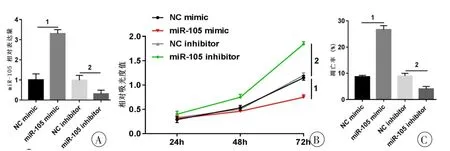
图2 转染后对OA软骨细胞增殖和凋亡的影响
2.3 FUT4是miR-105的靶基因
在线数据库TargetScan预测结果显示,FUT4 mRNA的3′UTR与miR-105核苷酸序列存在结合位点(图3A)。双荧光素酶报告基因检测结果显示,miR-105模拟物可显著降低含有FUT4 mRNA的3′UTR结合序列细胞的荧光素酶活性(P<0.05),而对含有FUT4 mRNA的3′UTR突变序列细胞的荧光素酶活性无显著影响(P>0.05)(图3B),表明miR-105可与FUT4 mRNA的3′UTR结合,提示FUT4是miR-105的靶基因。
2.4 miR-105靶向调控FUT4
为进一步验证miR-105与FUT4的靶向关系,本研究构建了共转染miR-105模拟物和FUT4 cDNA以及共转染miR-105抑制剂和FUT4 siRNA的OA软骨细胞,检测对FUT4表达的影响,与miR组相比较,miR+FUT4 cDNA组细胞中FUT4的表达升高,差异具有统计学意义(P<0.05,图4A);与anti-miR组相比较,anti-miR+FUT4 siRNA组细胞中FUT4的表达降低,差异具有统计学意义(P<0.05,图4B)。通过共转染能够回调由上调或下调miR-105对FUT4表达的影响。进一步验证了miR-105能够负向调控FUT4的表达。
2.5 miR-105通过靶向调控FUT4影响OA软骨细胞的增殖和凋亡
通过MTT法和Annexin V/PI流式细胞术检测共转染的OA软骨细胞增殖和凋亡的结果显示,与miR-105 mimic+pc-NC组相比,miR-105 mimic+pc-FUT4组细胞增殖能力升高,凋亡率降低,差异具有统计学意义(P<0.05,图5A、B),表明过表达FUT4部分逆转了上调miR-105表达对OA软骨细胞增殖和凋亡的影响;与miR-105 inhibitor+si-NC组相比,miR-105 inhibitor+si-FUT4组细胞增殖能力升高,凋亡率降低,差异具有统计学意义(P<0.05,图5C、D),表明下调FUT4部分逆转了下调miR-105表达对OA软骨细胞增殖和凋亡的影响。提示miR-105能够通过负向调控FUT4表达影响人OA软骨细胞的增殖和凋亡。

图3 miR-105与FUT4 mRNA的3’UTR靶向结合
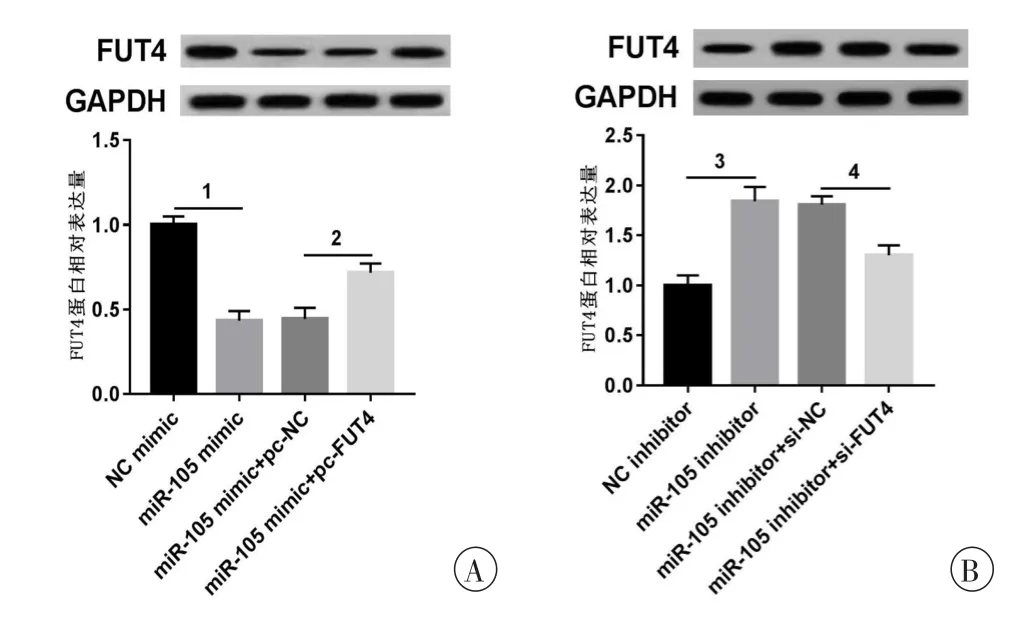
图4 miR-105靶向调控FUT4的表达
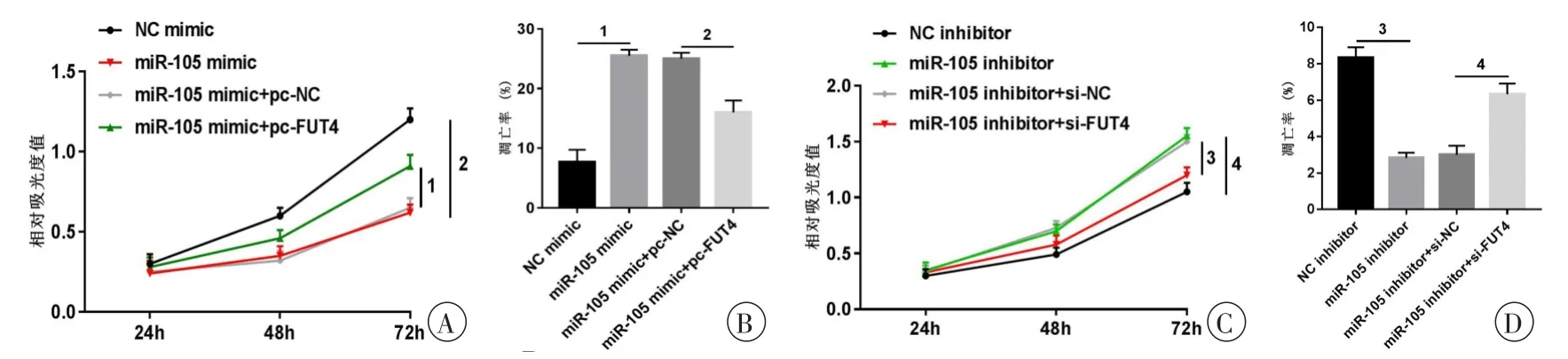
图5 共转染对人OA软骨细胞增殖和凋亡的影响
3 讨论
OA是一种以软骨退变为主要特征的慢性退行性骨关节疾病,病情严重时可导致关节功能障碍[15,16]。OA的病因及发病机制目前尚不明确,近年来的研究报道miRNA与该疾病的发病密切相关,参与OA的炎性反应等多项进程[17-19],如miR-15a通过抑制其靶基因的表达诱导OA软骨细胞发生凋亡,参与OA的进展[20]。目前研究表明,miR-105能够显著抑制胃癌、肝癌、脑胶质瘤、结直肠癌等癌细胞的增殖,诱导细胞凋亡,发挥抑癌作用[21-25]。然而,miR-105在OA中的研究仍较少。本研究通过Real-time PCR检测人OA软骨细胞和人正常软骨细胞中miR-105的表达量,显示miR-105在人OA软骨细胞中呈低表达,通过细胞转染上调OA软骨细胞中miR-105的表达,结果发现OA软骨细胞的增殖能力升高,细胞凋亡率降低。与Ji等[8]的研究结果类似,miR-105在OA患者中表达下调,FGF2/miR-105在OA发病机制中起重要作用。上述结果说明miR-105对OA软骨细胞起保护作用。
FUTs家族是一组岩藻糖基化合酶。目前认为人血清中一些FUTs活性升高,可作为恶性肿瘤的指征,FUTs活性与疾病发展过程(如炎症)关系密切[26-29]。目前多项研究表明FUTs家族可能在某些关节炎中起重要作用,但FUTs对OA影响的研究仍较少。本研究分析了人OA软骨细胞和人正常软骨细胞中FUT4基因和蛋白的表达水平,发现人OA软骨细胞中FUT4 mRNA和蛋白水平显著增加。因此,有必要进一步研究阐明FUT4在OA中的作用机制。本研究通过生物信息学工具预测并通过双荧光素酶报告基因实验验证,FUT4是miR-105的直接靶基因,且FUT4表达受软骨细胞中内源性miR-105的调节。此外,miR-105的过表达显著促进了OA软骨细胞的生长并抑制细胞凋亡,而这种效应可以通过与FUT4 cDNA的共转染来逆转。FUT4的敲除逆转了miR-105的敲除导致OA软骨细胞凋亡抑制作用。这与Isozaki等[30]的报道类似,在类风湿性关节炎滑膜成纤维细胞裂解物中α(1,2)-连接的岩藻糖基化蛋白显著高于正常滑膜成纤维细胞裂解物。Benedetti等[31]关于青少年特发性关节炎的研究发现,与患者外周血T细胞相比,滑液中FUT7 mRNA水平上调。
本研究首先检测了miR-105和FUT4基因在人OA软骨细胞和人正常软骨细胞中的表达水平,发现FUT4在OA软骨细胞中异常上调。通过生物信息学和双荧光素酶报告基因实验验证了FUT4是miR-105的直接靶基因,并鉴定了miR-105在OA中通过负向调控FUT4影响OA软骨细胞的增殖和凋亡。因此,miR-105-FUT4信号轴可作为OA治疗中的潜在治疗靶点。
