响应面法优化壶瓶枣醋的工艺研究
2019-07-20吕欢刘瑶樊迎王如福
吕欢,刘瑶,樊迎,王如福*
(1.山西农业大学 食品科学与工程学院,山西 晋中 030801;2.山西农业大学 园艺学院,山西 晋中 030801)
壶瓶枣(ZiziphusjujubeMill. cv. Hupingzao)是鼠李科枣属植物的果实,其个大、皮簿、肉厚、风味甘美,有“八个一尺,十个一斤”之美称[1]。壶瓶枣富含黄酮类、有机酸、三萜类、环磷酸腺苷、维生素、微量元素等[2]。同时壶瓶枣含糖量也相当高,可以很好被酵母菌、醋酸菌等发酵微生物所利用。此外,壶瓶枣是一种滋补佳品,中医认为其有补中益气、养血安神、润心肺、补五脏、治虚损及解毒等功效[3]。近年来,随着壶瓶枣种植面积增加,其产量不断提高,但壶瓶枣易裂口、不耐贮运,这严重制约了枣农的经济收入,故对裂枣进行综合开发和深加工较为迫切[4,5]。
枣醋营养丰富,兼有枣和食醋的多种营养保健功能。枣醋作为一种美味的保健品,能开胃消食、预防感冒、消除疲劳、醒酒、降低血脂含量、防治高血压及动脉硬化,并对神经衰弱具有辅助性治疗作用[6]。目前,枣醋的发酵工艺已经比较成熟,但运用优势菌株强化发酵过程的研究较少,因此枣醋仍有较大的开发潜力及广阔的市场前景[7]。
本文的研究对象为山西省太谷县的特色水果——壶瓶枣。将其进行液态发酵制醋,在单因素试验的基础上,采用Box-Behnken试验设计,通过响应面分析,对壶瓶枣醋酒化阶段和醋化阶段的发酵工艺条件进行优化,以期为壶瓶枣的深加工提供技术参数。
1 材料与方法
1.1 原料与试剂
1.1.1 原料
裂口壶瓶枣:山西农业科学院果树研究所。
1.1.2 菌种
巴氏醋酸菌A3-7:山西农业大学山西老陈醋菌种库。
1.1.3 试剂
酵母膏、葡萄糖、琼脂、无水乙醇、碳酸钙、氢氧化钠等:常规分析纯;安琪酿酒酵母:安琪酵母股份有限公司。
1.2 仪器与设备
DS-1组织捣碎机 上海昂尼仪器仪表有限公司;SW-CJ-2FD双人单面净化工作台 苏州净化设备有限公司;ZQPL-200立体式全温振荡培养箱 天津市莱玻特瑞仪器设备有限公司;GZX-9420电热恒温鼓风干燥箱 上海博讯实业有限公司医疗设备厂;STARTER 3100 pH计 奥豪斯仪器(上海)有限公司;LS-35LJ立式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;79-1型磁力加热搅拌器 常州润华电器有限公司;FA224电子天平 上海舜宇恒平科学仪器有限公司;手持折光仪 北京中西远大科技有限公司。
1.3 试验方法
1.3.1 工艺流程
果实挑选→清洗沥干→去核→破碎打浆→过滤取汁→酶解→灭酶灭菌→调糖调酸→加入酵母→酒化发酵→接入醋酸菌→醋化发酵→过滤→装瓶→杀菌→成品。
1.3.2 操作要点
原料挑选:裂口壶瓶枣(半红期至全红期)。
破碎、榨汁[8]:破碎、去核,将果肉放入捣碎机,按质量比1∶4 加水进行打浆;然后过滤。
酶解、澄清[9]:将滤液升温至50 ℃左右,并加入滤液0.1%的果胶酶,恒温水解3 h;再升温至85 ℃灭酶10 min,最后降至25 ℃。将灭酶后的酶解液离心(4000 r/min,10 min),取上清液。
调糖调酸[10,11]:测出此时枣汁的可溶性固形物含量,以白砂糖调整后枣汁的可溶性固形物含量作为试验设定值,并用柠檬酸调整pH值为3.5~4.0。
酒化阶段:以调整好成分的壶瓶枣枣汁为原料,接入适量安琪酵母置于恒温培养箱中进行酒化发酵,1~3 d敞口发酵,4~8 d封口发酵,随后每天同一时间取样,并测定酒精度。
醋化阶段:以酒化后的发酵液为原料,接入适量巴氏醋酸菌放入恒温振荡培养箱中,在一定温度条件下发酵10 d,并每天同一时间取样,测定酸度。
1.3.3 酒化阶段单因素试验设计
以酒精度作为评价指标,固定基本条件为[12]:可溶性固形物含量(soluble solid content,SSC,下同)8%、酵母菌接种量(以壶瓶枣枣汁含量计算)0.4%、发酵温度30 ℃。采用控制变量的单因素轮换法,分别考察并确定出SSC(5%、6%、7%、8%、9%)、酵母菌接种量(0.1%、0.2%、0.3%、0.4%、0.5%)、发酵温度(24,26,28,30,32 ℃)这3个因素的合适水平。
1.3.4 醋化阶段单因素试验设计
以总酸含量作为评价指标,固定基本条件为:初始酒精度8.0%、醋酸菌接种量(以壶瓶枣枣汁含量计算)7%、发酵温度34 ℃。同样采用单因素轮换法,分别考察并确定出初始酒精度(7.0%、7.5%、8.0%、8.5%、9.0%)、醋酸菌接种量(1%、3%、5%、7%、9%)、发酵温度(32,34,36,38,40 ℃)这3个因素的合适水平。
1.3.5 响应面试验设计
在单因素试验数据基础上,对酒化阶段的SSC、酵母菌接种量、发酵温度这3个因素的优选水平和醋化阶段的初始酒精度、醋酸菌接种量、发酵温度这3个因素的优选水平分别进行Box-Behnken中心组合试验。每组试验各包括17个试验点,其中12个析因点,5个零点重复以估计误差。用Design-Expert 8.0软件建立回归模型,确定酒化和醋化阶段的最优工艺条件。两个阶段的因素水平编码值见表1和表2。

表1 酒化阶段响应面因素水平编码表Table 1 The response surface factors and levels coding table in alcoholization stage

表2 醋化阶段响应面因素水平编码表Table 2 The response surface factors and levels coding table in acetification stage
1.3.6 指标测定方法
SSC含量:手持折光仪[13];
酒精度(酒精计法):根据GB/T 15038-2006操作;
总酸度:根据GB/T 5009.41-1996操作。
2 结果与分析
2.1 酒化阶段各单因素试验结果与分析
2.1.1 SSC对酒精度的影响
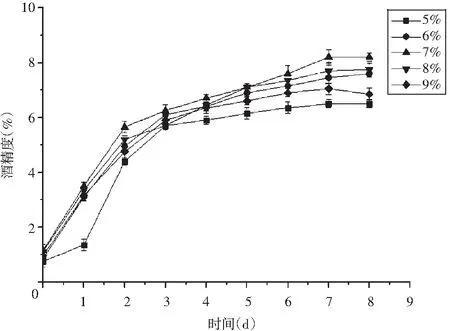
图1 SSC对酒精度的影响Fig.1 Effect of soluble solid content on alcohol content
由图1可知,酒化阶段酒精度的整体变化趋势一致:前1~3 d酒醪的酒精度增长较快,之后增长较平缓。但不同SSC所对应的最终酒精度不同:当SSC为5%时,由于还原糖含量低,可供酵母菌发酵的底物不足,导致最终酒精度也最低;当SSC为9%时,最终酒精度也明显低于其他几组,说明糖度过高抑制了微生物的正常代谢;当SSC为7%时,最终获得的酒精度最高(8.2%)。说明SSC过高或过低都不利于酒化时酒精的生成,过高可能会导致糖类发酵不完全,过低则会抑制发酵。故选择SSC 7%为最适水平,选择6%、7%、8%这3个水平进行响应面优化。
2.1.2 酵母菌接种量对酒精度的影响

图2 酵母菌接种量对酒精度的影响Fig.2 Effect of yeast inoculation amount on alcohol content
由图2可知,酵母菌接种量在一定范围内,酒精发酵7 d后基本停止发酵。当酵母菌接种量为0.3%时,酒醪的最终酒度达到最高(8.0%);接种量大于0.3%时,随着接种量增加,菌种会消耗更多的糖分用于自身代谢,故最终酒精度越低;接种量为0.1%时,酒精度最低,未达到6.0%,原因是接种量太少,发酵能力不足致使发酵不完全。综上所述,酵母菌最佳接种量为0.3%,选择0.2%、0.3%、0.4%这3个酵母菌接种量水平进行响应面优化。
2.1.3 发酵温度对酒精度的影响
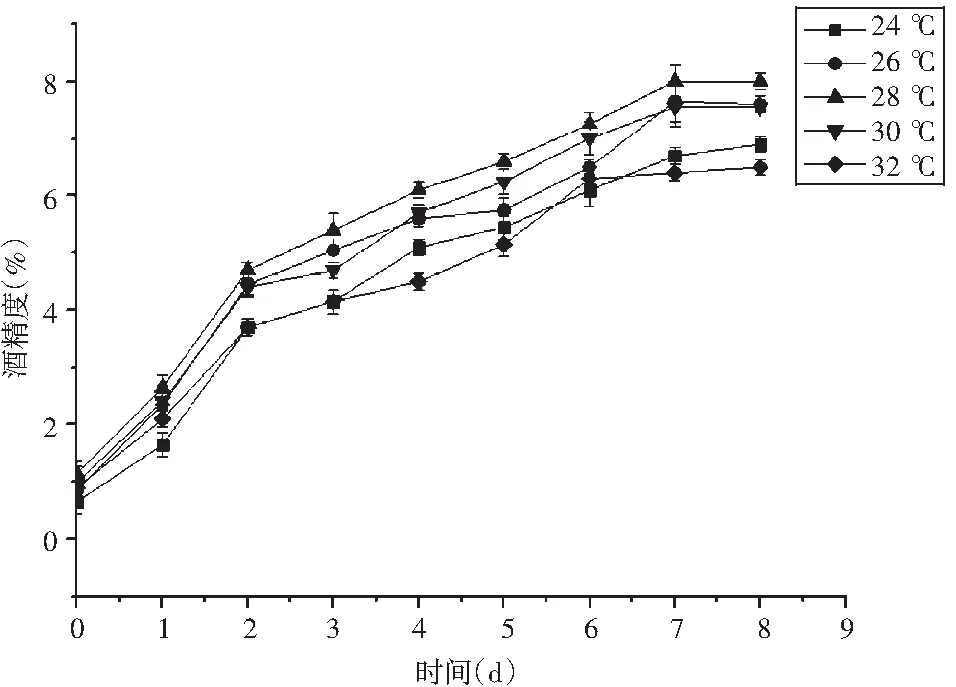
图3 发酵温度对酒精度的影响Fig.3 Effect of fermentation temperature on alcohol content
适宜的发酵温度不仅有利于菌株的生长繁殖,也利于代谢产物的积累。一般而言,随着温度的升高,酵母菌繁殖和代谢速度加快,产酒率也随之升高;但当温度过高时酵母菌会丧失活性而死亡,对发酵不利[14]。由图3可知,敞口发酵前3 d(1~3 d)酒度增长速度较快,从封口发酵开始直到酒化结束,酒精度增长幅度不大,趋于平稳状态。当发酵温度为28 ℃时,酒醪的最终酒精度达到最高8.0%;发酵温度24 ℃时,因低温抑制了酵母菌的生长繁殖,致使最终酒度低于7.0%;当发酵温度为32 ℃时,最终酒精度也较低,表现出温度过高对发酵过程的不利影响;当发酵温度为26,30 ℃时,最终酒精度均接近于8.0%。因此,确定酒化阶段最适温度为28 ℃,选择26,28,30 ℃这3个温度水平进行响应面优化。
2.2 酒化阶段响应面试验结果
在单因素基础上,对SSC、酵母菌接种量、发酵温度这3个因素进行响应面试验,采用Design-Expert 8.0软件提供的Box-Behnken试验与响应面分析,以最终酒精度为响应值,优化酒化阶段的工艺参数,试验设计及结果见表3。

表3 酒化阶段响应面试验设计及结果Table 3 Design and results of response surface test in alcoholization stage

续 表
运用Design-Expert 8.0对表3试验结果进行回归分析,获得SSC(A)、酵母菌接种量(B)和发酵温度(C)与酒精度(Y)的二次多项回归方程式:
Y=9.04+0.21A-0.025B+0.088C-0.13AB+0.45AC+0.18BC-0.47A2-0.35B2-0.47C2。
对该响应面二次回归模型进行方差分析,结果见表4。
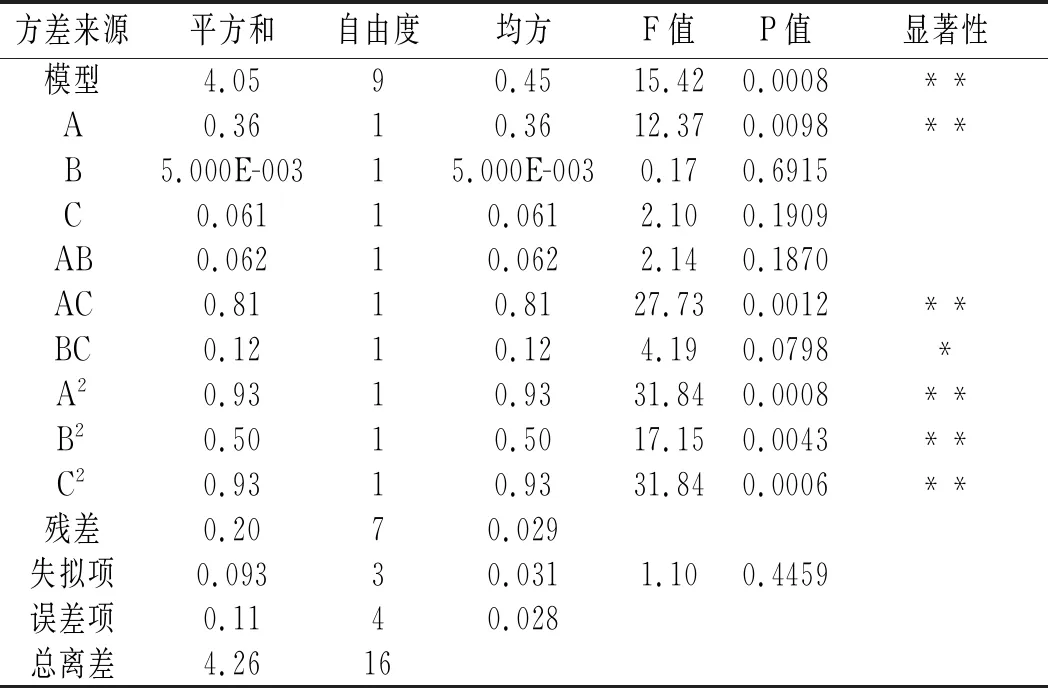
表4 响应面优化酒化阶段二阶回归模型方差分析Table 4 Response surface optimization of analysis of second-order regression model in alcoholization stage
注:若Prob>F值<0.05表明模型或因素影响显著,用“*”表示;若Prob>F值<0.01表明影响极显著,用“**”表示。
显著性试验结果以P值大小表示,P值<0.05,表明在统计学上有意义[15],由表4可知,该回归模型P=0.0008<0.01,表明该方程模型极显著,具备统计学意义;失拟项不显著(P=0.4459>0.05),说明试验误差较小,所预测的结果较可靠。模型的决定系数R2=0.9520,调整决定系数R2(Adj)=0.8902和信噪比(C.V.,%)=2.03,说明预测值与试验值相关性较好,即模型可信度高,故可以使用该模型确定酒化阶段的最佳工艺。由表4中方差分析结果可知,本试验建立的模型中一次项A、二次项A2、B2、C2及交互项AC影响极显著(P<0.01);交互项BC影响显著(P<0.05);一次项B和C及交互项AB影响不显著(P>0.05)。
在ANOVA 结果的基础上,运用Design-Expert 8.0绘制出各因素对酒精度影响的响应面图,见图4。
响应面可以直接反映各因素对酒精度的影响程度,响应面坡度越陡,说明该因素对酒精度影响越大;相反,响应面坡度越平缓,说明该因素对酒精度的影响越小[16]。3个因素之间的交互作用对酒精度的影响见图4,其中,SSC与发酵温度的交互作用、SSC与酵母菌接种量的交互作用对酒精度影响显著,发酵温度与酵母菌接种量的交互作用对酒精度影响不显著。综上所述,3个因素对酒精度的影响程度为:SSC(A)>发酵温度(C)>酵母菌接种量(B)。
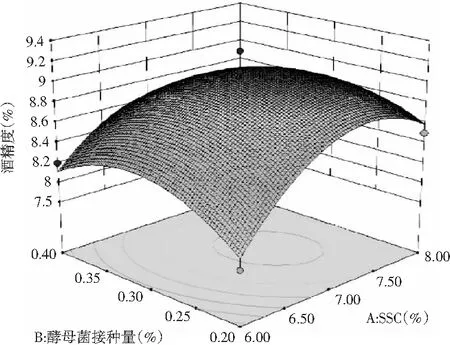

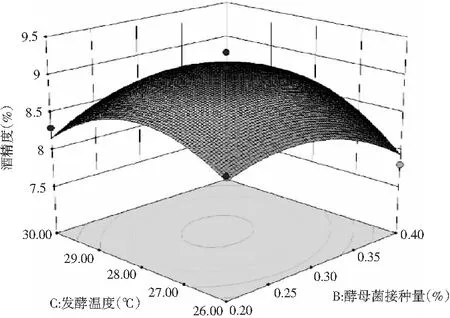
图4 SSC、酵母菌接种量和发酵温度对酒精度影响的响应面图Fig.4 Response surface diagrams of soluble solid content, yeast inoculation amount and fermentation temperature on alcohol content
由Design-Expert 8.0分析处理得到酒化阶段最佳发酵条件为:SSC 7.35%、发酵温度28.51 ℃、酵母菌接种量0.30%,在此优化条件下酒醪的酒精度理论值为9.08914%。为满足工艺的实用性,将工艺参数改为: SSC含量7%、酵母菌接种量0.3%、发酵温度28.5℃,并在此条件下,重复3次试验进行验证,得到酒醪酒精度的平均值为9.0%,与模型预测值吻合。
2.3 醋化阶段各单因素试验结果与分析
2.3.1 初始酒精度对总酸含量的影响
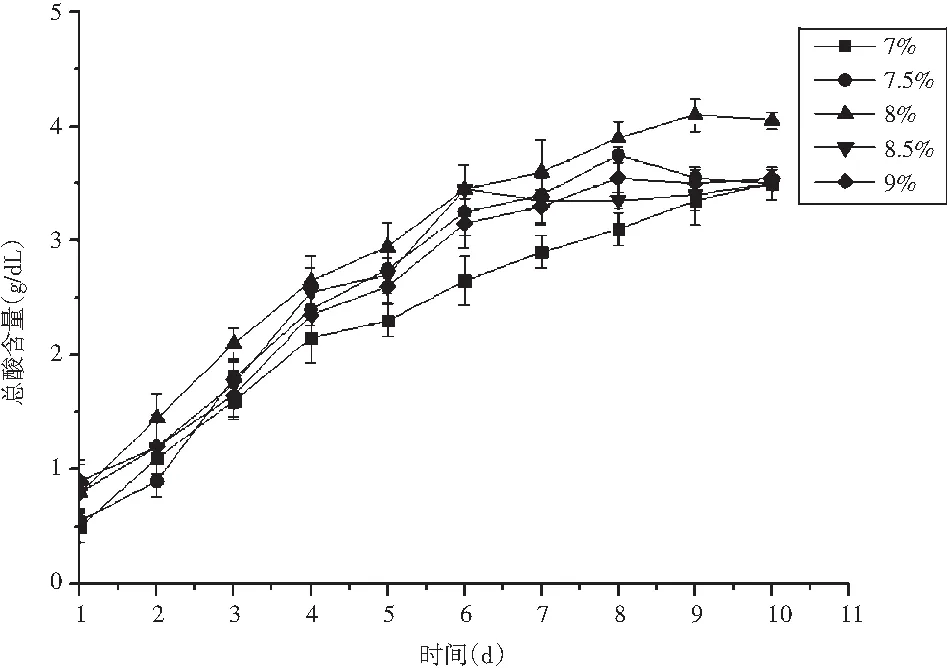
图5 初始酒精度对总酸含量的影响Fig.5 Effect of initial alcohol content on total acid content
在醋化阶段,酒精是醋酸菌作用的主要物质,初始酒精度越高,则产酸量越高,但是酒精浓度过高时也会抑制醋酸菌的生长和代谢,反而使产酸量下降;当酒度太低时又不易产酸,这两者情况均会影响产品的风味[17,18],故有必要寻找最优的初始酒精度。由图5可知,8.0%的初始酒精度为临界点,在该酒度下总酸含量最高,为4.1 g/dL;初始酒精度低于或高于8.0%,最终酸度值均低于4.1 g/dL,且初始酒精度跟8.0%相差越大,最终酸度值也愈低。综上所述,初始酒精度8.0%为该因素的最适水平,选择7.5%、8.0%、8.5%这3个水平进行响应面优化。
2.3.2 醋酸菌接种量对总酸含量的影响
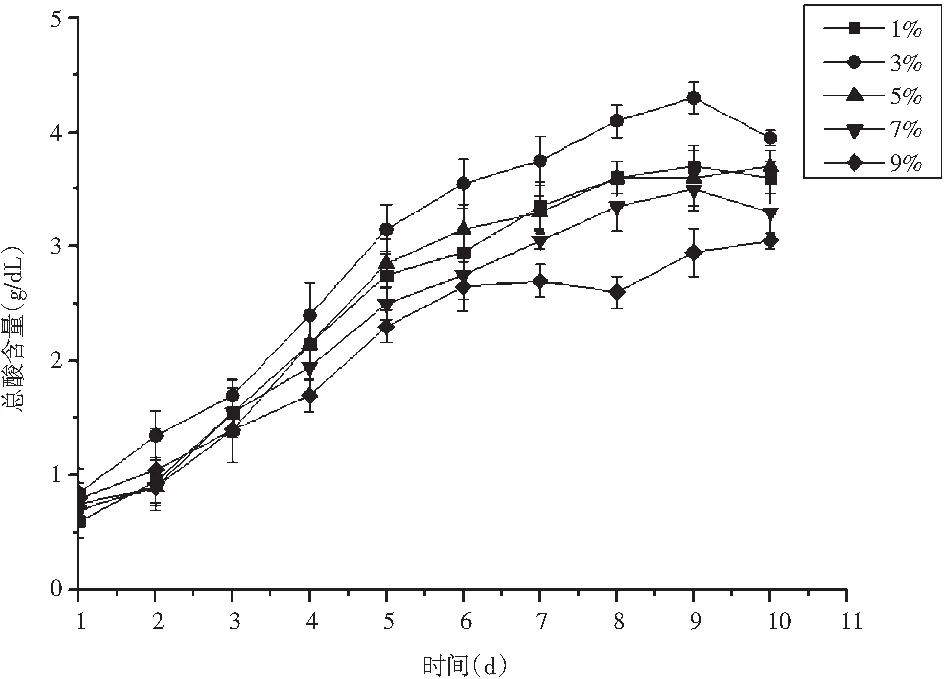
图6 醋酸菌接种量对总酸含量的影响Fig.6 Effect of acetic acid inoculation amount on total acid content
醋酸菌作为醋化阶段发酵的主要菌种,其接种量大小对最终产品酸度有直接影响[19]。由图6可知,不同醋酸接种量下发酵前8 d均产酸迅速,总酸含量不断增加;发酵最后2 d,总酸含量趋于平缓。当醋酸菌接种量为5%、7%、9%时,最终酸度值较低,可能由于接种量过大,菌体生长繁殖消耗大量营养物质,导致产酸能力减弱;当接种量为1%时,由于菌种含量少,发酵不完全,最终导致总酸含量低于4 g/dL。整体来看,醋酸菌接种量过高或过低都不利于醋化发酵。当醋酸菌接种量为3%时,产酸能力最强,此时最终总酸含量为4.3 g/dL,与次优值之间差距较大,为了更精确地优化该因素,选择2%、3%、4%这3个醋酸菌接种量水平进行响应面优化。
2.3.3 发酵温度对总酸含量的影响

图7 发酵温度对总酸含量的影响Fig.7 Effect of fermentation temperature on total acid content
由图7可知,发酵温度在36 ℃时,总酸含量达到最高;当温度低于36 ℃时,酸度随温度的升高逐渐上升;当发酵温度超过36 ℃时,酸度随温度的上升反而明显下降。38 ℃与40 ℃条件下产醋酸量较少的主要原因可能是在高温条件下,醋酸被氧化成二氧化碳和水[20];而32 ℃与34 ℃时的最终酸度值不高的原因是低温抑制了醋酸菌的活性,影响其代谢产物的产量。所以认为36 ℃为醋化阶段的最适发酵温度,选择34,36,38 ℃这3个水平进行响应面优化。
2.4 醋化阶段响应面试验结果
在单因素基础上,对初始酒精度、醋酸菌接种量、发酵温度这3个因素进行响应面试验,设计因素及结果见表5。

表5 醋化阶段响应面试验设计及结果Table 5 Design and results of response surface test in acetification stage

续 表
运用Design-Expert对所得的试验结果进行回归分析,获得初始酒精度(A)、醋酸菌接种量(B)和发酵温度(C)与总酸含量(Y)的二次多项回归方程式:
Y=+4.80+0.43A+0.19B+0.19C-0.100AB+0.050AC+0.025BC-0.51A2-0.19B2-0.39C2。
对该响应面二次回归模型进行方差分析,结果见表6。

表6 响应面优化醋化阶段二阶回归模型方差分析Table 6 Response surface optimization of analysis of the second-order regression model in acetification stage
注:若Prob>F值<0.05表明模型或因素影响显著,用“*”表示;若Prob>F值<0.01表明影响极显著,用“**”表示。
由表6方差分析结果可知,本试验建立的模型一次项A与二次项A2、C2影响极显著(P<0.01);一次项B和C与二次项B2影响显著(P<0.05);交互项 AB、AC、BC影响不显著(P>0.05)。模型的决定系数R2=0.9754,调整决定系数R2(Adj)=0.9439和信噪比(C.V.,%)=3.77,说明预测值与试验值有较好的相关性,可以使用该模型确定醋化阶段的最佳工艺。
在ANOVA结果的基础上,运用Design-Expert 8.0绘制出各因素对总酸含量影响的响应面图,见图8。
3个因素之间的交互作用对壶瓶枣醋总酸含量的影响见图8。其中,初始酒精度与发酵温度、初始酒精度与醋酸菌接种量的交互作用对总酸含量影响显著,发酵温度与酵母菌接种量的交互作用对总酸含量影响不显著。由此可知,各因素对产品总酸含量影响程度为:初始酒精度(A)>发酵温度(C)>醋酸菌接种量(B)。



图8 初始酒精度、醋酸菌接种量和发酵温度对总酸含量影响的响应面图Fig.8 Response surface diagrams of initial alcohol content, acetic acid inoculation amount and fermentation temperature on total acid content
由Design-Expert分析处理得到醋化阶段最佳发酵条件为:初始酒精度8.11%、醋酸菌接种量3.46%、发酵温度36.54 ℃,在此优化条件下所得产品总酸含量理论值为4.91426 g/dL。考虑工艺的实用性,将工艺参数改为:初始酒精度8%、醋酸菌接种量3.5%、发酵温度36.5 ℃,并在此条件下,重复3次试验进行验证,得到壶瓶枣醋总酸含量的平均值为4.9 g/dL。预测值与真实值之间的误差约为0.06 g/dL,表明响应面法对醋化发酵优化的结果是合理有效的。
3 结论
本研究以裂口壶瓶枣为原料,酿造一种兼具壶瓶枣和醋营养价值的枣醋。通过单因素试验、响应面法优化出壶瓶枣醋酒化阶段及醋化阶段的最佳发酵工艺。得出酒化阶段发酵工艺的最优条件为:SSC 7%、酵母菌接种量0.3%、发酵温度28.5 ℃;醋化阶段发酵工艺的最优条件为:初始酒精度8.0%、醋酸菌接种量3.5%、发酵温度36.5 ℃。在此工艺条件下,枣醋总酸含量为4.9 g/dL,该研究不仅为壶瓶枣醋的生产酿造提供了技术参数,而且减少了裂果给枣农带来的经济损失。
