不同提取方法提取辣椒及其制品中DNA效果研究
2019-07-11罗阿东陆邹红蔡秋
罗阿东 陆邹红 蔡秋
摘要 采用CTAB法、SDS法、吸附柱法对辣椒及其制品中的基因组DNA进行提取,分别通过核酸蛋白测定仪、琼脂糖凝胶电泳、实时荧光PCR扩增检测。结果表明,CTAB法、SDS法、吸附柱法均能从鲜辣椒、干辣椒、油辣椒、辣椒酱中抽提得到DNA,从核酸蛋白测定仪检测得到的DNA提取物OD260/OD280值可看出,CTAB法和SDS法提取的DNA纯度较吸附柱法的低;DNA样品的琼脂糖凝胶电泳发现,各样品均无大范围明显拖尾,说明DNA提取完整度较好;实时荧光PCR检测分析3种提取方法的不同样品基因组DNA均出现PCR扩增曲线。经试验比较确定,提取方法的效率由高到低依次为吸附柱法>SDS法>CTAB法。可见,吸附柱法最适用于辣椒及其制品中核酸提取。
关键词 辣椒及其制品;DNA提取;CTAB法;SDS法;DNA吸附柱
中图分类号 S641.3 文献标识码 A 文章编号 1007-5739(2019)01-0212-02
Abstract CTAB,SDS and DNA adsorption column method were adopted to extract DNA from chilli and its products.Nucleic acidprotein detector method,agarose gel electrophoresis method and real-time fluorescence PCR amplification methods were applied to measure the DNA samples.The results showed that DNA could be extracted by CTAB,SDS and adsorption column from chilli and its products.It could be seen from the OD260/OD280 value of DNA extract by nucleic acid protein detector,the concentration of DNA extracted by CTAB and SDS was lower than that by adsorption column.Agarose gel electrophoresis measurement showed DNA extracted with 3 methods there was no obvious tail smearing in all areas,the results showed that DNA had better extraction integrity.The PCR amplification curve of genomic DNA of 3 different extraction methods was detected by real-time fluor-escence PCR.Through experiment and comparison,it was determined that the efficiency of the extraction method was as following:adsorption column method>SDS method>CTAB method.In summary,the adsorption column method is the most suitable for extracting nucleic acid from chilli and its products.
Key words chilli and its products;DNA extraction;CTAB method;SDS method;DNA adsorption column
辣椒是人們生活中必不可少的蔬菜作物,具有药理、经济、食用、营养等方面的价值。我国的辣椒制品种类繁多,如油辣椒、糟辣椒、辣椒酱等,辣椒制品多样化推动了我国辣椒产业经济的发展。辣椒在世界各地得到广泛种植,但是同时也面临着连作障碍、土壤传播疫病、生长条件、产量及质量等诸多问题,人们借助转基因技术以及辣椒分子育种技术,对辣椒的生长条件、栽培技术、病虫害防治等方面进行了研究[1-2]。
DNA是遗传信息的载体,提取高质量的DNA分子是开展植物基因组学及转基因检测研究的基础,通常要求所提取的DNA分子应具有较高的纯度,且无断裂、降解现象,提取过程中尽量少使用有毒化学药品以保证下游工作的进行[3-4]。辣椒中富含的酚类化合物、蛋白质、多糖等物质会抑制DNA提取质量,辣椒制品内的酸、油、盐、添加剂等也会影响DNA提取效率及质量[5-6]。目前,国内外已研究出许多提取植物DNA的方法,例如CTAB法、SDS法、碱裂解法、苯酚法、吸附柱法等[7-10]。
本次研究针对辣椒及其制品的成分特点,选取CTAB法、SDS法和吸附柱(试剂盒)等DNA提取具有代表性的方法,对辣椒及其制品进行DNA提取,并比较提取效果,目的在于筛选出一种能简单、快速、高效获取高质量DNA的方法,为辣椒及其制品分子生物学的研究奠定基础。
1 材料与方法
1.1 试验材料
试验材料有鲜辣椒、干辣椒、油辣椒和辣椒酱,均购自市场。
试剂有Premix Ex Taq(Probe qPCR)(荧光PCR反应液)、DL2000 DNA Marker 、MiniBEST Universal Genomic DNA Ext-raction Kit(DNA提取试剂)、十六烷基三甲基溴化铵(CTAB)、十二烷基硫酸钠(SDS)、蛋白酶K、氯仿/异戊醇(24∶1)、75%乙醇、GoldView核酸染料,均购买于宝日医生物技术有限公司。
仪器有实时荧光PCR仪(7500 Fast,美国Applied Bios-ystems)、化学发光凝胶成像系统(DOC XRS,美国Bio-rad)、凝胶电泳仪(PowerPac 3000,美国Bio-rad )、高速冷冻离心机(Microfuge 22R Centrifuge,美国Beckman Coulter)、超纯水仪(Milli-Q,美国Milli-pore)、核酸蛋白测定仪(NanoDrop 2000,美国Thermo Scientific)、冷冻混合球磨仪(MM400,德国Retsch)、移液器、涡旋振荡器、恒温金属浴锅、生物安全柜等。
1.2 DNA提取方法
针对辣椒制品需做样品前处理,采用洗涤方式,尽量去除样品中的其他物质(如盐、糖、添加剂及其发酵产物等)。取适量样品与2倍体积的超纯水至50 mL离心管中,充分混匀,于离心机离心5 min(12 000 r/min),弃上清,重复洗涤3~5次。对于辣椒酱、油辣椒等液体样品,可使用均质器破坏样品的稳定性并加以分离、浓缩,取适量样品与2倍体积的超纯水至2 mL离心管中,充分混匀,于离心机离心5 min(12 000 r/min)弃上清,重复洗涤3~5次。
1.2.1 CTAB法。取2% CTAB抽提缓冲液于65 ℃金属浴中预热,取样品约0.3 g置于球磨仪(液氮处理)研磨,加入700 μL 2% CTAB抽提缓冲液,轻轻搅动,将磨碎液分倒入1.5 μL灭菌离心管中,于 65 ℃金属浴加热振荡10 min,加入5 μL 5 mol/L醋酸钾溶液,混匀,再金属浴20 min;取出离心管后置于冰上,加入等体积的氯仿/异戊醇(24∶1),轻轻来回颠倒,充分混匀;放入4 ℃高速冷冻离心机中(12 000 r/min)离心15 min,吸取上清液500 μL放入另一离心管中,加入等体积异戊醇,颠倒混匀;12 000 r/min离心10 min后,弃上清,加入500 μL 75%乙醇,轻弹离心管,使沉淀与管底的DNA块状物浮游于液体中,放置30 min,使DNA块状物上的不纯物溶解;在12 000 r/min条件下离心5 min后弃上清,加入等量75%乙醇再洗30 min,然后再12 000 r/min离心5 min,弃上清液,并将离心管倒立于滤纸之上,自然风干,加入50 μL TE溶液,使DNA溶解,置于-20 ℃冰箱冷冻保存、待用。
1.2.2 SDS法。称取0.3 g样品放入球磨仪(液氮处理)中研碎,迅速放入1.5 mL离心管中,加700 μL SDS提取液,充分混匀,于65 ℃金属浴加热振荡30 min;取出离心管,加入5 μL 5 mol/L醋酸钾溶液,混匀,再金属浴20 min;取出离心管后放置在冰上,加入等体积的氯仿/异戊醇(24∶1),轻轻地来回颠倒,使管液充分混匀;放入4 ℃高速冷冻离心机中(12 000 r/min)离心15 min,吸取上清液500 μL放入另一离心管中,加入等体积的氯仿/异戊醇(24∶1),颠倒混匀,然后12 000 r/min离心10 min,再吸取上清液500 μL于另一离心管中,重复上一步骤;吸取上清液于另一干净的离心管中,加入0.6~1.0倍体积的异丙醇,轻轻地来回颠倒,出现絮状DNA沉淀,再放入-20 ℃冰箱冷冻室30 min沉淀核酸;然后在12 000 r/min条件下离心5 min后,倒掉液体,加入500 μL 75%乙醇再洗涤30 min;在12 000 r/min条件下离心5 min之后,倒掉液体,并将离心管倒立于滤纸之上,自然風干,加入50 μL TE溶液溶解DNA,放置于-20 ℃冰箱冷冻保存、待用。
1.2.3 吸附柱法(试剂盒)。取0.3 g样品加入1.5 mL离心管,再加入180 μL Buffer GL、20 μL Proteinase K和10 μL RNase A(10 mg/mL),于56 ℃水浴(或用加热振荡器)至组织完全裂解(30 min);在12 000 r/min条件下离心5 min,取上清至另一离心管中,并加入200 μL Buffer GB和200 μL 100%乙醇,充分混匀;将溶液移至Spin Column中,在12 000 r/min条件下离心2 min,弃滤液,将500 μL Buffer WA加入至Spin Column中,在12 000 r/min条件下离心1 min,弃滤液;将500 μL 75%乙醇加入至Spin Column中,在12 000 r/min条件下离心1 min,弃滤液。重复该步骤1次,弃滤液后再离心2 min;将Spin Column安置于新的1.5 mL离心管上,在Spin Column膜中央处加入50 μL TE溶液,室温静置5 min;在12 000 r/min条件下离心5 min洗脱DNA,置于-20 ℃冰箱冷冻保存、待用。
1.3 DNA浓度及纯度检测
1.3.1 核酸蛋白测定仪检测。利用核酸蛋白测定仪检测SDS法、CTAB法、吸附柱法提取鲜辣椒、干辣椒、油辣椒、辣椒酱中的DNA,测260 nm和280 nm处的吸光值,并记录,通过OD260/OD280值判断提取DNA的纯度。
1.3.2 琼脂糖凝胶电泳检测。吸取3 ?滋L DNA在1%琼脂糖凝胶电泳上进行电泳,GoldView染色、蒸馏水冲洗后,放入化学发光凝胶成像系统观察、拍照。以电泳图来确定提取的DNA完整度及RNA是否去除。
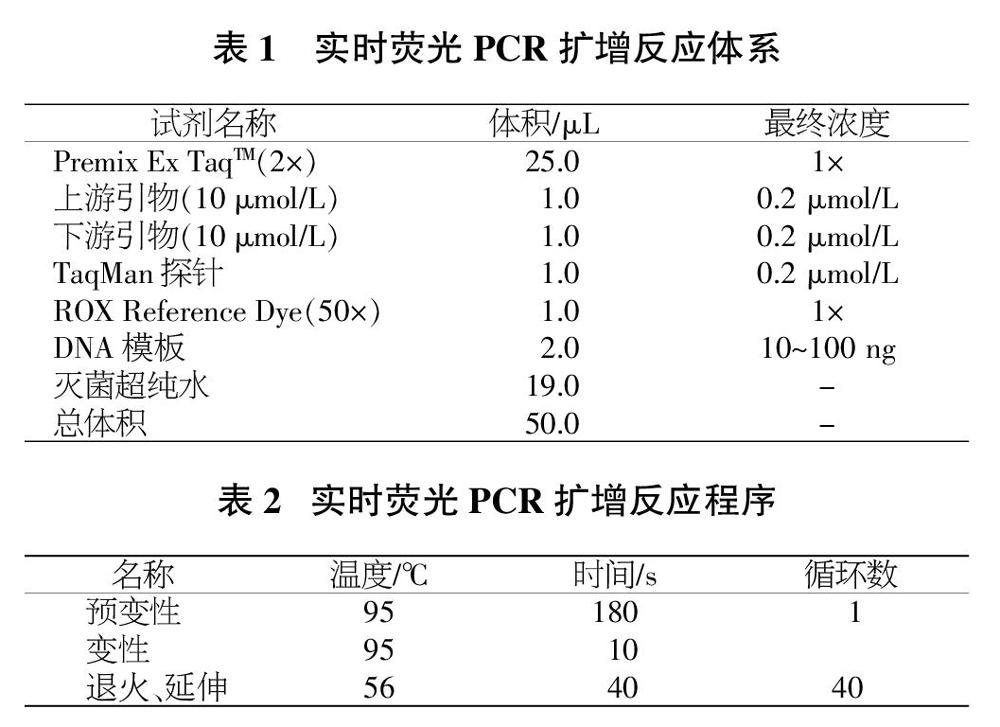
1.3.3 实时荧光PCR扩增检测。为进一步检测SDS法、CTAB法、吸附柱法提取不同样品的基因组DNA中是否存在PCR扩增抑制。以提取得到的DNA为模板,以辣椒内源基因CaATL1为参考基因,其具有保守、拷贝数稳定等特征。所使用反应体系见表1,扩增程序见表2。
2 结果与分析
2.1 核酸蛋白测定仪检测结果
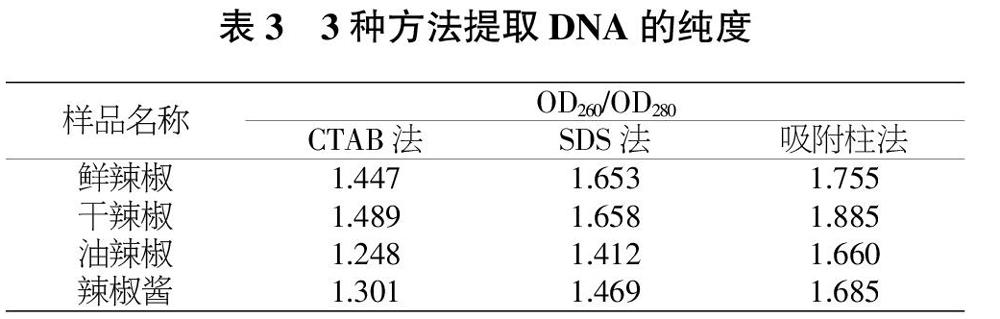
经核酸蛋白分析仪测定表明,用CTAB法、SDS法、吸附柱法对鲜辣椒、干辣椒、油辣椒、辣椒酱提取,均能抽提得到DNA。从样品的抽提物纯度OD260/OD280比值(表3)来看,CTAB法提取物纯度较低,其次是SDS法,而吸附柱法的提取物纯度较高。
2.2 琼脂糖凝胶电泳检测结果
如图1所示,CTAB法、SDS法、吸附柱法均能从指定样品中提取出DNA,均无大范围明显拖尾,说明DNA完整性较好。从泳道中可看出,吸附柱法提取的目标条带较亮,这与吸附柱的过滤吸附功能有关,对DNA基因组及其片段有较强的吸附获取作用,在3种方法中以吸附柱法提取的DNA效率最高。而SDS法和CTAB法条带较吸附柱法暗,提取到的DNA量相对较少,其中CTAB法对油辣椒和辣椒酱的DNA提取量最少,说明其针对深加工辣椒制品的DNA提取效率较低。
2.3 实时荧光PCR扩增检测结果
3种提取方法的鲜辣椒、干辣椒、油辣椒、辣椒酱基因组DNA均出现了PCR扩增曲线。对比同个样品,从实时荧光PCR扩增曲线的Ct值大小比较可得出,吸附柱法 3 结论与讨论 从深加工的辣椒制品中提取DNA比从辣椒原料中提取相对困难,因为辣椒制品中富含多种食品添加剂且加工过程复杂,影响DNA提取的质量和完整度。经过试验比较,确定提取方法的效率由高到低依次为吸附柱法>SDS法 >CTAB法。 在分子生物学标准上,OD260/OD280值是判断DNA纯度的依据。符合要求、纯度高的纯化DNA,其OD260/OD280值在1.7~1.9之间,低于此范围表示所提取样品的DNA中含有蛋白质污染,高于此范围表明样品中有RNA污染。提取的样品中存在着较多的多酚、多糖,也是导致OD260/OD280值偏低的原因之一。因此,在操作過程中需要注意多糖、多酚等杂质的去除。 通过核酸蛋白测定仪、琼脂糖凝胶电泳分析及实时荧光定量PCR检测进行比较,确定采用吸附柱法提取核酸的效率较高。根据核酸提取的原理可以看出,使用过滤膜吸附的过程中,含有基因组的混合液与之进行结合,在较短时间内仍然可以获得纯度及浓度较高的DNA;而CTAB法、SDS法操作时间较长且通过异戊醇、异丙醇沉淀DNA,效率较低。并且在针对辣椒制品进行提取时,更容易受到盐类、蛋白质、多糖的影响,故其所提取的DNA纯度较低。本次研究针对辣椒及其制品的成分特点,确定吸附柱法为最适宜辣椒及其制品核酸提取的方法。该提取方法具有用时少、效率高、提取核酸质量纯且稳定等优点。 4 参考文献 [1] 康瑜,肖深根,李颖.辣椒转基因研究进展[J].辣椒杂志,2012(2):6-11. [2] 田娅红,张鼎华.植物转基因研究进展及安全性分析[J].廊坊师范学院学报(自然科学版),2014(4):89-93. [3] 张虎平,牛建新,马兵钢,等.核桃DNA的提取及RAPD体系的优化[J].石河子大学学报(自然科学版),2003(4):267-270. [4] 刘萍,代红军,张立杰,等.DNA提取方法与植物种类的效应比较[J].宁夏农林科技,1998(1):15-18. [5] 周春阳,谢立波,李景富,等.辣椒叶片基因组DNA提取方法的研究[J].辣椒杂志,2011(3):35-37. [6] 孙晓东,李小丹,郭晏海,等.经济植物DNA提取与纯化的三种方法比较[J].陕西教育学院学报,2003(2):93-94. [7] 陈昆松,李方,徐昌杰,等.改良CTAB法用于多年生植物组织基因组DNA的大量提取[J].遗传,2004(4):529-531. [8] 桑维维,高贵珍,张兴桃,等.辣椒基因组DNA两种提取方法的比较[J].宿州学院学报,2012(8):21-24. [9] 王艳,李韶山,刘颂豪.植物总DNA样品的快速制备[J].激光生物学报,2000(1):79-81. [10] 朱英,陶刚,刘作易,等.普遍适用于农作物基因组DNA的提取方法及值得注意的几个问题[J].贵州农业科学,2005(5):20-21.
