紫山药淀粉的糖化工艺优化及体外消化模拟分析
2019-07-08崔晋马艳弘吴彩娥黄赞曹培杰黄开红
崔晋 马艳弘 吴彩娥 黄赞 曹培杰 黄开红

摘要:旨在研究紫山药淀粉糖化工艺及在模拟体外消化过程中的消化特性。以还原糖含量为指标,主要考察葡萄糖糖化酶添加量、温度、pH值和时间对糖化效果的影响,并采用正交试验优化糖化工艺。结果表明,最优糖化工艺条件为糖化酶添加量180 U/g,糖化温度65 ℃,糖化pH值4.5,糖化时间60 min。体外消化模拟试验结果表明,紫山药的可溶性糖、还原性糖释放率较低,且远低于酶解过程,主要是因为模拟的肠液中只有胰淀粉酶可以水解紫山药淀粉,产生糊精和糖,不能进一步水解。
关键词:紫山药;糖化酶;糖化;体外消化
中图分类号: TS231 文献标志码: A 文章编号:1002-1302(2019)10-0213-03
紫山药,又名紫淮山、紫莳药、大薯、参薯、脚板薯、佛掌薯等,俗称紫人参,是近年来发现的一种药食同源的薯蓣科植物[1],原产于亚洲热带地区,是一种草本蔓生性植物。紫山药富含黏性多糖、花青素、胆碱、尿囊素和薯蓣皂苷等多种功能成分[2-4]。大量研究表明,这些功能成分使紫山药具有营养、保健和医药价值,在抗氧化、抗肿瘤、降血糖、增强免疫力、调节血脂等方面具有良好的作用[5-6]。近年来,国内外对山药的研究性报道越来越多,加快了紫山药的市场开发和应用进程。
目前有关紫山药的研究主要集中在育种、栽培、营养以及生理活性等方面,有关紫山药淀粉的相关研究较少。有研究认为,淀粉酶解是开发研究含淀粉原料深加工产品的基础[7-9],其酶解特性与消化特性直接影响到产品的营养、功能及其市场销售。因此,本研究以紫山药为原料,初步研究糖化酶对紫山药淀粉的酶解特性,在单因素试验的基础上,采用正交试验对其酶解工艺进行优化,并进行体外模拟消化分析,为系统了解紫山药淀粉在人体的消化过程及营养特性与制备紫山药饮料、保健酒等产品提供理论依据。
1 材料与方法
1.1 材料与试剂
紫山药品种为苏蓣1号,由江苏省农业科学院南京六合动物科学基地提供。
α-淀粉酶(酶活性为4 000 U/g)、糖化酶(酶活性为10万U/g),南京建安实业有限公司;氢氧化钠(分析纯),南京化学试剂股份有限公司;盐酸(分析纯),济南英出化工科技有限公司;胰酶[8×USP(美国药典)],Sigma公司。
1.2 主要仪器与设备
MJ-BL15U11破壁搅拌机,广东美的电器制造有限公司;DK-8D电子恒温水浴槽,上海精宏实验设备有限公司;FE20 pH计,梅特勒-托利多(上海)仪器有限公司;ML204电子分析天平,梅特勒-托利多(上海)仪器有限公司;LXJ-IIB離心机,上海安亭科学仪器厂;D-8紫外分光光度计,南京菲勒仪器有限公司;JJ500电子天平,常熟市双杰测试仪器厂;RE-6000A旋转蒸发器,上海亚荣生化仪器厂。
1.3 紫山药的糖化方法
将新鲜紫山药清洗,切片,用水蒸30 min,按料液比 1 g ∶ 4 mL 8混合打浆,得到紫山药浆液,通过响应面法优化得到最佳紫山药淀粉酶解条件:调节pH值为5.5,加入 23 U/g α-淀粉酶混匀,于75 ℃酶解77 min后冷却至室温,再根据试验之前设计的加酶量、pH值、温度、时间4个因素进行试验,糖化结束后再升温至100 ℃并保持5 min进行灭酶。
1.3.1 糖化单因素试验 分别考察不同糖化酶添加量(60、120、180、240、300 U/g)、反应体系的pH值(4.0、4.5、5.0、5.5、6.0)、反应温度(45、55、65、75、85 ℃)、酶解时间(30、60、90、120、150 min)对糖化的影响,结束后测定其还原糖含量[10]。
1.3.2 糖化正交试验设计 根据糖化单因素试验结果,选取影响糖化活性的糖化pH值、糖化温度、糖化酶添加量、糖化时间4个因素进行正交试验,因素和水平见表1。
1.4 紫山药淀粉体外消化模拟方法
体外模拟肠液的配制[11]:取5.4 g NaCl、0.65 g KCl、0.33 g CaCl2,分别用去离子水溶解后定容于1 L容量瓶中。称取7 g胰酶溶于100 mL水中,4 800 r/min离心10 min,取上清液待用。体外模拟肠液的制备:取90 mL胰酶溶液,加入90 mL肠电解质溶液,混合均匀,用1 mol/L NaHCO3调节pH值至7。
称取一定量的紫山药于用蒸馏水配制的10 g/100 mL悬浮液中,先在沸水中糊化0.5 h,静置至室温,再加入1/2体积的人工肠液,在38 ℃水浴锅中水浴180 min,每20 min取 5 mL 消化液于离心管中,立刻加入1 mL 0.2 mol/L Na2CO3溶液以终止消化,于4 500 r/min离心15 min,取上清液定容。测定上清液中的还原糖和可溶性糖释放率,计算方法分别参照式(1)、式(2):
还原糖释放率(以葡萄糖计)=m1/m×100%;(1)
可溶性糖释放率(以蔗糖计)=m2/m×100%。(2)
式中:m1为水解液中的还原糖质量,g;m2为水解液中的可溶性糖质量,g;m为样品中的淀粉质量,g。
2 结果与分析
2.1 不同糖化酶添加量对还原糖含量的影响
由图1可以看出,随着糖化酶添加量的增加,还原糖含量先增加后降低。当酶添加量达到180 U/g时,还原糖含量最高,继续提高酶的添加量,还原糖含量有所下降。由此可见,加大酶的用量可以加快糖化速度,缩短糖化反应时间,最终使糖度也会有所提高。但是,酶用量过高也会促进复合反应的发生,导致糖度降低[12]。
2.2 不同pH值对还原糖含量的影响
由图2可以看出,还原糖含量随着pH值的提高呈先升高后下降的趋势,当pH值为4.5时,达到最大值。pH值对糖化液的还原糖含量有较大影响,因为pH值会影响酶的稳定性,在最适pH范围以外时,酶活性会受到影响,促使糖化液还原糖含量发生变化。因此,在工业生产时应保持糖化液的pH值在最适范围内。
2.3 不同温度对还原糖含量的影响
由图3可以看出,当温度低于65 ℃时,还原糖含量随温度的升高而增大;当温度为65 ℃时,还原糖含量达到峰值;当温度超过65 ℃时,还原糖含量呈下降趋势。这是因为当温度在65 ℃以下时,酶的活性未被激发,而随着温度的升高,酶反应加快,当温度过高时,酶开始变性失活,从而又抑制了糖化反应的进行。
2.4 不同糖化时间对还原糖含量的影响
由图4可以看出,在糖化时间为90 min以内时,还原糖含量都是随糖化时间延长而增大的,但在90 min之后,还原糖含量下降并趋于平稳。在糖化初期,糖化速度很快,还原糖含量不断增加,达到最高值后,由于生成物的反馈抑制和酶的逐渐钝化,糖化速度逐渐减慢。糖化90 min后,糖化作用达到最高峰,还原糖含量不再上升,高峰期过后,由于复合反应的影响,还原糖含量反而下降。
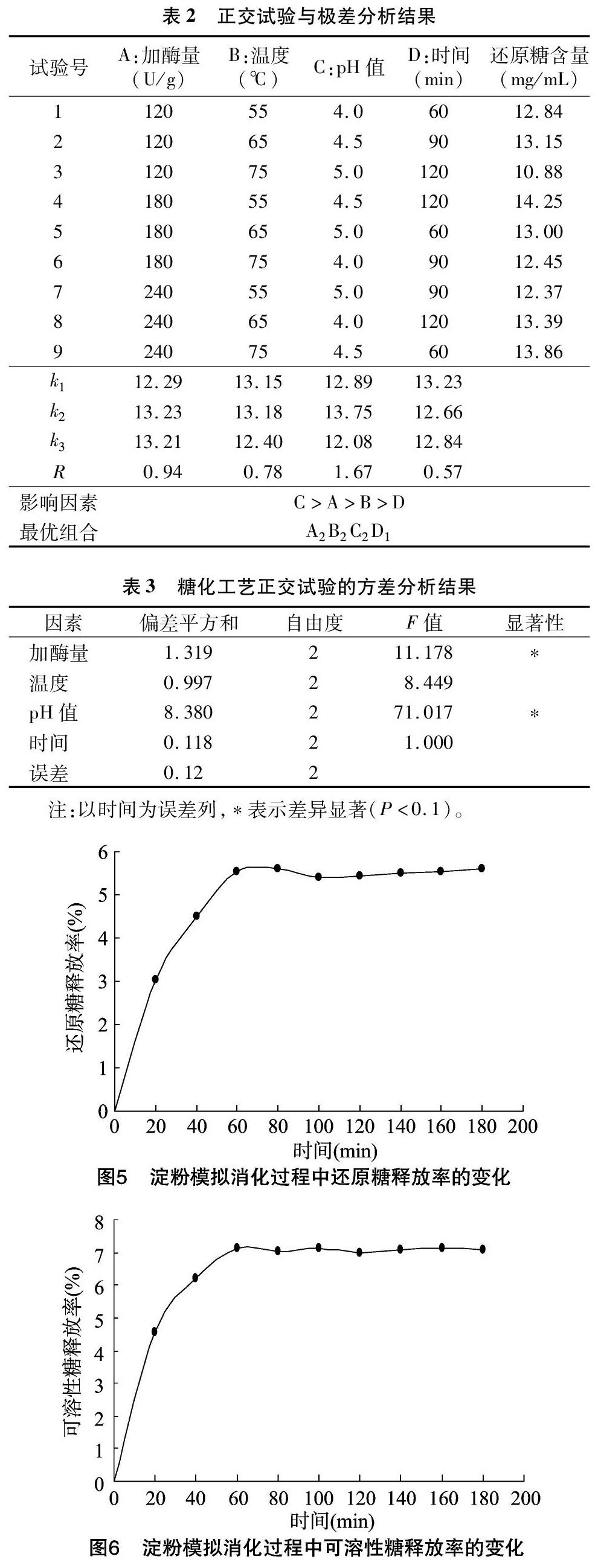
2.5 正交试验的优化工艺条件
由表2可以看出,各因素对紫山药淀粉糖化工艺的影响程度依次为C>A>B>D,即pH值是影响工艺的主要因素,其次是酶添加量、温度、时间,且糖化的最优工艺条件为A2B2C2D1。对正交试验数据进行方差分析,结果见表3。在糖化过程中,pH值和加酶量对还原糖含量影响显著,温度和时间对还原糖含量影响不显著,从时间周期方面综合考虑,糖化时间选择60 min。因此,确定糖化的最优工艺为A2B2C2D1,即酶添加量为180 U/g,温度为65 ℃,pH值为 4.5,时间为60 min。对此糖化工艺进行验证试验,得到还原糖含量为14.25 mg/mL。
2.6 紫山药体外模拟消化的结果与分析
由图5可以看出,在0~60 min时,还原糖释放率快速升高,60 min时还原糖释放率最高,此后还原糖释放率趋于平稳[13]。这是因为在水解初期,淀粉是结构较复杂的高分子化合物,很容易被胰淀粉酶水解其分子中的α-1,4葡萄糖苷键,所以水解速度较快[14]。但是随着淀粉链变短,酶作用底物的结合点也相应减少,且胰淀粉酶不能水解淀粉的α-1,6葡萄糖苷键,使水解速度迅速减慢。紫山药淀粉在模拟肠液消化过程中的还原糖释放率较低,主要原因在于模拟肠液中只有胰淀粉酶可以水解紫山药淀粉,产生糊精和糖,不能进一步水解,所以释放出较低含量的还原糖。
由图6可以看出,可溶性糖释放率随时间的变化与还原糖变化率基本一致,最高释放率也在处理60 min时,但可溶性糖的释放率稍高于还原糖的释放率。造成紫山药淀粉具有较低消化率的一个原因可能与紫山药淀粉中残余较多的植物多酚类物质有关[15],此类物质可以与多糖、蛋白质分子结合,从而影响其消化水解。
3 结论
本试验主要研究了紫山药的糖化工艺并进行了体外消化模拟分析,结果显示,pH值对紫山药淀粉的糖化有显著影响,各因素对紫山药淀粉糖化工艺的影响程度大小依次为pH值、酶添加量、温度、时间。最佳糖化工艺条件如下:糖化酶添加量为180 U/g,酶解温度为65 ℃,pH值为4.5,酶解时间为 60 min。在此条件下,紫山药淀粉的葡萄糖含量达 14.25 mg/mL。淀粉的体外消化模拟试验结果显示,紫山药淀粉在模拟肠液中的可溶性糖释放率和还原糖释放率较低,且远低于酶解过程,主要是因为模拟的肠液中只有胰淀粉酶可以水解紫山药淀粉,产生糊精和糖,其产物不能进一步水解。
参考文献:
[1]何圣米,潘广敏,汪芽芬. 紫山药丰产栽培技术[J]. 长江蔬菜,2011(1):12-13.
[2]李新华,董海洲. 粮油加工学[M]. 北京:中国农业大学出版社,2013:122-123.
[3]Rose D J,Inglett G E,Liu S X. Utilisation of corn (Zea mays) bran and corn fiber in the production of food components[J]. Journal of the Science of Food and Agriculture,2010,90(6):915-924.
[4]Wang T,Zhu Y D,Sun X H,et al. Effect of microfluidisation on antioxidant properties of corn bran[J]. Food Chemistry,2014,152(6):37-45.
[5]王 蕊. 山药的营养保健功能与贮藏加工技术[J]. 江苏食品与发酵,2006(3):34-36,38.
[6]张红霞. 山药栽培品种研究的进展[J]. 现代园艺,2015(4):35-36,37.
[7]张红雨. 低醇紫山药饮料的可控发酵及其营养成分分析[D]. 天津:天津商业大学,2014.
[8]王蔚新,付晓燕,程水明. 板栗酒生产中糖化工艺研究[J]. 中国酿造,2011,30(1):177-179.
[9]Duvernay W H,Chinn M S,Yencho G C. Hydrolysis and fermentation of sweetpotatoes for production of fermentable sugars and ethanol[J]. Industrial Crops & Products,2013,42(3):527-537.
[10]Blanquet S,Zeijdner E,Beyssac E,et al. A dynamic artificial gastrointestinal system for studying the behavior of orally administered drug dosage forms under various physiological conditions[J]. Pharmaceutical Research,2004,21(4):585-591.
[11]閔芳芳,聂少平,万宇俊,等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学,2013,34(21):24-29.
[12]丁小礼,扶明明. 杨梅果酒发酵过程主要理化指标变化规律研究[J]. 轻工标准与质量,2016(4):50-51.
[13]张 汆,魏兆军,袁怀波,等. 芡实淀粉的酶解特性及体外消化模拟分析[J]. 食品科学,2012,33(3):23-27.
[14]Rodríguezcabezas M E,Camuesco D,Arribas B,et al. The combination of fructooligosaccharides and resistant starch shows prebiotic additive effects in rats[J]. Clinical Nutrition,2010,29(6):832-839.
[15]张 汆,薛连海,贾小丽,等. D101树脂分离纯化芡实多酚的特性研究[J]. 食品科学,2009,30(20):260-264.
