饲料蛋白质水平对红螯螯虾幼虾生长、肌肉组成和酶活性的影响
2019-07-08鲁耀鹏张秀霞李军涛郑佩华王安利冼健安王冬梅
鲁耀鹏 张秀霞 李军涛 郑佩华 王安利 冼健安 王冬梅

摘要:为探讨红螯螯虾幼虾饲料的适宜蛋白质水平,配制6种不同蛋白质水平(24%、27%、30%、33%、36%和39%)的等脂等能饲料,饲喂体质量为(0.30±0.02) g的红螯螯虾幼虾8周,测定其生长性能、肌肉组成及肝胰腺酶活性。结果显示,饲料蛋白质水平对红螯螯虾幼虾的存活率没有显著影响;随着饲料蛋白质水平的升高,红螯螯虾幼虾的增质量率和特定生长率有升高的趋势,30%~39%饲料蛋白质组红螯螯虾的增质量率和特定生长率显著高于24%饲料蛋白质组。饲料蛋白质水平对红螯螯虾肌肉的粗蛋白、粗脂肪和粗灰分含量均无显著影响。随着饲料蛋白质水平的升高,肝胰腺中的胰蛋白酶活性呈现上升的趋势,30%~36%饲料蛋白质组红螯螯虾的胰蛋白酶活性显著高于24%饲料蛋白质组;饲料蛋白质水平对肝胰腺脂肪酶和淀粉酶活性均没有显著影响。随着饲料蛋白质水平的上升,红螯螯虾肝胰腺的总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)活性均呈现先上升后下降的趋势,30%~36%饲料蛋白质组红螯螯虾的T-AOC活性较高,30%、33%饲料蛋白质组红螯螯虾的SOD活性较高;饲料蛋白质水平对肝胰腺酸性磷酸酶(ACP)、碱性磷酸酶(AKP)活性均没有显著影响。由红螯螯虾的生长、胰蛋白酶活性和抗氧化能力可知,红螯螯虾幼虾饲料中的适宜蛋白质水平为30%。
关键词:红螯螯虾;饲料;蛋白质;生长性能;肌肉组成;免疫
中图分类号: S966.12 文献标志码: A 文章编号:1002-1302(2019)10-0181-05
红螯螯虾(Cherax quadricarinatus)别称澳洲淡水龙虾,原产于澳大利亚,隶属于甲壳纲十足目长尾亚目拟河虾科光壳虾属[1]。我国最早于19世纪90年代开始引进试养该虾,但是由于出苗率低、虾苗价格高等原因制约了其大规模养殖,并在对虾的养殖热潮下逐渐淡出了我国的水产养殖业。近年来,由于病害、种质退化等原因,对虾养殖的成功率低下,罗非鱼养殖业也遭遇利润低的问题,部分养殖户开始寻求新的养殖品种。红螯螯虾具有生长速度快、适应性强、出肉率高、价格高、肉质鲜美等优点,成为对虾和罗非鱼的主要替代品种之一,在海南、广东等地逐渐兴起养殖热。然而,红螯螯虾苗种和成虾的市场需求不断扩大,供不应求,具有广阔的养殖前景[2]。针对红螯螯虾营养需求已有少量的报道[3-9],但是目前红螯螯虾养殖仍然缺乏专用的人工配合饲料,容易造成养殖过程中红螯螯虾营养不均衡、生长缓慢、死亡率高等问题。
蛋白质是水产动物饲料最主要的营养成分之一,所占比例较高,价格也最高。适宜的饲料蛋白质水平不仅有利于水产动物的健康生长,减少污染排放,还可以节约饲料成本。国外学者对红螯螯虾饲料的适宜蛋白质水平做过研究[10-12],但这些研究的气候环境条件、饲料原料等与国内状况差异较大。国内学者虽然也对红螯螯虾饲料的适宜蛋白质水平做过研究[3-4],但仍有待完善与改进。吴志新等针对红螯螯虾生长性能的研究得出,体质量为2.35~3.84 g的幼虾的适宜蛋白质用量范围为30%~35%[3];蒋琦辰等虽然根据生长性能、消化酶和抗氧化酶活性等对蛋白质需求量作了较为全面的评价[4],但是样品量较少,存活率较低,有待进一步优化。另外,海南地处热带地区,气候条件特殊,红螯螯虾生长速度较快,其营养生理代谢状态可能有所不同。此外,近年来新引进的红螯螯虾的种质状况也不明确,因而很有必要针对目前新引进种质的饲料蛋白质适宜水平进行系统研究,以期为当前红螯螯虾在适应海南气候环境条件下的专用配合饲料的研制提供基础资料。
1 材料与方法
1.1 试验饲料
本试验配制6种不同蛋白质含量(24%、27%、30%、33%、36%和39%)的等脂等能饲料,饲料配方见表1。将饲料原料粉碎后过80目筛网,按照配方中的比例称取原料,加水、油混合后制粒,颗粒直径为1.5、2.0 mm,于60 ℃烘干后放入4 ℃冰箱中保存。
1.2 试验用虾及饲养管理
红螯螯虾幼虾购自海南省万宁市山根镇某虾苗厂。试验在海南省海口市中国热带农业科学院热带生物技术研究所的室内循环水养殖系统中进行,将红螯螯虾幼虾在试验的养殖环境条件下暂养1周,然后选择附肢完整、健康无患病并处于蜕皮期的幼虾540尾[平均体质量为(0.30±0.02) g]进行养殖试验,正式试验时间为2016年6—7月,饲养周期为8周。随机分为6组,每组3个重复,每个重复25尾虾。养殖箱规格为90 cm×60 cm×45 cm,每个养殖箱底部放置30个聚氯乙烯(PVC)管作为遮蔽物。养殖期间水温为27~31 ℃,pH值为78。每天饲料的投喂量为虾体质量的6%,按照实际摄食情况进行调整。每天分2次投喂,时间分别为07:00、18:00。
1.3 生长性能的测定
养殖试验结束时,测定红螯螯虾的存活率、增质量率和特定生长率,按以下公式进行计算:
存活率=终末虾数量/初始虾数量×100%;
增质量率=(终末体质量-初始体质量)/初始体质 量×100%;
特定生长率=100×(ln Wf-ln Wi)/T×100%。
式中:Wf为平均终末体质量;Wi为平均初始体质量;T为试验时间,d。
1.4 样品采集
对红螯螯虾进行计数并称质量后,取肝胰腺和肌肉,用液氮进行速冻后于-80 ℃保存备用。
1.5 饲料和肌肉的常规营養成分测定
采用凯氏定氮法(GB/T 6432—1994《饲料中粗蛋白测定方法》)测定饲料和肌肉中的粗蛋白含量;用索氏抽提法(GB/T 6433—2006《饲料中粗脂肪的测定》)测定粗脂肪含量;用灼烧法(550 ℃)测定粗灰分含量。
1.6 肝胰腺酶活性的测定
1.6.1 酶活性待测液的制备 将样品从-80 ℃冰箱中取出,在冰上解冻,然后加入9倍体积的生理盐水(0.85% NaCl),在冰浴中进行超声波匀浆(工作时间为3 s,间歇时间为5 s,工作次数为15次),于10 000 r/min离心10 min,取上清液待测。
1.6.2 酶活性的测定 肝胰腺的脂肪酶、淀粉酶、胰蛋白酶、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)的活性及总抗氧化能力(T-AOC)和蛋白质含量均采用南京建成生物工程研究所的试剂盒进行检测。
1.7 统计分析
结果表示为平均值±标准差(x±s),试验数据用SPSS 18.0进行单因素方差分析(One-Way ANVOA),P<0.05为差异显著。
2 结果与分析
2.1 饲料蛋白质水平对红螯螯虾生长性能的影响
试验结果显示,饲料蛋白质水平对红螯螯虾存活率没有显著影响,存活率范围为74.67%~81.33%。随着饲料蛋白质水平的上升,红螯螯虾的增质量率、特定生长率呈现提高的趋势(图1、图2)。24%饲料蛋白质组红螯螯虾的增质量率、特定生长率最低,分别为313.93%、2.53%;30%~39%饲料蛋白质组红螯螯虾的增质量率、特定生长率显著高于24%饲料蛋白质组红螯螯虾(P<0.05)。当饲料蛋白质水平在 30%~39%范围内时,各组间的增质量率和特定生长率没有显著差异。由增质量率回归曲线得出,最合适的蛋白质含量为36.98%(图3)。
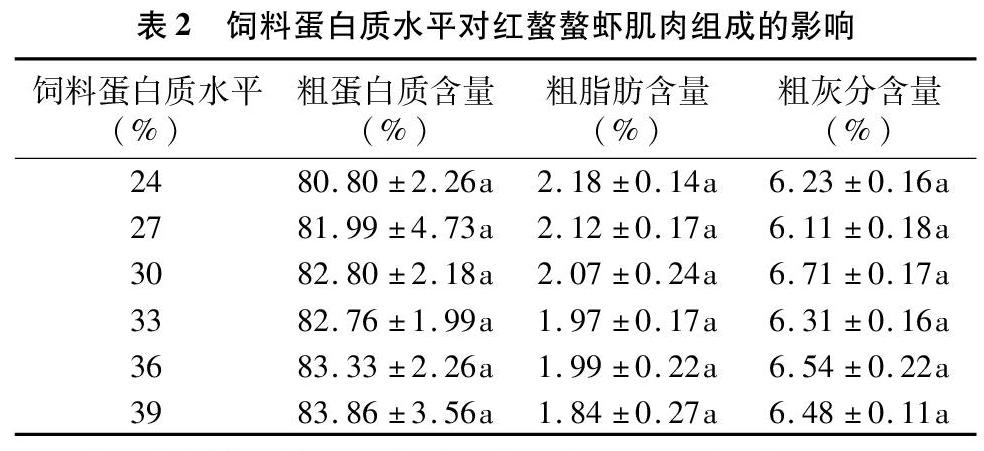
2.2 饲料蛋白质水平对红螯螯虾肌肉组成的影响
由表2可以看出,随着饲料蛋白质水平的增加,红螯螯虾肌肉的粗蛋白含量整体上有上升的趋势,而粗脂肪含量整体上有下降的趋势,但各组间的差异均不显著。
2.3 饲料蛋白质水平对红螯螯虾肝胰腺消化酶活性的影响
由图4可见,胰蛋白酶活性随饲料蛋白质水平的增加有升高的趋势;30%~36%饲料蛋白质组红螯螯虾的胰蛋白酶活性显著高于24%饲料蛋白质组的红螯螯虾(P<005);蛋白质水平为30%~39%时,各组间的胰蛋白酶活性没有显著差异(P>0.05)。由图5、图6可见,饲料蛋白质水平对肝胰腺的脂肪酶、淀粉酶活性均没有显著影响(P>005)。
2.4 饲料蛋白质水平对红螯螯虾肝胰腺免疫酶活性的影响
由图7、图8可以看出,随着饲料蛋白质水平的增加,红螯螯虾肝胰腺的T-AOC、SOD活性呈现先升高后下降的趋势,T-AOC、SOD活性均在蛋白质水平为30%时达到最大值,分别为5.88、2.61 U/mg;30%~36%饲料蛋白质组红螯螯虾的T-AOC活性显著高于24%组(P<0.05),30%、33%饲料蛋白质组红螯螯虾的SOD活性显著高于24%、27%饲料蛋白质组(P<0.05)。由图9、图10可知,饲料蛋白质水平对红螯螯虾肝胰腺的ACP、AKP活性均没有显著影响。
3 讨论
3.1 饲料蛋白质水平对红螯螯虾生长性能和肌肉组成的影响
本试验结果显示,随着饲料中蛋白质水平的提高,红螯螯虾的生长性能也逐渐升高,当饲料蛋白质水平达到30%以上时,生长性能没有进一步显著升高,表明30%的蛋白质含量已可满足红螯螯虾幼虾的生长需求。由回归曲线得出最适的蛋白质水平为36.98%,但是结合饲料成本考虑,饲料蛋白质含量以30%为宜。吴志新等针对生长性能得出了初质量为 2.35~3.84 g的红螯螯虾幼虾的饲料蛋白质含量的适宜范围为30%~35%[3]。Cortés-Jacinto等设计了以鱼粉为主要蛋白源的不同蛋白质含量饲料(20%~55%),结果显示,当饲料蛋白质水平在20%~31%时,生长性能显著上升;当饲料蛋白质水平在31%~43%之间时,生长性能没有显著差异;通过二次曲线回归得出,最适蛋白质水平为 34.2%[13],也与本研究得出的36.98%较为接近。 蒋琦辰等研究了蛋白质水平为20%~40%时对体质量为(0.33±0.07) g的幼虾生长的影响,结果显示,随着蛋白质水平的升高,特定生长率先升高后降低,该作者还认为,36%、40%蛋白质组的生长性能反而下降,可能是由豆粕添加量的提高造成的;以特定生长率作拟合曲线,得出最佳蛋白质水平为 27.8%[4],较本研究结果低 可能与不同养殖条件有关。Pavasovic等设置13%~32% 4种蛋白质水平的饲料,结果显示,当投喂蛋白质水平为25%时,红螯螯虾的生长性能最高[10]。Thompson等设置了22%、32%、42% 3种蛋白质水平的饲料,饲喂体质量为(4.6±2202) g的幼虾,结果显示,各饲料组螯虾的增质量率和特定生长率没有显著差异;另外,42%蛋白质组表现出更高的饲料转化率,但是存活率最低;该作者还对水体总氨氮和亚硝酸盐进行了检测,结果显示,42%蛋白质组的平均氨氮水平和亚硝酸盐水平显著升高,可能是造成该蛋白质水平下红螯螯虾存活率较低的主要原因[12]。上述研究结果存在一定的差异,可能与各自选用的虾龄、蛋白质水平设置、配方组成以及养殖条件等有关,有的研究设定的蛋白质水平梯度较少,有的研究的养殖存活率较低,均会对试验结果产生较大的影响。克氏原螯虾的研究较红螯螯虾成熟,同样作为杂食性的淡水螯虾,其幼虾的蛋白质需求量范围在24%~32%之间[14-18],与红螯螯虾较接近。
随着饲料蛋白质水平的增加,红螯螯虾肌肉中的蛋白质含量有增加的趋势,脂肪含量有下降的趋势,但是各饲料组的红螯螯虾肌肉蛋白质、脂肪和灰分含量均没有显著差异。Pavasovic等的研究结果显示,饲料蛋白质水平与红螯螯虾肌肉蛋白质含量呈正相关关系[10],这可能与该研究设置的13%低蛋白质水平有关,在本研究条件下,24%~39%的饲料蛋白质水平对红螯螯虾肌肉组分没有产生显著影响。关于克氏原螯虾的研究结果显示,饲料蛋白质水平对其肌肉组分产生了一定的影响,但是不同的研究结果也存在一定的差异。凌俊等的研究显示,26%~34%的饲料蛋白质含量对克氏原螯虾肌肉蛋白质含量没有显著影响,但是随着饲料蛋白质含量的提高,肌肉脂肪含量显著提高[19]。苏时萍等研究显示,当饲料蛋白质水平为45%时,可以显著提高克氏原螯虾肌肉蛋白质含量;当饲料蛋白质水平大于40%时,肌肉脂肪含量显著下降[20]。徐维娜等的研究显示,饲料蛋白质含量对克氏原螯虾肌肉蛋白質和脂肪含量有显著影响,饲料脂肪含量对肌肉脂肪含量有显著影响,且饲料蛋白质和脂肪水平之间存在交互作用[15]。于宁等的研究显示,饲料能量蛋白质比也会显著影响克氏原螯虾肌肉脂肪含量[21]。以上各研究结果存在较大差异,可能与各自不同的饲料组成、饲料蛋白质设置范围以及试验环境条件等多个方面有关。
3.2 饲料蛋白质水平对红螯螯虾消化酶活性的影响
本研究结果显示,饲料蛋白质水平对红螯螯虾肝胰腺胰蛋白酶活性有显著影响。随着饲料蛋白质水平的提高,胰蛋白酶活性也逐渐升高,在饲料蛋白质含量为33%~36%时胰蛋白酶活性达到了峰值。胰蛋白酶活性的变化趋势与增质量率具有相似性,表明适宜的蛋白质水平可能诱导了蛋白酶活性的提升,从而促进了蛋白质的消化吸收,进而提高了红螯螯虾的生长性能。蒋琦辰等的研究显示,胃蛋白酶活性随着饲料蛋白质水平的升高呈先升高后下降的趋势,在饲料蛋白质水平为28%、32%时,胃蛋白酶活性最高[4]。但该研究的36%、40%蛋白质组的饲料中添加了较多的豆粕,也可能是影响胃蛋白酶活性的重要原因。目前针对克氏原螯虾的研究较多,但各研究结果也存在较大的差异。何吉祥等设计了26%、29%、32% 3个蛋白质水平,结果显示,随着饲料蛋白质水平的提高,克氏原螯虾肝胰腺和胃的蛋白酶活性显著提高,但是肠蛋白酶活性没有显著变化[18]。徐维娜等的研究得出了不同的结果,结果显示,饲料的蛋白质水平(24%、27%、30%)仅对肠道蛋白酶活性产生显著影响[15]。苏时萍等设计了30%、35%、40%、45% 4个蛋白质水平,发现克氏原螯虾肠道蛋白酶、肝胰腺蛋白酶活性分别在饲料蛋白质水平为40%、35%时最高[20]。Pavasovic等设计了蛋白质含量分别为13%、18%、25%、32%的饲料,喂养体质量为(13.9±0.24) g的红螯螯虾,结果显示,蛋白酶活性与饲料的蛋白质水平呈正相关[10]。仅针对饲料蛋白质含量来探讨这些研究结果的差异,可能存在较大的片面性,加上上述研究的饲料配方也存在一定的差异,饲料的能量蛋白质比、鱼粉比例以及其他饲料组分都可能是影响消化酶活性的因素。本研究中,在24%~39%的饲料蛋白质水平范围内,提高飼料蛋白质水平可以明显提高红螯螯虾肝胰腺的胰蛋白酶活性,有利于蛋白质的消化吸收,促进生长。
3.3 饲料蛋白质水平对红螯螯虾免疫功能的影响
抗氧化系统是应对外界胁迫、清除过量活性氧以保护机体免受氧化损伤的重要工具。SOD是一种特异性消除 O-2 · 的循环酶,对组织的氧化胁迫起到重要的防御和保护的作用[22-23]。T-AOC则是反映机体总体抗氧化能力的重要指标,可以更全面地体现机体的抗氧化防御水平。本试验结果显示,饲料中蛋白质水平对红螯螯虾肝胰腺SOD和T-AOC活性均有显著影响,随着饲料蛋白质水平的提高,2种酶活性均呈现先升高后下降的趋势;SOD活性在30%、33%饲料蛋白质组中较高,而T-AOC活性在30%~36%饲料蛋白质组中较高,表明适宜的饲料蛋白质水平可以提高虾体的抗氧化能力,可能有利于提高虾体的抗胁迫能力。过低的饲料蛋白质水平由于导致总体营养水平不足,抗氧化酶的合成可能相对较少;过高的饲料蛋白质水平可能一方面导致虾体代谢过于旺盛,能量利用率较差,另一方面使消化系统负担较重,能量多用于供应消化系统,这些均可能导致供应抗氧化系统的组分和能量减少。虽然较高的饲料蛋白质水平对红螯螯虾的生长性能没有产生显著的负面影响,但是显然不利于其维持较高的抗氧化能力,以致可能影响其抗胁迫能力。因此,在探讨适宜的饲料营养水平时,除了生长性能外,还应全面考虑抗氧化活力等其他指标。本研究结果与一些鱼类的研究结果[24-25]相似,但与蒋琦辰等的研究结果[4]相反,其结果显示,红螯螯虾肝胰腺的另外2种抗氧化酶(过氧化氢酶和谷胱甘肽过氧化物酶)在饲料蛋白质水平过低或过高时,都呈现升高的状态。笔者认为,饲料蛋白质水平过低或过高会导致虾体处于轻度胁迫状态,体现出了“毒物兴奋效应”。产生不同结果的具体原因还有待进一步的研究。
磷酸酶是一种正磷酸单酯酶,根据其最适pH值的不同,可将其分为AKP和ACP。它们在蛋白质的去磷酸化和合成分解过程中起着重要的作用,也是动物体内解毒体系的重要组分[26]。本试验结果显示,各饲料组红螯螯虾肝胰腺的AKP和ACP活性均无显著差异,可能是由于螯虾处于非应激、无患病的正常生理状态时,AKP、ACP活性没有被诱导,表明在正常生理状态下,红螯螯虾肝胰腺的AKP、ACP活性在本试验条件下不会受到摄入的蛋白质水平的影响。
4 结论
本试验结果表明,饲料中蛋白质水平过低或过高可能会对红螯螯虾幼虾的生长性能、肝胰腺胰蛋白酶活性以及抗氧化能力产生一定的负面影响。综合红螯螯虾幼虾的生长性能、肝胰腺胰蛋白酶活性和抗氧化能力指标,并考虑尽量降低饲料成本,建议红螯螯虾幼虾最适的饲料蛋白质水平为30%。
参考文献:
[1]王友慧,叶金云. 红螯螯虾营养研究现状及展望[J]. 饲料研究,2004(7):38-41.
[2]李庆勇,高文峰,侯同玉,等. 澳洲淡水龙虾池塘健康养殖技术[J]. 中国水产,2017(6):90-92.
[3]吴志新,陈孝煊,罗宇良,等. 不同饵料蛋白质含量对红螯螯虾生长的影响[J]. 水利渔业,1998(4):22-23.
[4]蒋琦辰,冯晓庆,张呈祥,等. 饲料蛋白质水平对红螯螯虾生长、消化酶和抗氧化系统的影响[J]. 淡水渔业,2013,43(2):60-65.
[5]甘信辉. 脂类营养对雄性红螯光壳螯虾生长和生殖的影响研究[D]. 上海:华东师范大学,2010:15-29.
[6]郭占林,李嘉尧,甘信辉,等. 不同脂肪源对红螯光壳螯虾幼虾生长、消化酶活性及其肌肉生化组成的影响[J]. 中国水产科学,2010,17(5):996-1004.
[7]王冬冬,叶金云,王友慧,等. 饲料中不同磷水平对红螯螯虾幼虾生长和体组成的影响[J]. 上海海洋大学学报,2010,19(3):344-351.
[8]吴东蕾. 维生素C对红螯光壳螯虾生长及生长相关基因表达的影响[D]. 上海:华东师范大学,2015:13-27.
[9]朱欢喜,蒋琦辰,杨江华,等. 饲料中非蛋白能源物质对红螯光壳螯虾幼虾生长、生理、生化指标的影响[J]. 水产学报,2012,36(3):473-480.
[10]Pavasovic A,Anderson A J,Mather P B,et al. Influence of dietary protein on digestive enzyme activity,growth and tail muscle composition in redclaw crayfish,Cherax quadricarinatus(von Martens)[J]. Aquaculture Research,2007,38(6):644-652.
[11]Rodríguez-González H,Villarreal H,García-Ulloa M,et al. Evaluation of practical diets containing different protein levels on gonad development of female redclaw crayfish Cherax quadricarinatus[J]. Aquaculture Nutrition,2009,15(4):347-355.
[12]Thompson K R,Muzinic L A,Engler L S,et al. Effects of feeding practical diets containing various protein levels on growth,survival,body composition,and processing traits of Australian red claw crayfish (Cherax quadricarinatus) and on pond water quality[J]. Aquaculture Research,2015,35(7):659-668.
[13]Cortés-Jacinto E,Villarreal-Colmenares H,Civera-Cerecedo R,et al. Effect of dietary protein level on growth and survival of juvenile freshwater crayfish Cherax quadricarinatus (Decapoda:Parastacidae)[J]. Aquaculture Nutrition,2015,9(4):207-213.
[14]錢 坤,苗玉涛,张秀霞,等. 克氏原螯虾的营养需要与配合饲料研究进展[J]. 中国饲料,2015(23):30-33,37.
[15]徐维娜,刘文斌,沈美芳,等. 饲料中不同蛋白质和脂肪水平对克氏螯虾(Procambraus clarkii)生长性能、体组成和消化酶活性的影响[J]. 海洋与湖沼,2011,42(4):521-529.
[16]张家宏,王守红,寇祥明,等. 饲料中蛋白质和脂肪水平对克氏原螯虾生长的影响研究[J]. 江西农业学报,2012,24(8):88-93.
[17]王桂芹,赵朝阳,周 鑫,等. 饲料蛋白和能量水平对克氏原螯虾生长和蛋白质代谢的影响[J]. 华南农业大学学报,2011,32(2):109-112.
[18]何吉祥,丁凤琴,宋光同,等. 蛋白质水平及能量蛋白比对克氏原螯虾生长与蛋白酶活力的影响[J]. 水产科学,2009,28(12):741-744.
[19] 凌 俊,胡 王,江 河. 蛋白水平与构成对克氏原螯虾生长及肉质的影响[J]. 饲料研究,2012(8):61-63,75.
[20]苏时萍,施培松,杨启超,等. 饲料蛋白质水平对克氏原螯虾幼体消化酶活性和肌肉成分的影响[J]. 安徽农业大学学报,2009,36(2):231-235.
[21]于 宁,朱站英,冯文和,等. 克氏原螯虾饲料最适能量蛋白质比[J]. 动物营养学报,2014,26(4):1111-1119.
[22]Winston G W. Oxidants and antioxidants in aquatic animals[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1991,100(1/2):173-176.
[23]王宏伟,蔡端波,霍艳高,等. 对硫磷胁迫下锰对中华米虾SOD活性的影响[J]. 河北大学学报(自然科学版),2009,29(1):81-84.
[24]孙金辉,范 泽,张美静,等. 饲料蛋白水平对鲤幼鱼肝功能和抗氧化能力的影响[J]. 南方水产科学,2017,13(3):113-119.
[25]杨 弘,徐起群,乐贻荣,等. 饲料蛋白质水平对尼罗罗非鱼幼鱼生长性能、体组成、血液学指标和肝脏非特异性免疫指标的影响[J]. 动物营养学报,2012,24(12):2384-2392.
[26]张明明,王 雷,王宝杰,等. 凡纳滨对虾碱性磷酸酶和酸性磷酸酶基因的克隆、表达及盐度应答效应[J]. 海洋科学,2017,41(1):83-95.
