水稻花粉育性相关基因研究进展
2019-07-08马龙徐薇窦玲玲柯笑楠刘明月耿艳飞黄霞贾玉芳刘庆坡
马龙 徐薇 窦玲玲 柯笑楠 刘明月 耿艳飞 黄霞 贾玉芳 刘庆坡
摘要:花粉发育为水稻生殖发育不可或缺的过程之一,其育性高低对水稻育种以及经济产量具有重要意义。大量研究发现,水稻花粉发育是严格受基因表达调控的生物学过程。基于此,本文综述与水稻花粉育性相关的蛋白编码基因和调控性miRNA的研究现状,总结有关基因在调控水稻花粉育性方面的生物学功能及作用机制,并对该领域未来的发展趋势作出分析与展望,从而为水稻分子设计育种提供理论参考。
关键词:水稻;花粉发育;生殖发育;相关基因;miRNA;育种利用
中图分类号: S511.03 文献标志码: A 文章编号:1002-1302(2019)10-0042-05
水稻是世界性主要粮食作物之一,為全球50%以上人口提供食物,同时也是重要的单子叶模式植物之一[1],因此对水稻的不断深入研究具有重要理论和现实意义。随着人口数量的不断增长、生态环境的恶化、耕地面积的持续减少以及人们对食品安全的重视,在可预见的将来,粮食短缺及由此引发的其他问题将日益突显。因此,培育出优质、高产、抗逆性强的水稻新品种显得尤为重要,这要求研究者在了解水稻宏观表型变化的基础上更深入理解其分子调控机制等。基因组学育种及分子育种能够高效地对植物生理学、遗传学、生物技术及基因表达调控等研究进行有机整合,因此已成为解决当前问题的有效途径。鉴于基因组学育种主要通过转基因技术和分子标记技术等充分挖掘并利用有利基因[2],近几十年来大量调控不同农艺性状的相关基因被相继鉴定和克隆[3-4]。
水稻单产是受内在遗传和外部环境影响的综合性状,与植株器官形态构建、光合效率、矿质元素的高效利用以及授粉和授精过程、抗逆性等密切相关[5]。穗数、穗粒数、结实率和粒质量等是构成水稻稻谷产量的主要因素[6],其中穗数、穗粒数[7]、粒质量[8-10]和株型等水稻产量性状已被深入研究,且研究者已鉴定并克隆了许多相应的基因[11-12];而对水稻产量同样具有决定作用的结实率相关功能基因鉴定及调控水稻单产形成内在机制等方面的研究,进展相对比较缓慢[13]。迄今,已克隆到几个调控水稻结实率的重要基因,且其中多数基因参与了水稻花粉的发育进程[6,13-16]。例如通过促进花粉管生长正向调节水稻结实率的PTB1基因[13]以及通过促进花粉管伸长和调控胞内钙离子平衡提高水稻穗籽粒结实率的OsCNGC13基因[16]等。尽管如此,对于通过调控水稻花粉发育进而影响结实率的内在机制认识仍十分有限。此外,雄性不育的发现和利用为主要农作物的杂种优势利用提供了保障,其中杂交水稻的培育为世界粮食生产发挥了举足轻重的作用[17]。然而,杂交后代的结实率往往低于亲本,且已成为利用杂种优势进行水稻产量性状改良的一个主要瓶颈[13],因此对结实率相关基因的研究已成为水稻育种工作的主要热点之一,其中花粉育性作为结实率的决定因素之一,其相关研究备受关注。
在高等植物中,花粉发育是一个非常复杂的生物学过程。在一系列相关基因的协同作用下,小孢子母细胞在花粉囊中进行减数分裂产生小孢子,并进一步发育成花粉粒;当花粉囊裂开时,成熟的花粉粒被释放出来[18]。冯九焕等以籼稻品种IR36为材料,对水稻花粉发育过程及其药壁组织进行了系统观察,详细地描绘了其超微结构特征,并依据不同时期特点将水稻花粉发育过程划分为8个时期[19-20]。Itoh等也将该过程分成8个时期,其中前4个时期是花药孢子体发育时期,后4个时期是花粉发育时期[1,21]。在此基础上,后来的研究者进一步将水稻花药发育过程由原来的8时期细分为14时期[22-23],这些时期不同生物过程的循序渐进最终保证了花粉的完整发育。目前,基因表达调控机制等研究最深入的主要涉及水稻绒毡层和花粉壁等发育过程。基于此,本文主要综述当前与水稻花粉育性相关蛋白编码基因和miRNA的研究进展并初步阐释其在水稻花粉育性调控中的作用及机制,以期加深相关研究人员和育种工作者对花粉育性相关基因及生物学功能、调控途径等方面的认识,从而为相关基因的进一步育种利用等提供参考。
1 水稻花粉育性相关蛋白编码基因
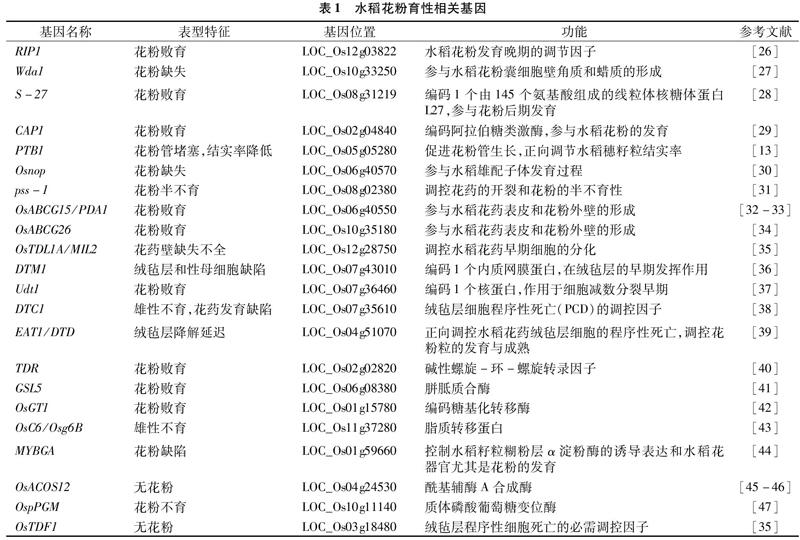
水稻的成熟花粉是由2或3个细胞组成的雄配子体,广义的花粉概念则包括从小孢子到成熟花粉的各个阶段[24],每个阶段都是在特定基因协作下完成的。任何参与花粉形成过程的基因发生突变,均可导致花药花粉异常,最终导致雄性不育[25]。近年来,随着研究的不断深入,研究者已陆续鉴定并克隆了多个与水稻花粉败育及花粉缺失等相关的功能基因(表1)。
1.1 花粉败育相关基因
花粉败育是指受内外环境因素影响导致花粉不能正常发育起到生殖作用的现象,其主要原因是花粉母细胞不能正常减数分裂以及绒毡层细胞作用失常。绒毡层细胞是花药发育过程中短暂存在的并位于花药最内层的细胞,它直接包裹着小孢子母细胞及分化后的小孢子[48]。绒毡层细胞的细胞质中富含线粒体、内质网、高尔基体等细胞器,代谢非常旺盛[49]。研究发现,绒毡层细胞的降解是一个细胞程序性死亡的过程,在此过程中会释放大量在绒毡层细胞内合成的物质,用于小孢子及其外壁的发育[40,50]。因而,绒毡层和花粉的发育是受一系列基因调控的复杂生理进程,时序上严格匹配。
1.1.1 绒毡层发育和PCD相关调控基因 目前,研究者利用突变体克隆了一些绒毡层发育相关基因,包括Udt1和TDR等。UDT1为bHLH转录因子,主要作用于细胞减数分裂早期,其T-DNA或Tos17插入突变体表现为雄性不育[37]。突变体udt1的绒毡层不能分化和液泡化,并且性母细胞不能分化成小孢子,中间层细胞不退化,因而花粉囊内不能产生正常花粉[51]。TDR也是bHLH类转录因子。在水稻花药发育过程中,TDR通过触发绒毡层PCD而调控花粉壁发育[40]。突变体tdr的绒毡层和中层降解延迟,花粉粒皱缩,且TDR可直接与2个下游基因OsCP1和OsC6互作[40],其中OsCP1编码一个半胱氨酸蛋白酶,在花药发育中发挥重要作用[51];OsC6是一个脂质转移蛋白基因,在水稻未成熟花药的绒毡层细胞中特异表达[43],该基因可通过抑制水稻乌氏体和花粉外壁发育而使其发生缺陷,并且降低花粉育性。Zhang等发现,TDR突变后还可导致花药表皮蜡质和花粉壁的形成异常[52-53]。进一步分析发现,TDR能结合OsADF基因启动子的E-box基序并调控其表达,进而通过参与ADF(花药发育相关的F-box蛋白)介导的蛋白水解途径调节绒毡层细胞的发育和花粉形成[54]。
水稻花药绒毡层细胞的程序性死亡是受一系列基因严格调控的过程。除正向调控因子TDR等外,Niu等克隆了1个在绒毡层细胞特异表达的bHLH类转录因子EAT1基因,该基因的突变体eat1表现为绒毡层降解延迟,不能形成正常的花粉粒,导致花药干瘪;深入研究发现,EAT1作用于TDR的下游,可通过直接调控天冬氨酸蛋白酶基因OsAP25和OsAP37的表达,促进植物绒毡层细胞的程序性死亡[39]。Yi等利用 T-DNA插入突变体鉴定到一个调控绒毡层PCD的基因DTC1,其突变体dtc1表现为雄性不育,花药发育缺陷,绒毡层增大不退化,中层降解延迟;进一步分析发现,DTC1可通过抑制OsMT2b的活性氧清除活性,调控绒毡层的PCD進程[38]。
1.1.2 花粉壁发育相关调控基因 花粉壁是花粉不可缺少的重要部分,也是花粉育性重要的决定因子之一。Ueda等从水稻Tos17插入突变体库中鉴定到一个花粉败育的突变体cap1,该突变体的杂合体有1/2的花粉粒发生干瘪畸变,且畸形花粉粒内所有的细胞质内充物、细胞核和内孢细胞壁几乎全部缺失,因而不能萌发;利用原位杂交等技术研究发现,CAP1主要在发育的花粉粒、绒毡层和药室内壁中表达;进一步分析发现,该突变体花粉粒畸变主要是由L-阿拉伯糖(L-arabinose)毒性积累所致或由UDP-L-arabinose(源于 L- 阿拉伯糖1-磷酸盐转变)缺乏而抑制细胞壁代谢造成[29]。此外,Moon等鉴定到一个主要在成熟花粉粒中表达的编码糖基化转移酶的基因OsGT1,其T-DNA插入突变体osgt1的花粉在减数分裂阶段正常但在成熟期活力丢失;进一步观察发现,该突变体的花粉内壁结构遭到破坏,且其淀粉、蛋白含量显著下降[42]。因此,花粉壁发育缺陷将导致水稻花粉育性降低。
1.1.3 其他基因 除了绒毡层和花粉壁发育相关基因外,人们利用花粉突变体还克隆到一些其他调控基因,比如rip1和Osabcg15。rip1是Han等从水稻T-DNA插入突变体库中筛选到的一个花粉特异突变体,其花粉中线粒体、高尔基体、脂肪体、质体和内质网的发育都表现为延迟;在体外培养条件下,该突变体的花粉不能萌发,而野生型对照的花粉萌发率>90%,表明RIP1基因是水稻花粉发育晚期的调节因子,是花粉成熟和萌发所必需的[26]。另外,Wu等利用籼稻恢复系缙恢一号获得一个不能产生有活力花粉的突变体Osabcg15,该突变体的花药短窄且白化,花药表皮异常、中层增大、乌氏体发育异常、绒毡层不完全退化、没有外壁,花粉粒收缩[32]。Niu等深入分析发现,OsABCG15可能在孢子花粉素合成或孢子花粉素从绒毡层细胞向花药室转移的过程中发挥关键作用[33]。
1.2 花粉缺失相关基因
除花粉败育外,花粉缺失是另一个影响水稻正常生殖发育的主要因素。Jung等曾鉴定到一个蜡质缺陷的花药突变体Wda1,该突变体所有细胞壁层的超长链脂肪酸合成受阻,花药外层的角质腊层缺失,小孢子的发育严重迟缓,导致花粉外壁的形成发生缺陷,最终造成花粉缺失[27]。同样地,Jiang等鉴定到一个无花粉突变体基因Osnop,该基因只在花粉发育和花粉管萌发时表达,因而控制水稻雄配子的发育[30],但是它在水稻花粉成熟时的具体调控机制尚不清楚。
此外,研究者还克隆了许多其他造成花粉缺失的相关基因。例如绒毡层PCD的必需调控因子基因OsTDF1[55]、绒毡层决定基因OsTDL1A[56]、控制水稻花器官尤其花粉发育及水稻籽粒糊粉层α淀粉酶活性的基因OsGAMYB[44]、调控水稻孢子花粉素合成并参与诱导绒毡层降解的酰基辅酶A合成酶基因OsACOS12[57-58]以及影响花粉发育过程中淀粉合成,进而影响花粉缺失的基因OsPGM[59]等,这些基因的发现与功能研究加深了人们对水稻花粉发育分子机制的了解。
2 水稻miRNA与花粉育性
miRNA是一类长20~24个核苷酸的内源单链非编码小分子RNA,通过与靶基因互补结合来介导mRNA的降解或在翻译水平上抑制其表达,进而调控植物的生长发育及环境适应性等[45]。例如,miRNA可参与调控水稻根系的生长发育[46]、水稻营养生长与生殖生长转换[47]以及水稻衰老期叶片发育[60]等不同生物学过程。
近年来,随着基因组学和生物信息学的迅猛发展,在不同物种中鉴定到越来越多的具有不同调控功能的miRNA。截至目前,在miRBase数据库中已注册有来自223个不同物种的28 645个前体miRNA(pre-miRNA),共表达35 828个成熟序列,其中从水稻基因组中鉴定到592个前体miRNA和713个成熟miRNA(http://www.mirbase.org,release 21)[61]。大量研究发现,同一miRNA在植物不同生长发育时期具有不同的表达模式,且在同一时期表达的miRNA也具有明显的多样性;miRNA与其作用靶基因组成调控网络参与植物生长发育的调节过程,进而在植物生命周期中发挥重要作用[62-64]。
花粉发育是开花植物生命周期中最重要的时期之一。近年来,随着高通量测序等技术的应用,有关miRNA参与调控水稻花粉发育的研究不断展开并取得一定进展。Wei等系统探究了水稻花粉发育过程中miRNA的表达情况,共鉴定到292个已知miRNA和75个新miRNA,其中202个已知miRNA在花粉发育过程有所表达,且其中103个的表达明显富集,而新鉴定的75个miRNA中半数以上在花粉发育中呈现出组织特异性或者在发育时期特异表达[65]。在比较同源四倍体和二倍体水稻花粉发育过程中miRNA的表达谱时,Li等发现,相对于二倍体,四倍体水稻有321个差异表达的miRNA,且同源四倍体水稻花粉和胚囊中miRNA的表达谱也截然不同,每个miRNA平均有3个与花粉发育有关的作用靶基因[66];此外,与转座因子相关的siRNA在四倍体水稻胚囊中上调表达,而在花粉发育过程中发生下调[67]。由此可见,miRNA可能确实参与了水稻花粉发育的生物学调控过程,但其与靶基因互作进而调控水稻花粉育性的内在分子机制等仍需进一步深入阐明。
杂交水稻的育种及大范围推广应用,对世界粮食供给作出了巨大贡献,因此对水稻杂交育种的研究始终是育种家的一个重要关注点。目前以细胞质雄性不育系(CMS)为基础的三系杂交和以细胞核雄性不育系为基础的两系杂交是杂交水稻的主要2种育种方式,其中雄性不育系的研究是水稻杂交育种的重点所在。在水稻中,miR156通过作用于靶基因SPL来参与水稻雄配子体的形成过程[68]。以水稻光周期/温敏性核雄不育系WuxiangS(WXS)为材料,Zhang等研究了其育性转换时期miRNA的表达模式,共鉴定出497个已知miRNA和273个新miRNA,在可育和不育WXS材料间共发现26个表达量存在显著差异的miRNA,其中11个表达量下调,15个表达量上调;进一步分析发现,水稻miR156a-j和miR164d等调控的靶基因多与花粉育性相关,表明miRNA确实参与了WXS花粉发育及育性转换进程;此外,在水稻不育材料WXS的育性转换期发现,miR5967与其靶基因(一种钙离子结合蛋白基因)互作,通过参与调控钙离子信号转导途径,在WXS育性转换过程发挥一定的调控作用[69]。
尽管近年来,人们已陆续发掘到一些与水稻花粉育性相关的miRNA,但在深入揭示其生物学功能及调控机制等方面进展十分缓慢。Zhou等发掘到一个与调控水稻光温敏雄性不育有关的miRNA——P/TMS12-1,在农垦58S和培矮64S中超量表达该miRNA可显著恢复其花粉育性;生物信息学分析显示,P/TMS12-1拥有10个潜在靶基因[70],但它到底与哪个(些)靶基因互作进而调控水稻花粉育性尚不清楚。总之,水稻育性是一个复杂的基因网络调控过程,其间参与的基因远远不止目前所发掘的。因此,要想充分理解水稻花粉育性的分子机制,仍需要在原有基础上进一步发掘新基因,并通过转基因技术等探明其生物学功能。
3 總结与展望
水稻花粉发育是一个连续的、复杂的生物学过程,该过程受一系列基因精细调控,涉及此过程的任何基因发生突变都将影响花粉的正常发育。近年来,研究者已陆续克隆了许多相关基因,并且对其相应功能进行了研究,其中包括花粉发育调控基因Wda1[30]、花粉半不育基因pss1[31,71]、花粉缺失基因Osnop[55]、花粉管堵塞基因PTB1[13]以及绒毡层相关基因OsTDL1A[56]、绒毡层发育调控基因Udt1[72]和TDR[40]等。尽管如此,人们对于花粉发育分子机制的认识仍很有限。例如,Deveshwar等以水稻花粉发育的4个不同时期(包括减数分裂前期、减数分裂期、单核细胞期和三核细胞期)为研对象,利用基因芯片和测序技术对其转录组进行分析,结果发现,至少22 000个基因在花粉发育不同时期有所表达,其中减数分裂期最多(18 090个),三核细胞期最少(15 465个);此外,通过比较水稻营养生长期和生殖生长期的基因表达情况发现,在花粉发育期特异表达的基因约有1 000个,但在上述发现的基因中约1/2的生物学功能未知[73]。表明对于水稻花粉发育的网络机制,仍有太多未知领域需进一步探索。此外,与水稻花粉发育相关miRNA的发掘及功能研究才起步不久,在花粉发育过程中miRNA自身的表达调控机制尚不清楚,其如何与靶基因互作以及如何影响其他miRNA和蛋白编码基因的表达等是充分理解花粉育性迫切需要解决的问题。随着高通量测序技术的发展以及基因编辑等技术的应用,越来越多的miRNA和蛋白编码基因的生物学功能将被逐步阐明,这必将为人们充分理解水稻花粉育性的调控机制奠定坚实基础。
参考文献:
[1]Itoh J,Nonomura K,Ikeda K,et al. Rice plant development:from zygote to spikelet[J]. Plant & Cell Physiology,2005,46(1):23-47.
[2]Lombardo L,Coppola G,Zelasco S. New technologies for insect-resistant and herbicice-tolerant plants[J]. Trends in Biotechnology,2016,34(1):49-57.
[3]Takeda S,Matsuoka M. Genetic approaches to crop improvement:responding to environmental and population changes[J]. Nature Reviews Genetics,2008,9(6):444-457.
[4]Varshney R K,Hoisington D A,Tyagi A K. Advances in cereal genomics and applications in crop breeding[J]. Trends in Biotechnology,2006,24(11):490-499.
[5]Zhang Q F. Strategies for developing green super rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16402-16409.
[6]Zhang K,Song Q,Wei Q,et al. Down-regulation of OsSPX1 caused semi-male sterility,resulting in reduction of grain yield in rice[J]. Plant Biotechnology Journal,2016,14(8):1661-1672.
[7]Ashikari M,Sakakibara H,Lin S,et al. Cytokinin oxidase regulates rice grain production[J]. Science,2005,309(5735):741-745.
[8]Wang Y X,Xiong G S,Hu J,et al. Copy number variation at the GL7 locus contributes to grain size diversity in rice[J]. Nature Genetics,2015,47(8):944-948.
[9]Si L Z,Chen J Y,Huang X E,et al. OsSPL13 controls grain size in cultivated rice[J]. Nature Genetics,2016,48(4):447-456.
[10]Wang S K,Li S,Liu Q,et al. The OsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality[J]. Nature Genetics,2015,47(3):949-954.
[11]Huang X Z,Qian Q,Liu Z B,et al. Natural variation at the DEP1 locus enhances grain yield in rice[J]. Nature Genetics,2009,41(4):494-497.
[12]Jiao Y Q,Wang Y H,Xue D W,et al. Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J]. Nature Genetics,2010,42(6):541-544.
[13]Li S C,Li W B,Huang B,et al. Natural variation in PTB1 regulates rice seed setting rate by controlling pollen tube growth[J]. Nature Communications,2013,4:2793.
[14]Kwon C T,Kim S H,Kim D,et al. The rice floral repressor Early Flowering 1 affects spikelet fertility by modulating gibberellin signaling[J]. Rice,2015,8(1):58.
[15]Lu G W,Coneva V,Casaretto J A,et al. OsPIN5b modulates rice (Oryza sativa) plant architecture and yield by changing auxin homeostasis,transport and distribution[J]. Plant Journal,2015,83(5):913-925.
[16]Xu Y,Yang J,Wang Y H,et al. OsCNGC13 promotes seed-setting rate by facilitating pollen tube growth in stylar tissues[J]. PLoS Genetics,2017,13(7):e1006906.
[17]胡 駿,黄文超,朱仁山,等. 水稻雄性不育与杂种优势的利用[J]. 武汉大学学报(理学版),2013,59(1):1-9.
[18]Ma H. Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants[J]. Annual Review of Plant Biology,2005,56:393-434.
[19]冯九焕,卢永根,刘向东,等. 水稻花粉发育过程及其分期[J]. 中国水稻科学,2001,15(1):21-28.
[20]卢永根,冯九焕,刘向东,等. 水稻(Oryza sativa L.)花粉及花药壁发育的超微结构研究[J]. 中国水稻科学,2002,16(1):30-38.
[21]谭何新,文铁桥,张大兵. 水稻花粉发育的分子机理[J]. 植物学通报,2007,24(3):330-339.
[22]Zhang D B,Luo X E,Zhu L. Cytological analysis and genetic control of rice anther development[J]. Journal of Genetics and Genomics,2011,38(9):379-390.
[23]Zhang D B,Wilson Z A. Stamen specification and anther development in rice[J]. Chinese Science Bulletin,2009,54(14):2342-2353.
[24]王 洋. 水稻育性突变体的筛选和育性相关基因OsMSH4及PSS1的克隆与功能研究[D]. 南京:南京农业大学,2013.
[25]Glover J,Grelon M,Craig S,et al. Cloning and characterization of MS5 from Arabidopsis:a gene critical in male meiosis[J]. Plant Journal,1998,15(3):345-356.
[26]Han M J,Jung K H,Yi G,et al. Rice immature pollen 1 (RIP1) is a regulator of late pollen development[J]. Plant & Cell Physiology,2006,47(11):1457-1472.
[27]Jung K H,Han M J,Lee D Y,et al. Wax-deficient anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development[J]. The Plant Cell,2006,18(11):3015-3032.
[28]Yamagata Y,Yamamoto E,Aya K,et al. Mitochondrial gene in the nuclear genome induces reproductive barrier in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(4):1494-1499.
[29]Ueda K,Yoshimura F,Miyao A,et al. COLLAPSED ABNORMAL POLLEN1 gene encoding the arabinokinase-like protein is involved in pollen development in rice[J]. Plant Physiology,2013,162(2):858-871.
[30]Jiang S Y,Cai M N,Ramachandran S. The Oryza sativa no pollen (Osnop) gene plays a role in male gametophyte development and most likely encodes a C2-GRAM domain-containing protein[J]. Plant Molecular Biology,2005,57(6):835-853.
[31]Zhou S R,Wang Y,Li W C,et al. Pollen semi-sterility1 encodes a kinesin-1-like protein important for male meiosis,anther dehiscence,and fertility in rice[J]. The Plant Cell,2011,23(1):111-129.
[32]Wu L A,Guan Y S,Wu Z G,et al. OsABCG15 encodes a membrane protein that plays an important role in anther cuticle and pollen exine formation in rice[J]. Plant Cell Reports,2014,33(11):1881-1899.
[33]Niu B X,,Fu F R,He M,et al. The ATP-binding cassette transporter OsABCG15 is required for anther development and pollen fertility in rice[J]. Journal of Integrative Plant Biology,2013,55(8):710-720.
[34]Zhao G C,Shi J X,Liang W Q,et al. Two ATP binding cassette G transporters,rice ATP binding cassette G26 and ATP binding cassette G15,collaboratively regulate rice male reproduction[J]. Plant Physiology,2015,169(3):2064-2079.
[35]Hong L L,Tang D,Shen Y,et al. MIL2(MICROSPORELESS2) regulates early cell differentiation in the rice anther[J]. New Phytologist,2012,196(2):402-413.
[36]Yi J,Kim S R,Lee D Y,et al. The rice gene DEFECTIVE TAPETUM AND MEIOCYTES 1 (DTM1) is required for early tapetum development and meiosis[J]. Plant Journal,2012,70(2):256-270.
[37]Jung K H,Han M J,Lee Y S,et al. Rice undeveloped tapetum1 is a major regulator of early tapetum development[J]. The Plant Cell,2005,17(10):2705-2722.
[38]Yi J,Moon S,Lee Y S,et al. Defective tapetum cell death 1 (DTC1) regulates ROS levels by binding to metallothionein during tapetum degeneration[J]. Plant Physiology,2016,170(3):1611-1623.
[39]Niu N N,Liang W Q,Yang X J,et al. EAT1 promotes tapetal cell death by regulating aspartic proteases during male reproductive development in rice[J]. Nature Communications,2013,4:1445.
[40]Li N,Zhang D S,Liu H S,et al. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J]. The Plant Cell,2006,18(11):2999-3014.
[41]Shi X,Sun X H,Zhang Z G,et al. GLUCAN SYNTHASE-LIKE 5 (GSL5) plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice[J]. Plant and Cell Physiology,2015,56(3):497-509.
[42]Moon S,Kim S R,Zhao G C,et al. Rice GLYCOSYLTRANSFERASE1 encodes a glycosyltransferase essential for pollen wall formation[J]. Plant Physiology,2013,161(2):663-675.
[43]Tsuchiya T,Toriyama K,Ejiri S,et al. Molecular characterization of rice genes specifically expressed in the anther tapetum[J]. Plant Molecular Biology,1994,26(6):1737-1746.
[44]Kaneko M,Inukai Y,Ueguchi-Tanaka M,et al. Loss-of-function mutations of the rice GAMYB gene impair α-amylase expression in aleurone and flower development[J]. The Plant Cell,2004,16(1):33-44.
[45]Tang J Y,Chu C C. MicroRNAs in crop improvement:fine-tuners for complex traits[J]. Nature Plants,2017,3(7):17077.
[46]Ma X X,Shao C G,Wang H Z,et al. Construction of small RNA-mediated gene regulatory networks in the Roots of rice(Oryza sativa)[J]. BMC Genomics,2013,14:510.
[47]Meng Y J,Shao C G,Wang H Z,et al. Construction of gene regulatory networks mediated by vegetative and reproductive stage-specific small RNAs in rice (Oryza sativa)[J]. New Phytologist,2013,197(2):441-453.
[48]李興旺. 水稻绒毡层细胞程序性死亡调控育性的分子机理研究[D]. 武汉:华中农业大学,2011.
[49]Bedinger P. The remarkable biology of pollen[J]. The Plant Cell,1992,4:879-887.
[50]Aya K,Ueguchi-Tanaka M,Kondo M,et al. Gibberellin modulates anther development in rice via the transcriptional regulation of GAMYB[J]. The Plant Cell,2009,21(5):1453-1472.
[51]Lee S,Jung K H,An G H,et al. Isolation and characterization of a rice cysteine protease gene,OSCP1,using T-DNA gene-trap system[J]. Plant Molecular Biology,2004,54(5):755-765.
[52]Zhang D S,Liang W Q,Yin C S,et al. OsC6,encoding a lipid transfer protein,is required for postmeiotic anther development in rice[J]. Plant Physiology,2010,154(1):149-162.
[53]Zhang D S,Liang W Q,Yuan Z,et al. Tapetum degeneration retardation is critical for aliphatic metabolism and gene regulation during rice pollen development[J]. Molecular Plant,2008,1(4):599-610.
[54]Li L,Li Y,Song S,et al. An anther development F-box (ADF) protein regulated by tapetum degeneration retardation (TDR) controls rice anther development[J]. Planta,2015,241(1):157-166.
[55]Cai C F,Zhu J,Lou Y,et al. The functional analysis of OsTDF1 reveals a conserved genetic pathway for tapetal development between rice and Arabidopsis[J]. Science Bulletin,2015,60(12):1073-1082.
[56]Zhao X A,de Palma J,Oane R,et al. OsTDL1A binds to the LRR domain of rice receptor kinase MSP1,and is required to limit sporocyte numbers[J]. Plant Journal,2008,54(3):375-387.
[57]Yang X J,Liang W Q,Chen M J,et al. Rice fatty acyl-CoA synthetase OsACOS12 is required for tapetum programmed cell death and male fertility[J]. Planta,2017,246(1):105-122.
[58]Li Y L,Li D D,Guo Z L,et al. OsACOS12,an orthologue of Arabidopsis acyl-CoA synthetase5,plays an important role in pollen exine formation and anther development in rice[J]. BMC Plant Biology,2016,16(1):256.
[59]Lee S K,Eom J S,Hwang S K,et al. Plastidic phosphoglucomutase and ADP-glucose pyrophosphorylase mutants impair starch synthesis in rice pollen grains and cause male sterility[J]. Journal of Experimental Botany,2016,67(18):5557-5569.
[60]Xu X B,Bai H Q,Liu C P,et al. Genome-Wide analysis of MicroRNAs and their target genes related to leaf senescence of rice[J]. PLoS One,2014,9(12):e114313.
[61]Kozomara A,Griffiths-Jones S. miRBase:annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acids Research,2014,42:D68-D73.
[62]Singh S,Parihar P,Singh R,et al. Heavy metal tolerance in plants:role of transcriptomics,proteomics,metabolomics and ionomics[J]. Frontiers in Plant Science,2015,6:1143.
[63]Li S X,Liu J X,Liu Z Y,et al. HEAT-INDUCED TAS1 TARGET1 mediates thermotolerance via heat stress transcription factor a1a-directed pathways in Arabidopsis[J]. The Plant Cell,2014,26(4):1764-1780.
[64]Shriram V,Kumar V,Devarumath R M,et al. MicroRNAs as potential targets for abiotic stress tolerance in plants[J]. Frontiers in Plant Science,2016,7:817.
[65]Wei L Q,Yan L F,Wang T. Deep sequencing on genome-wide scale reveals the unique composition and expression patterns of microRNAs in developing pollen of Oryza sativa[J]. Genome Biology,2011,12(6):R53.
[66]Li X,Shahid M Q,Wu J W,et al. Comparative small RNA analysis of pollen development in autotetraploid and diploid rice[J]. International Journal of Molecular Sciences,2016,17(4):499.
[67]Li X,Shahid M Q,Xia J,et al. Analysis of small RNAs revealed differential expressions during pollen and embryo sac development in autotetraploid rice[J]. BMC Genomics,2017,18:129.
[68]Yamaguchi A,Wu M F,Yang L,et al. The MicroRNA-Regulated SBP-Box transcription factor SPL3 is a direct upstream activator of LEAFY,FRUITFULL,and APETALA1[J]. Developmental Cell,2009,17(2):268-278.
[69]Zhang H Y,Hu J H,Qian Q,et al. Small RNA profiles of the rice PTGMS line wuxiang S reveal miRNAs involved in fertility transition[J]. Frontiers in Plant Science,2016,7:514.
[70]Zhou H,Liu Q J,Li J,et al. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel noncoding RNA that produces a small RNA[J]. Cell Research,2012,22(4):649-660.
[71]Li W,Jiang L,Zhou S,et al. Fine mapping of pss1,a pollen semi-sterile gene in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics,2007,114(5):939-946.
[72]Liu Z H,Bao W J,Liang W Q,et al. Identification of gamyb-4 and analysis of the regulatory role of GAMYB in rice anther development[J]. Journal of Integrative Plant Biology,2010,52(7):670-678.
[73]Deveshwar P,Bovill W D,Sharma R,et al. Analysis of anther transcriptomes to identify genes contributing to meiosis and male gametophyte development in rice[J]. BMC Plant Biology,2011,11:78.
