萝卜硫素对人胃癌SGC-7901细胞凋亡的影响及其机制研究
2019-06-21杨艳华梁丽琴
杨艳华, 梁丽琴
1.恩施土家族苗族自治州中心医院消化内科,湖北 恩施 445000; 2.恩施市中心医院消化内科
在消化道恶性肿瘤中胃癌的发病率和死亡率较高,对人类的身体健康也造成严重威胁。胃癌的发病率在恶性肿瘤中占第5位,而致死率则位于第3位[1-2]。流行病学统计发现我国每年新增40万例胃癌患者,占世界总人数的4.2%,对我国医疗工作者、患者带来沉重压力[3-4]。虽然医疗科技不断革新、肿瘤治疗的手段不断改进,但胃癌患者死亡率仍然较高,其中5年存活率不到30%[5]。目前,化疗是晚期胃癌患者主要的干预手段,然而化疗药物作用的有限性及带来明显的毒副作用严重影响患者的生存质量[6]。寻找新的治疗胃癌的药物是当前亟需解决的问题。萝卜硫素(Sulforaphane)主要来源于十字花科蔬菜,属于一种异硫氰酸酯类化合物[7],前期研究已发现萝卜硫素能够预防、延缓及改善肿瘤出现之前的病理改变,而且还表现出较强的抗肿瘤活性[8]。近期也有相关研究发现萝卜硫素对胃癌细胞增殖具有抑制作用[9],但其作用机制还不明确。于是,本文体外研究了萝卜硫素对胃癌SGC-7901细胞增殖、凋亡、周期的影响,还探讨了萝卜硫素诱导SGC-7901细胞凋亡的分子机制。
1 材料及方法
1.1 药物及试剂萝卜硫素(杭州林格贝公司,批号:3602-41-37,纯度≥98%);DMEM高糖培养基及质量浓度为2.5 g/L胰酶(卡迈舒生物公司);胎牛血清(美国Gibco公司,批号:110524);CCK-8试剂盒(上海纪宁公司,批号:WH1175);Annexin V-FITC/PI凋亡试剂盒(BD公司,批号:KGA107);BCA试剂盒(上海威奥生物科技有限公司,批号:WB0123);SDS-PAGE试剂盒(武汉谷歌生物有限公司,批号:P1320);兔抗人Notch1、Hes1、Bcl-2、Bax及β-actin单克隆一抗(美国Sigma公司),HRP标记山羊抗兔IgG(武汉谷歌生物科技有限公司)。
1.2 仪器150i型CO2培养箱、MSC1.2型生物安全柜(美国Thermo公司);EnSpire多功能酶标板分析仪(美国PerkinElmer公司);Mini-protean TetraSystem型垂直电泳、ChemiDoc XRS+型凝胶成像系统(美国Bio-Rad公司);CytoFLEX流式细胞仪(贝克曼公司)。
1.3 胃癌细胞株培养SGC-7901细胞购自上海中科院细胞库,采用质量浓度为100 g/L胎牛血清的DMEM培养基培养,培养箱条件为37 ℃恒温、体积分数为5% CO2,采用对数生长期细胞进行后续实验。
1.4 CCK-8检测SGC-7901细胞增殖把对数期细胞制备成单细胞悬液(5×104ml-1)后,接种至96孔板中,每孔200 μl。细胞培养过夜后,每孔加入含不同浓度(0、15、30、60、100 μg/ml)萝卜硫素的培养液200 μl,对照组加入等量的DMEM培养液,继续孵育24、48、72 h后,加入CCK-8溶液10 μl反应2 h后,酶标仪检测450 nm波长处的吸光度值(A),计算细胞增殖抑制率。细胞增殖抑制率(%)=1-药物组(A)/对照组(A)×100%。
1.5 流式细胞仪检测SGC-7901细胞周期把对数期细胞制备成单细胞悬液(2×105ml-1)后,接种至6孔板中培养24 h后,加入含不同浓度(0、30、60 μg/ml)萝卜硫素的培养液2 ml,24 h后吸去培养液上清,PBS清洗2次,用不含乙二胺四乙酸(EDTA)的胰酶消化收集细胞。PBS清洗2次后,在70%冷乙醇固定后进行碘化丙啶染色,流式细胞仪检测细胞周期。
1.6 流式细胞仪检测SGC-7901细胞凋亡按照“1.5”项处理细胞后,将细胞收集至离心管中,PBS清洗2次,加入500 μl的Binding Buffer悬浮细胞后进行Annexin V-FITC/PI双染色。具体操作如下:首先在避光环境下加入Annexin V-FITC染料孵育15 min,在同一条件下加入PI染料孵育30 min,用流式细胞仪检测细胞凋亡。
1.7 Western blotting检测SGC-7901细胞中Notch1、Hes1、Bax及Bcl-2蛋白表达按照“1.5”项处理细胞后,将细胞收集于冰上裂解30 min,15 000 r/min、4 ℃条件下离心12 min,取上清,采用BCA试剂盒检测蛋白浓度。每孔上样50 μg进行凝胶电泳(电压70 V,电泳3 h),转膜条件为恒流275 mA、80 min。质量浓度为50 g/L脱脂牛奶封闭膜1 h,加入一抗溶液(稀释比1∶1 000),采用TBST洗膜3次后室温下加入二抗溶液(稀释比1∶3 000)反应1.5 h,TBST洗膜3次,每次10 min,ECL显色后进行曝光。
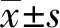
2 结果
2.1 萝卜硫素对SGC-7901细胞增殖的影响采用不同剂量(0、5、15、30、60、100 μg/ml)的萝卜硫素干预SGC-7901细胞24、48、72 h后,对细胞增殖抑制率检测结果如图1所示。相同时间范围内,不同剂量的萝卜硫素对SGC-7901细胞的增殖抑制率随剂量升高而增大,差异有统计学意义(P<0.05)。在同一剂量的萝卜硫素,对SGC-7901细胞的增殖抑制活性随时间延长而增高,差异有统计学意义(P<0.05)。
2.2 萝卜硫素对SGC-7901细胞周期的影响采用流式细胞仪分析SGC-7901细胞在不同剂量的萝卜硫素干预24 h后细胞周期的情况。结果提示,0、30、60 μg/ml的萝卜硫素干预24 h后处于G1期细胞比例差异有统计学意义(P<0.05),表现出剂量依赖性(见图2、表1)。


注:与对照组比较,*P<0.05。
2.3 萝卜硫素对SGC-7901细胞凋亡的影响采用流式细胞仪分析SGC-7901细胞在不同剂量的萝卜硫素干预24 h后细胞凋亡的情况。结果发现,0、30、60 μg/ml的萝卜硫素干预24 h后SGC-7901细胞凋亡率分别为(2.43±0.07)%、(18.5±2.3)%和(33.7±2.6)%,差异有统计学意义(P<0.05)(见图3)。

图2 萝卜硫素对SGC-7901细胞周期的影响 Fig 2 Effect of Sulforaphane on the cell cycle of SGC-7901 cells

图3 萝卜硫素对SGC-7901细胞凋亡的影响 Fig 3 Effect of Sulforaphane on the apoptosis of SGC-7901 cells
2.4 萝卜硫素对SGC-7901细胞中Notch信号通路的影响采用Western blotting方法检测了SGC-7901细胞中Notch信号通路相关蛋白。结果提示,0、30、60 μg/ml的萝卜硫素干预SGC-7901细胞24 h后,Notch1、Hes1及Bcl-2蛋白表达水平随着萝卜硫素剂量升高而降低,而Bax表达水平随萝卜硫素剂量升高而升高,Bcl-2/Bax比例降低,与对照组相比,差异均有统计学意义(P<0.05)(见图4、表2)。

图4 萝卜硫素对SGC-7901细胞Notch信号通路的影响 Fig 4 Effect of Sulforaphane on the Notch pathway of SGC-7901 cells

分组Notch1Hes1BaxBcl-2对照组0.52±0.050.28±0.040.14±0.020.34±0.0330 μg/ml萝卜硫素0.33±0.04∗0.11±0.02∗0.26±0.03∗0.23±0.03∗60 μg/ml萝卜硫素0.16±0.02∗0.06±0.01∗0.44±0.04∗0.07±0.01∗
注:与对照组比较,*P<0.05。
3 讨论
胃癌对人类健康带来严重威胁,但治疗胃癌的药物疗效非常有限,主要包括铂类及氟尿嘧啶类药物、紫杉醇类药物及基因靶向药物等[10]。有研究提出,萝卜硫素对胃癌细胞增殖具有抑制作用,有望成为胃癌的辅助药物[9]。由于多种抗肿瘤药物通过诱导细胞凋亡而发挥作用,本实验观察萝卜硫素对胃癌SGC-7901细胞凋亡及分裂周期的影响,并对其作用的分子机制进行初探。
采用不同剂量的萝卜硫素(0、30、60 μg/ml)干预SGC-7901细胞后,发现萝卜硫素对SGC-7901细胞的抑制活性随着剂量升高而增高;在同一剂量下,随着作用时间延长,萝卜硫素对SGC-7901细胞的抑制活性随之增强。可以得出萝卜硫素对胃癌SGC-7901细胞有明显的抑制作用,还表现出剂量和时间依赖性。进一步利用流式细胞仪分析萝卜硫素对SGC-7901细胞周期和凋亡率的影响,发现药物处理细胞24 h后,萝卜硫素表现出对SGC-7901细胞凋亡具有显著的诱导作用,主要诱导细胞发生G1期阻滞。
Notch信号通路在遗传进化上高度保守,参与介导细胞增殖、凋亡、分化等过程,并与多种癌症的发生、发展密切相关,具有促癌或抑癌作用[11]。在正常黏膜中不仅有Notch蛋白的表达,其通路中相关分子还参与了胃癌的发生、发展[12]。早期研究报道Notch信号过度激活能够促使胃癌的恶化,而对其进行抑制则会改善胃癌的症状[13]。本实验检测结果显示,萝卜硫素能够抑制胃癌SGC-7901细胞中Notch信号通路Notch1及下游靶基因Hes1蛋白的表达。Notch信号通路的活化能够导致下游凋亡相关蛋白表达的改变,包括促凋亡蛋白Bax及抗凋亡蛋白Bcl-2[14]。其中,作为一种抗凋亡相关蛋白,Bcl-2的高表达可以抑制肿瘤细胞凋亡;而Bax是一种同属于Bcl-2家族的促凋亡相关蛋白,Bax的高表达能够诱导肿瘤细胞凋亡[15]。Bcl-2与Bax在细胞内能够相互作用形成复合物,进而相互制约彼此发挥对细胞凋亡的调节作用,于是Bcl-2与Bax比例影响着肿瘤细胞凋亡的走向。本实验发现,萝卜硫素能够抑制胃癌SGC-7901细胞中抗凋亡蛋白Bcl-2表达、诱导促凋亡蛋白Bax表达,进而降低了Bcl-2/Bax比例,促使胃癌细胞向凋亡方向发展。早期也有研究报道萝卜硫素能够上调Bax蛋白表达、抑制Bcl-2蛋白表达,降低Bcl-2/Bax比例,进而诱导前列腺癌细胞的凋亡[16]。总之,萝卜硫素可以明显诱导胃癌SGC-7901细胞凋亡,可能通过抑制Notch1/Hes1信号通路、降低Bcl-2/Bax比例实现。
