解磷菌的分离、筛选、鉴定及解磷能力研究
2019-06-11上官亦卿常帆吕睿齐凡贾凤安王艳丁浩
上官亦卿 常帆 吕睿 齐凡 贾凤安 王艳 丁浩

摘要:为开发高效微生物解磷肥,利用解磷菌选择培养基(蒙吉娜卵磷脂培养基)从陕西省西安市周至县猕猴桃园农田土壤中分离出11株解磷菌,通过纯化培养,筛选出1株高效解磷菌JYP9。利用16S rDNA基因序列分析方法对该菌株的分类信息进行鉴定,鉴定结果表明该菌株为假单胞菌(Pseudomonas extremorientalis)。并用解磷圈法和液体摇瓶培养法,分别以卵磷脂为惟一磷源,确定了该菌株的最适培养温度为26 ℃、最适转速为200 r/min、最适起始pH为7和最适起始接种量为2%。
关键词:解磷菌;筛选;鉴定;最适条件
中图分类号:S154.39 文献标识码:A
文章编号:0439-8114(2019)01-0030-05
DOI:10.14088/j.cnki.issn0439-8114.2019.01.007 开放科学(资源服务)标识码(OSID):
Isolation,Screening,Identification and Phosphate Solubilizing Ability of Phosphate Solubilizing Bacteria
SHANGGUAN Yi-qing1,2,CHANG Fan2,LYU Rui2,QI Fan1,JIA Feng-an2,WANG Yan2,DING Hao2
(1.Shaanxi Academy of Sciences,Xian 710043,China;
2.Microbial Metabolism Research Center,Shaanxi Province Institute of Microbiology,Xian 710043,China)
Abstract: In order to develop an efficient microbial fertilizer solution, 11 strains from the farm-land soil of actinidia park in Zhouzhi county, Shaanxi prvince, were isolated, using phosphate volubility bacteria selective culture medium (Mongolia lecithin culture medium). A strain of phosphate volubility bacteria JYP9 was screened through purification cultivar. And classification information of this strain was identified by using 16S rDNA gene sequence analysis, the results showed that the strain was a Pseudomonas extremorientalis. Then the phosphate solubilizing method and the liquid shake flask method were used in the experiment to confirm the optimum cultivation condition of JYP9 with lecithin as the only phosphorus source. The results showed that the optimal temperature was 26 ℃, optimal rotational was 200 r/min, optimal pH was 7, and optimum initial inoculation amount was 2%.
Key words: phosphate solubilizing bacteria; screen; identify; optimum condition
磷是植物生长所需的一种主要营养元素,但植物对土壤中的磷元素利用率很低,严重影响着植物的生长[1]。有机磷是土壤磷的重要组成部分,一般占土壤全磷的20%~50%,其中植酸磷占有机磷的10%~50%[2],是土壤有机磷的主要存在形式。解磷菌能将植物难以吸收利用的难溶性或不溶性磷转化为可利用的形态,提高土壤中磷素的利用效率,减少化学肥料的施用,降低农业投入成本。因此,对土壤环境进行微生物修复是提高作物产量、解决土壤速效磷缺乏的重要途径之一[3,4]。
存在于土壤中的根际细菌、内部共生细菌被认为是最有效的解磷微生物,它們能够利用自身的代谢物质[5]、通过NH4+同化作用[6]或释放H2S[7]将被土壤固定的无效态磷释放出来。这些细菌能够将被土壤固定的矿物态磷释放出来,但是其在植物根际的数量不足以与其他微生物竞争,难以挥发其活性,因此筛选出具有高效溶磷能力的菌株,并将其添加到生物有机肥中,以供给作物充足的磷素显得尤为重要。中国对解磷细菌的研究起步于20世纪50年代,研究人员从东北黑土和灰化土中分离出具有解磷功能的巨大芽孢杆菌[8]。现在对溶磷菌的研究主要集中于溶解无机磷菌株的筛选方面[9-11],对于土壤难溶性有机磷解磷菌的研究却鲜有报道[12]。本研究选择一种有机磷培养基(蒙吉娜卵磷脂培养基),以卵磷脂作为惟一磷源,通过选择性培养从猕猴桃大田土壤中分离出11株解磷细菌,并通过分离、纯化、复筛,得到一株解磷能力较强的细菌 JYP9,研究该菌株的生理生化特征及对卵磷脂的降解特性,确定菌株的最适初始接种量、最适pH、最适生长温度及最佳转速对解磷能力的影响,旨在确定该菌株的生长情况及解磷能力,为开发新的成本低、效果好且不污染环境的解磷菌,充分利用土壤中的磷素资源提供科学依据,对发展绿色农业具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 土样 土壤样品采集自陕西省西安市周至县猕猴桃园,釆集方法为五点采样法,去除表层土壤,用土钻取深度为0~20 cm的土壤,将5个不同点的土样混合为1份,装入无菌样品采集袋,标签注明采样信息,放入4 ℃冰箱保存。
1.1.2 样品 市购卵磷脂。
1.1.3 培养基 ①分离培养基[13,14]。蔗糖5.0 g,KH2PO4
0.5 g,MgSO4·7H2O 0.5 g,CaCO35 g,琼脂20 g,去离子水1.0 L,pH 7.2~7.5,121 ℃灭菌20 min。②蒙吉娜卵磷脂培养基[15](有机磷细菌培养基)。蔗糖(葡萄糖)10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O(微量)0.03 g,NaCl 0.3 g,MnSO4·7H2O(微量)0.03 g,CaCO35.0 g,卵磷脂1.0 g(卵磷脂用时先溶于75%乙醇中),去离子水1 L,琼脂18~20 g, pH 7.2~7.4。③牛肉膏蛋白胨培养基。牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,去离子水1 L,固体培养基加琼脂 15~20 g。
所有培养基均置于0.05 MPa灭菌锅中灭菌20 min后进行试验。
1.1.4 种子液 从保存培养基上挑取菌种接种至150 mL有机磷液体培养基中的三角瓶中,放置于28 ℃、200 r/min的摇床上培养24 h。
1.1.5 其他溶液
1)17.5 mol/L硫酸钼锑储存液。取去离子水400 mL,放入1 L烧杯中,将烧杯浸入冷水中,之后注入分析纯浓硫酸208 mL,并不断搅拌,冷却至室温。分析纯钼酸铵20 g溶于200 mL去离子水,将硫酸溶液缓慢倒入钼酸铵溶液中,并不断搅拌,再加入100 mL 5 g/L(0.5 g)酒石酸锑钾溶液,去离子水定容至1 L,摇匀,保存。100 mL储液加入1.5 g抗坏血酸(VC)组成钼锑抗显色剂(现配现用)。
2)磷标准储备液。准确称取经105 ℃下烘干2 h的磷酸二氢钾(GB1274,优级纯)0.439 0 g,用水溶解后,加入5 mL浓硫酸,加水定容至1 L,该溶液含磷100 mg/L,放于冰箱可供长期使用。
1.2 方法
1.2.1 解磷菌的富集 取3只250 mL锥形瓶,各装入含无机盐液体培养基100 mL,向锥形瓶中分别加入1 g土壤样品,摇床培养3 d(温度28 ℃,转速200 r/min),吸取锥形瓶底部菌液进行转接,富集解磷菌,每次转接前将菌液涂布到平板上计数。
1.2.2 解磷菌的初筛 将富集培养基中的菌种转接到含卵磷脂培养基的平板上,置于30 ℃恒温培养箱中,出现菌落后,挑取单菌落转接至新的固体培养基上,重复上述操作3次,将单菌落放入冰箱保存备用。
1.2.3 解磷菌的复筛 将初筛出的菌株转接到装有100 mL卵磷脂液体培养基中,恒温培养3 d,涂布,记录菌数,同时测量溶磷圈的大小,选取溶磷圈大的菌株为目标菌。
1.2.4 菌株形态学及生理生化特征 将分离纯化得到的菌株在固体平板上进行划线培养,在温度为30 ℃的条件下培养2 d,观察菌株生长状况及菌落特征。
1.2.5 菌株16S rDNA序列分析及比对 选用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492R(5′-GGTTACCTTGTTACGAC TT-3′)建立PCR扩增体系进行扩增。PCR 反应体系(50 μL)为5×One Taq Standard Reaction Buffer 10 μL,10 mmol/L dNTPs 1 μL,10 μmol/L Forward Primer 1 μL,10 μmol/L Reverse Primer 1 μL,One Taq DNA Polymerase 1 μL,Template DNA 2.0 μL,Nuclease-Free Water 34 μL。擴增程序为94 ℃预变性10 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃后延伸10 min。产物经纯化后测定基因序列, 利用 BLAST将菌株的基因序列与 GenBank数据库中的序列进行比较,选取相似性较高的模式菌株序列,用MEGA5.1中Neighbor-Joining法比较同源性,构建系统发育树。
1.2.6 菌株解磷能力测定 配制解磷培养基(无磷),按50 mL每瓶分装于250 mL锥形瓶中,各加入0.1 g准确称取的卵磷脂,在121 ℃条件下灭菌20 min,每个锥形瓶接入2%待测菌悬液,30 ℃条件下摇床培养5 d,培养液倒入离心管配平,10 000 r/min离心5 min,取上清液10 mL,加入显色剂5 mL,定容至50 mL,最后放置30 min,进行反应后(抗锑比色法[12])测定上清液中速效磷含量。
1)标准曲线的测定。将配好的磷标准储备液吸取0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL到20 mL的玻璃管中,然后吸取5 mL显色剂到玻璃管中,最后都定容到20 mL,反应30 min后,进行速效磷含量的测定。
2)最适生长温度测定。按2%接种量将菌株接入培养液中,调节pH为7将菌种接于解磷液体培养基中,分别置于温度为24、26、28、30、32 ℃的摇床中培养5 d后将菌液倒入离心管配平,然后以 10 000 r/min离心5 min,取上清,定容至50 mL,以不接菌处理为对照,检测速效磷含量。
3)最适生长转速测定。按试验得出的最适接种量将菌液接种到解磷液体培养基中,调节pH为7,温度设置为30 ℃,调节摇床转速分别为140、160、180、200、220 r/min,培养5 d后将菌液倒入离心管中配平,然后以10 000 r/min离心5 min,取上清,定容至50 mL,以不接菌处理为对照,检测速效磷含量。
4)最适初始pH测定。配制解磷液体培养基,分组调节pH为5、6、7、8、9,按最适初始接种量和最适生长转速将菌液接种到解磷菌筛选培养基中,在30 ℃条件下摇瓶培养5 d(温度28 ℃,转速200 r/min)后将菌液倒入离心管中配平,然后以10 000 r/min离心5 min,取上清,定容至50 mL,以不接菌处理为对照,检测速效磷含量。
5)最适初始接种量测定。配制液体培养基,将菌液进行稀释,按1%、2%、3%、4%和5% 5个接种量接入到解磷培养基中,在30 ℃条件下摇瓶培养5 d(温度28 ℃,转速200 r/min)后将菌液倒入离心管中配平,然后以10 000 r/min离心5 min,取上清,定容至50 mL,以不接菌处理为对照,检测速效磷含量。
1.2.7 数据处理 数据采用Excel 2010和SPSS 19统计软件进行方差分析和多重比较。
2 结果与分析
2.1 解磷菌的筛选
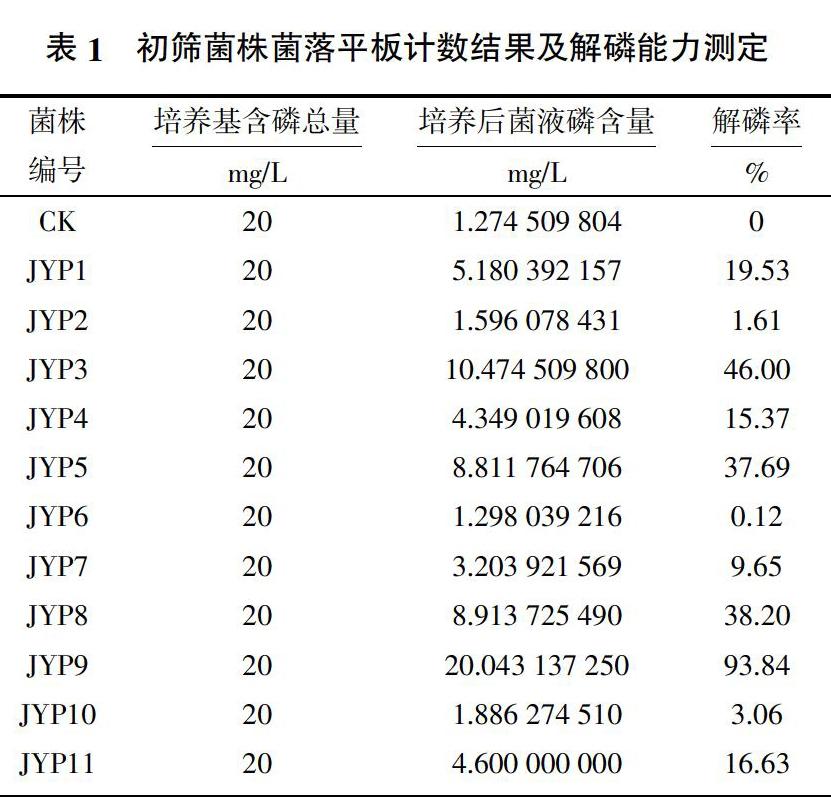
对土壤样品进行涂布处理,初步得到菌株56株,经复筛,得到具有高效解磷能力的菌株11株,通过钼蓝比色法测定解磷量,计算时稀释倍数为50倍,所有的数据均为3次测定的平均值。由表1可知,11株解磷菌的解磷能力均较强,比对照组都有明显增加。其中,JYP6解磷效果最弱,菌液中速效磷含量最低,比空白对照增加了0.12%;而菌株JYP9培养液中速效磷含量最高,比空白对照增加了93.84%,其解磷能力最强,菌株JYP9的解磷率比其他菌株有顯著增加,因此,本试验以JYP9菌株为研究对象,对其菌落特征和解磷特性做进一步研究。
2.2 菌落形态
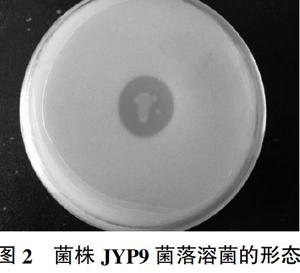
采用平板划线法将JYP9菌株进行纯化,并转接至固体培养基上,培养2 d后观察菌株形态。如图1所示,菌株单菌落呈水滴装,菌落无色透明,边缘光滑,表面湿润且黏稠,菌落直径约为0.5 mm。单菌落的溶解以及解磷圈形态见图2,解磷圈的内外直径比为0.913。
2.3 16S rDNA测序分析
菌株JYP9经16S rDNA测序获得1 418 bp的基因片段,将序列信息提交到GenBank数据库中,利用BLAST将菌株的基因序列进行相似性比较,结果表明,菌株JYP9与假单胞菌属同源性很高,从16S rDNA序列相似性比较结果看,菌株JYP9与Pseudomonas extremorientalis相似性达到100%;选取17株同源性较高的假单胞菌菌株序列与待测菌株序列构建系统发育树,如图3所示,从系统发育树可以看出,菌株JYP9与P. extremorientalis相似性达到100%且处于同一分支,距离最近,鉴定菌株JYP9为P. extremorientalis。
2.4 菌株解磷能力测定结果
2.4.1 标准曲线的测定 用钼锑抗分光光度法测定磷。在一定酸度和锑离子存在的情况下,磷酸根与钼酸铵形成锑酸钼混合杂多酸,它在常温下可迅速被抗坏血酸还原为钼蓝,在660 nm波长下测定。试验的适宜酸度为0.28~0.38 mol/L H2SO4,适宜时间为20~60 min,可稳定24 h,磷含量为0.5~2.0 mg/L时符合线性关系。标准曲线结果见图4。
2.4.2 最适培养温度 由图5可知,温度的变化对菌株的生长有显著影响,随着温度的升高,菌株解磷能力逐渐增强,当温度达到26 ℃时,解磷量达到最高,菌液中的速效磷含量达到8.12 mg/L,比24 ℃时增加了4.94 mg/L,而温度为32 ℃时,解磷量为2.23 mg/L,可能是温度升高导致菌株生长受到抑制,使解磷能力降低,因此确定菌株JYP9的最适生长温度为26 ℃。
2.4.3 最适培养转速 由图6可知,不同摇床转速对解磷能力有明显影响,当摇床转速增加时,菌株解磷能力逐渐增加,当转速达到200 r/min时,菌液中速效磷含量最高,菌液中的速效磷含量达到7.48 mg/L,当转速达到220 r/min时,解磷能力降低,菌液中速效磷含量为7.10 mg/L,比200 r/min时减少了0.38 mg/L,二者有一定差异,其原因可能是转速过高,产生的剪切力对菌体造成机械损伤,降低了菌株的解磷能力。由此可知,菌株JYP9的最适培养转速为200 r/min。
2.4.4 最适培养pH 由图7可以看出,不同pH对菌株生长及解磷能力有显著影响,pH 7时解磷量达到最大,菌液中的速效磷含量达到7.53 mg/L,与其他pH有明显差异。因此确定,菌株JYP9的最适生长pH为7,且菌株适合生长于中性环境中,这对于菌株的大规模生产有重要指导意义。
2.4.5 最适初始接种量 不同的初始接种量对解磷能力有一定的影响,由图8可以看出,随接种浓度的增加,速效磷含量呈先增加后减少的趋势,当接种量为2%时,菌液中速效磷含量达到最大,为7.36 mg/L,比接种量为1.0%时高了4.75 mg/L,有显著性差异,而当接种量为3%时,解磷量为6.41 mg/L,与2%时也有显著性差异,从经济角度考虑,选取2%为最适接种量。
3 小结与讨论
随着种植业结构的调整,农作物产量和复种指数的不断提高,土壤中耗磷量的不断增加,全国耕地土壤速效磷含量逐年下降,南方各地土壤缺磷情况更为严重。土壤中的含磷硅酸盐矿物只有在理化因素和微生物的作用下,通过分化和分解逐步释放出磷供作物生长利用。本研究从陕西省周至县猕猴桃园土壤中筛选到11株高效解磷菌,通过鉴定和解磷能力的测定,复筛出1株解磷能力最强的菌株,命名为JYP9,通过16S rDNA测序,并对序列进行比对,确定其为假单胞菌(Pseudomonas extremorientalis)。
解磷微生物的解磷机理非常复杂,有学者认为解磷微生物通过溶解或矿化作用能使土壤中难溶态磷或非溶性有机磷转化为可供植物利用的速效磷形式[16]。一般认为无机解磷微生物能向外分泌酸性物质,如葡萄糖酸、酒石酸、柠檬酸等来降低土壤环境的pH,使难溶性的磷酸盐溶解;而有机解磷微生物向外分泌酶类物质,如磷酸酶、核酸酶等将磷酸脂等有机磷盐矿化。本试验主要对有机解磷微生物JYP9进行了研究,结果表明,温度为24 ℃和26 ℃的解磷量差异很大,26 ℃时解磷量达到最大,之后随着温度的升高,解磷量下降;在转速为140~200 r/min时,随着转速增加,解磷量也增加,表明接触面积越大,解磷量就越大,但是过快的转速(220 r/min)会使解磷量下降,可能是因为速度过快而导致培养液中的营养没有充分吸收;pH对解磷量有显著影响,pH 7时解磷量最大,但是过酸或者过碱都会影响解磷量,而且影响显著,显然JYP9适宜在中性条件下生存;接种量对解磷量影响显著,2%的接种量与1%的接种量相比,解磷量增加了很多,但是接种量过大反而会抑制生长,导致解磷量减少。由此可知,该菌株的最适培养条件为初始接种量2%、摇床转速200 r/min、培养温度26 ℃、初始pH 7。该结果为菌株的开发利用提供了数据支持和理论基础。
参考文献:
[1] AB-ALLA M H. Phosphates and the utilization of organic phosphorus by Rhizobium leguminosarum biovar viceae[J].Letters in Applied Microbiology,1994,18(5):294-296.
[2] DALAL R C. Soil organic phosphorus[J].Advances in Agronomy,1977,29(1):83-117.
[3] 張宝贵,李贵桐.土壤生物在土壤磷有效化中的作用[J].土壤学报,1977,35(1):104-111.
[4] 冯月红,姚 拓,龙瑞军.土壤解磷菌研究进展[J].草原与草坪,2003,15(1):3-7.
[5] 钟传青,黄为一.磷细菌P17对不同来源磷矿粉的溶磷作用及机制[J].土壤学报,2004,41(6):931-937.
[6] ILLMER P,BARBARA A,SCH-INNER F. Volubility of hardly-soluble AlPO4 with P-volubility microorganisms[J].Soil Biochemistry,1995,27(3):265-270.
[7] SPERBER J I. Solution of mineral phosphates by soil bacteria[J].Nature,1957,180(1):994-995.
[8] 张云翼,邹碧莹.土壤解磷细菌的研究进展[J].现代农业科技,2008(1):182-184.
[9] 刘 江,谷 洁,高 华,等.秦岭山区无机磷细菌筛选及其Biolog和分子生物学鉴定[J].干旱地区农业研究,2012,30(1):184-189.
[10] 段秀梅,高晓蓉,吕 军,等.两株土壤分离菌的解磷能力及对玉米的促生作用[J].中国土壤与肥料,2010,29(2):79-85.
[11] 虞伟斌,杨兴明,沈其荣,等.K3解磷菌的解磷机理及其对缓冲容量的响应[J].植物营养与肥料学报,2010,16(2):354-361.
[12] 胡秀芳,陈集双,陈海敏.一株有机磷降解菌的筛选、鉴定及其解磷功效[J].中国环境科学,2005,25(3):353-356.
[13] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科学技术出版社,2000.60-71.
[14] 刘亚男,于水利,薛 罡,等.聚磷菌PA01-1的筛选及除磷特性[J].中国给水排水,2005,21(10):13-17.
[15] 杨艳华.土壤解磷微生物的分离鉴定[D].郑州:河南农业大学,2014.
[16] 唐 勇,陆 玲,杨启银,等.解磷微生物及其应用的研究进展[J].天津农业科学,2001,7(2):1-5.
