朗德鹅体组织中MTP基因的发育表达及其在填饲后的变化研究
2019-06-11叶健强康润敏
叶健强 康润敏
摘要[目的]研究MTP基因在朗德鹅体组织中的表达量及填饲后的变化。[方法]采用RT-PCR方法,以朗德鹅为研究材料,研究了1、10、13、14和16周龄朗德鹅肝脏、小肠、脑、胸肌、腹肌、腹脂、皮脂和心肌组织以及填饲后肝脏与小肠组织中MTP基因的表达量。[结果]1周龄,MTP基因仅在朗德鹅小肠组织中表达;10周龄,除在肝脏和小肠组织中外,首次发现MTP基因在朗德鹅脑组织中也有表达;MTP基因在肝脏和小肠中的表达量随周龄的增加呈逐步上升的趋势(P<0.05); 1~13周龄,MTP基因在朗德鹅小肠中的表达量高于肝脏;14~16周龄,MTP基因在朗德鹅小肠中的表达量低于肝脏;填饲后MTP基因在朗德鹅肝组织中的表达量降低,而MTP基因在小肠组织中的表达量升高。[结论]MTP基因在朗德鹅脂肪沉积和转运过程中具有极重要的调控作用。
关键词朗德鹅;MTP基因;发育阶段;表达
中图分类号S835;Q756文献标识码A文章编号0517-6611(2019)02-0075-05
doi:10.3969/j.issn.0517-6611.2019.02.022
开放科学(资源服务)标识码(OSID):
填饲诱导的鹅肥肝是由于食物中碳水化合物引起的在肝脏中强烈的脂肪生成[1-2],特别是大量的中性脂肪甘油三酯(triglyceride,TG)在肝实质细胞内的异常沉积。微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTP)是由大亚基(97 ku)和二硫化合物异构酶(55 ku)(protein disulfide-isomerase,PDI)2种多肽构成的异质二聚复合体,其生理作用是加速细胞膜或亚细胞膜之间甘油三酯、胆固醇脂(cholesteryl ester,CE)和卵磷脂(phosphatidylcholine,PC)等的转运和合成[3]。研究发现,动物体内肝脏和小肠细胞中形成富含TG的极低密度脂蛋白(very low density lipoproteins,VLDL)和乳糜微粒(chylomicrons,CM)的组装形成和向血浆分泌过程中主要依赖于MTP(在禽类上,由于小肠淋巴系统不发达,因此小肠中形成的主要是门静脉微粒)[4]。MTP在载脂蛋白B(Apolipoprotein B,apoB)翻译和转移到(endoplasmic reticulum,ER)内质网内膜时,可将体内内源性合成的TG和以CM形式的食物性TG转运到apoB上,并使其构象折叠恰当,进而可组装形成一个含有中性脂质中心的脂蛋白颗粒,以便将TG向外周组织分泌。在体内,由于MTP是参与VLDL和CM或门静脉微粒组装和分泌过程中的必需因子,因此MTP是调节肝脏和外周组织脂质平衡的一个关键因子[5]。
近年来,Lu等[6]和Farese等[7]在小鼠的胚胎发育过程中发现其卵黄囊组织中有MTP基因的表达;同时,Nielsen等[8]和Fournier等[9]发现MTP基因在心脏组织中同样也有较高地表达,但目前人们在水禽(鹅)脂肪代谢调控机理和基因组织表达上的研究尚未见报道。笔者首次以产肝性能较好的朗德鹅作为试验材料,对MTP基因在朗德鹅不同组织中的发育表达及其在填饲后的变化进行研究,旨在为研究水禽肝脏脂蛋白合成、组装与分泌的表达调控机理提供参考依据。
1材料与方法
1.1试验动物及其饲养管理
选用健康朗德鹅雏鹅(公鹅)60只,随机分为对照组(45只)和填饲组(15只)进行饲养(四川省原种水禽场提供)。参照Fournier等[9]的饲养方式,整个饲养期采用自由饮水。0~4周,自由采食雏鹅料(代谢能12 351 kJ/kg,粗蛋白20.5%);5~13周,自由采食生长鹅饲料(代谢能10 886 kJ/kg,粗蛋白13.8%)并按照精饲料量的5%添加青饲料。4~5、6~8、9~13周龄饲料添加量分别为150、165和120 g/(只·d)。13周龄填饲组开始预填饲,预填饲时只添加精料且供给量逐渐过渡为自由采食;对照组,继续饲喂生长鹅饲料,自由采食。14周龄开始填饲,每天机器填饲5次,填饲期2周,其饲料配方如下:煮熟的黄玉米、3%鹅油和1.5%食盐等(代谢能14 109 kJ/kg,粗蛋白9.0%)。
1.2样品采集
分别于1、10、13、14和16周龄采集对照组和填饲组中鹅的肝脏、小肠组织样各5 g,其中10周龄另采集胸肌、腿肌、皮脂、腹脂、脑和心脏等组织样各5 g。将采集的各组织样品,先使用DEPC处理水洗去表面血液,然后用剪刀迅速剪成50~100 mg的组织块,放入2 mL冻存管内并做好标记后迅速存于液氮中速冻,以备总RNA提取,速冻后的样品于-70 ℃液氮罐中保存,以供各組织总RNA的抽提。
1.3试验方法
1.3.1各组织总RNA的提取。
取-70 ℃条件下保存的各种组织50 mg,按照Beyozol kit使用说明书分别提取各组织的总RNA,使用紫外分光光度计测定总RNA的浓度和纯度(OD260/ OD280为1.8~2.0),利用1.0%变性琼脂糖凝胶电泳检测总RNA质量,置于-70 ℃条件下贮存或立即进行反转录。
1.3.3半定量分析及数据统计分析。
抽提的总RNA及RT-PCR产物使用1.0%的琼脂糖凝胶电泳进行;电泳结束后用凝胶成像系统(BTS-20.M,UVItec,Inc.)进行拍照;半定量分析软件用Quantity one进行,并计算目的基因的相对表达量。试验数据用SAS 6.12统计软件进行统计与分析,并采用LSD法进行多重比较。
2结果与分析
2.1总RNA的提取和纯化
利用RNA抽屉试剂盒分别对不同发育阶段和不同处理间的多种组织总RNA进行提取,取5 mL总RNA进行琼脂糖凝胶电泳。由图1A可以看出,抽提总RNA的28S、18S条带清晰、锐利,且28S条带亮度约为18S条带的2倍左右,说明所抽提的总RNA完整;但因未经DNase Ⅰ 处理,其总RNA中含有大量DNA杂带,经DNase I处理后(图1B),说明已经将DNA的污染去除且RNA的完整性没有被破坏,因此其处理是有效的。通过吸光度定量分析,各组织总RNA OD260/OD280为1.8~2.0,表明抽提RNA具有较高的质量,可进行后续试验。
2.2MTP基因在朗德鹅各组织中的表达
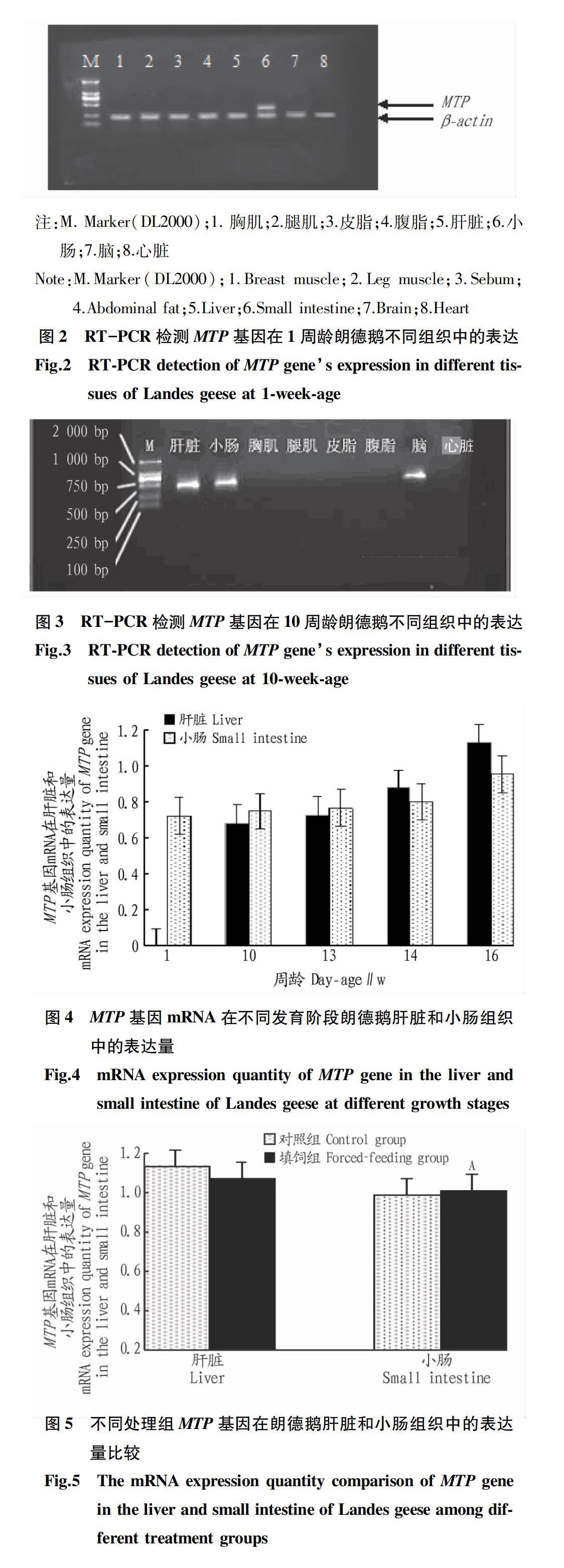
从图2和图3可以看出,1周龄MTP基因仅在朗德鹅小肠组织中表达,10周龄MTP基因在朗德鹅肝脏、小肠和脑组织中均有表达,在胸肌、腿肌、皮脂、腹脂和心脏组织中则未检测到表达。
2.3MTP基因在不同发育阶段朗德鹅肝脏和小肠组织中的表达量
MTP基因在朗德鹅肝脏和小肠组织中的表达量随日龄的增加呈上升趋势(图4),且差异均达到显著水平(P<0.05)。
2.4填饲后MTP基因mRNA在朗德鹅肝脏和小腸组织中的表达量
填饲后,朗德鹅肝脏组织中MTP基因mRNA表达丰度降低,但差异不显著(P>0.05);小肠组织中MTP基因mRNA表达丰度却显著升高(P<0.05)(图5)。
3讨论
3.1MTP基因在朗德鹅不同组织中的表达特性
该研究首次测定了朗德鹅不同组织中MTP基因mRNA表达量,结果发现10周龄MTP基因仅在肝脏、小肠和脑组织中有表达,而在其他脂肪和肌肉组织中(如腹脂、皮脂、胸肌、腿肌和心脏组织)中均不表达;16周龄,肝脏和小肠组织中仍检测到MTP基因的表达。此表达特点与Davis[10]、Lu等[11]、Farese等[7]和Terasawa等[12]在哺乳动物(猪和小鼠)肝脏和小肠组织中均发现有MTP基因表达的结论一致;这都证实了MTP基因在脂质转运中的生理作用——MTP基因在ER内膜中将TG、CE和PC等的转运到apoB上并协同组装成富含apoB的脂蛋白(VLDL)向血浆中分泌[13-14]。由于在哺乳动物上发现其体内的脂蛋白主要是肝脏组织中合成的VLDL、小肠组织中的乳糜微粒和胎儿的卵黄囊组织中的VTG[15];在禽类上,Bensadoun等[16]认为除肝中能合成VLDL和VTG外,由于其小肠淋巴系统不发达,禽类小肠中合成的脂蛋白被直接转运至门静脉系统进行代谢,这种脂蛋白称为门静脉微粒(potimicron)。因此,MTP基因在朗德鹅肝脏和小肠组织中发现有表达,反映了禽类上述的生理特点——禽类体内VLDL和门静脉微粒的合成和分泌主要依赖于MTP基因的脂质转运功能[17]。
笔者首次发现MTP基因在朗德鹅脑组织中有表达,这与Terasawa等[12]、Nielsen等[18]、Nielsen等[19]、Borén等[20]、Walzem等[21]和Iqbal等[22]在小鼠卵黄囊组织、人类心肌组织和鸡肾脏组织中发现有MTP基因表达的特点并不一致;一些研究表明,MTP基因在某组织中表达可能与该组织中脂蛋白的形成和分泌有关,且是该组织中沉积的过多TG向外转运的一种新途径,同时也依赖于MTP基因启动子SREBP1的表达[12,18-20]。因此,根据MTP基因的生理作用推测,MTP基因在朗德鹅脑组织中表达与其脑组织中某种脂蛋白的合成和分泌有关,但MTP基因是否参与脑组织中某种脂类物质的转运调控有待进一步研究。
47卷2期叶健强等朗德鹅体组织中MTP基因的发育表达及其在填饲后的变化研究
3.2MTP基因在不同发育阶段朗德鹅肝脏和小肠组织中的表达特性
目前,对哺乳动物MTP基因不同发育阶段的表达特性研究较少。Shelton等[23]、Plonné等[24]和Lu等[6]分别对胚胎期小鼠中MTP基因大亚基、哺乳期大鼠初级肝细胞和不同发育阶段猪肝脏和小肠组织中MTP基因的表达进行了初步研究;Levy等[25]研究了人胚胎期小肠组织中MTP基因的表达特性。在禽类脂肪代谢上,不仅缺乏对MTP基因在体内、外的表达特性研究,不同发育阶段MTP基因在组织上的表达特性研究未见报道。该研究采用RT-PCR法首次以朗德鹅1、10、13、14和16周龄5个不同发育阶段研究了肝脏和小肠组织中MTP基因的表达特性,结果表明1周龄MTP基因仅在小肠组织中表达;10周龄,检测到MTP基因在肝和小肠组织中均有表达;同时发现MTP基因不仅在不同的发育阶段表达丰度存在差异,而且不同组织间其表达丰度也存在差异,即10~16周龄MTP基因在肝脏与小肠组织中的表达量均呈显著上升趋势; 1~13周龄小肠组织中MTP基因表达丰度高于肝脏,14~16周龄MTP基因在小肠组织中表达丰度却低于肝脏。
Lu等[6]研究发现新生乳猪胎儿期MTP基因在肝脏和小肠组织中都有较高表达,但出生后MTP基因在空肠组织中维持较高的表达直到泌乳结束,而在回肠组织中其表达量在出生后2 d降低;出生后,MTP基因在肝组织中的表达一直维持较低的表达水平。Black[26]和Lu等[6]认为此阶段MTP基因的表达主要与胎儿期或刚出生时体内脂质的吸收和代谢特点有关,因为此阶段主要依靠胎盘或母乳有效地吸收营养和利用食物中的脂类物质(以TG为主),并且体内50%左右的能量供应来源与母乳中的脂质代谢;MTP基因发挥脂质转运作用形成乳糜微粒,进而向外周组织分泌。Raabe等[27]认为新生动物小肠组织中较高的MTP基因表达是必要的,也反映出其在脂质转运过程中的重要性,且在缺乏MTP基因表达的小鼠胚胎早期不能成活的研究中得以证实。此外,1周龄雏鹅所利用的营养物质不同于胚胎期和出壳后2~3 d,后者其主要通过卵黄囊将母体的营养成分供给雏鹅;而此阶段的雏鹅主要以摄入外源性营养物质在小肠绒毛组织中被分解、组装成门静脉微粒直接进入肝脏中[7]来维持体内的能量和蛋白需求;另外,机体发育早期主要是体细胞增长,脂肪沉积较少,则肝组织中合成的脂质相对较少,进而肝组织中脂质通过MTP基因组装、形成并转运到血浆中的富含TG的VLDL就更为有限。因此,为了维持和生长发育的需求,此阶段雏鹅小肠组织相对肝脏组织的生理作用较大,所以MTP基因在这2个组织间的表达呈差异性。14~16周龄,机体已发育成熟,此时主要是以脂肪沉积为主[15],因此在肝脏中合成的TG量也增大,进而通过MTP基因脂质转运作用将TG和apoB转运结合在一起形成能够分泌到血浆中VLDL的量也有所增加[28],此阶段肝组织中MTP基因表达量的提高与满足自身营养需要是一致的;同时,此阶段其采食量加大,则在小肠组织中被分解的脂类物质的量提高,从而加大了MTP基因的转运作用。
3.3填飼前后朗德鹅MTP基因在肝脏和小肠组织中表达特性
14~16周龄,在肝脏和小肠中的表达都进一步提高且肝组织中的表达量高于小肠,这与饲料成分(高能的碳水化物—玉米)、饲养方式(填饲)和此期间体内脂肪沉积强度有密切关系。此阶段,食物中大量碳水化物由小肠消化组织吸收后,使通过血浆运输到门静脉的葡萄糖浓度大大提高,进而促进肝内的脂质(TG)合成[29]。肝细胞ER中MTP基因的主要作用是将肝内合成的大量TG转运到apoB上,并与其一起形成富含TG的VLDL向血浆中分泌,其目的在于调节TG在肝内和肝外脂肪组织之间的平衡,则MTP基因的表达量大幅度提高。同样,在小肠组织中,随着采食量的增加,进入到小肠组织中的食物源性脂质含量也加大,小肠中向门静脉系统分泌的门静脉微粒的量增加,而MTP基因在门静脉微粒的形成和分泌中是必需的[15],因此MTP基因在小肠组织中的表达也大幅度提高。然而,小肠组织中MTP基因的表达量低于肝组织,这种差异与家禽的生理特点相一致,因为家禽的脂肪组织发育、脂肪沉积和蛋黄的形成主要取决于血浆中的TG浓度,但其肝外组织合成的脂肪很有限,血浆中的TG主要来源于日粮或肝脏,而日粮中的脂肪含量很有限,因此肝脏在禽类脂类代谢过程中起着至关重要的作用[15]。此外,由于禽类的小肠淋巴系统不发达,小肠绒毛细胞内合成的脂蛋白微粒直接通过门静脉系统进入肝脏,并在其中代谢;Wetterau等[13]研究发现,MTP基因在肝脏和小肠组织中的表达主要受脂质和胰岛素调节,但在2个组织的反应却不相同,其认为可能是因为MTP的蛋白质水平与其表达水平间的变化敏锐程度不一致,这主要与体内长期适应有关。因此,填饲期间食物中大量的脂肪对肝组织中MTP基因表达的促进作用较小肠大。此特性与在大鼠[30]和猪[31]的研究结果不同,在小鼠和猪中随着日龄的增长,肝脏和小肠中MTP基因的表达量逐渐降低,直至成年后趋于稳定,这可能是由于不同物种间消化生理和日粮组成在各发育生长阶段不同所致。
总而言之,与猪[6]一样,MTP基因在不同发育阶段朗德鹅肝脏与小肠组织中的表达是以一种满足自身营养需要的方式来进行的。虽然,各物种自身的遗传特性在MTP基因的表达上起主要作用,但饲料中脂肪的含量和类型同样在调节其表达上起着重要作用。
4结论
MTP基因的表达具有组织差异性,其优势组织为肝脏和小肠,特有组织为脑;MTP基因在肝脏和小肠中的表达量随周龄的增加呈逐步上升趋势(P<0.05); 1~13周龄,MTP基因在小肠中的表达量高于肝脏;14~16周龄,MTP基因在小肠中的表达量低于肝脏;填饲后MTP基因中肝组织中的表达水平有所降低,而MTP基因在小肠组织中的表达水平有所升高。MTP基因在鹅肥肝形成中具有重要的调控作用。
参考文献
[1] BNARD G,LABIE C.Evolution histologique du foie des palmipedes au cours du gavage [C]//Troisiemes Joumees de la Recherche sur les Palmipedes a Foie Gras.[s.l.]:[s.n.],1998:31-35.
[2] MOUROT J,GUY G,LAGARRIGUE S,et al.Role of hepatic lipogenesis in the susceptibility to fatty liver in the goose (Anser anser)[J].Comp Biochem Physiol B Biochem Mol Biol,2000,126(1):81-87.
[3] WETTERAU J R,ZILVERSMIT D B.A triglyceride and cholesteryl ester transfer protein associated with liver microsomes[J].J Biol Chem,1984,259(17):10863-10866.
[4] 呙于明.家禽营养[M].2版.北京:中国农业大学出版社,2004.
[5] TSU KAMOTO H.Fat paradox in liver disease [J].Keio J Med,2005,54(4):190-192.
[6] LU S,HUFFMAN M,YAO Y,et al.Regulation of MTP expression in developing swine[J].J Lipid Res,2002,43:1303-1311.
[7] FARESE R V JR,CASES S,RULAND S L,et al.A novel function for apolipoprotein B:Lipoprotein synthesis in the yolk sac is critical for maternal-fetal lipid transport in mice[J].J Lipid Res,1996,37(2):347-360.
[8] NIELSEN L B.Lipoprotein production by the heart:A novel pathway of triglyceride export from cardiomyocytes[J].Scand J Clin Lab Invest Suppl,2002,62(7):35-40.
[9] FOURNIER E, PERESSON R, GUY G, et al. Relationship between storage and secretion of hepatic lipids in two breeds of geese with different susceptibility to liver steatosis[J].Poult Sci, 1997,76(4):599-607.
[10] DAVIS R A.Cell and molecular biology of the assembly and secretion of apolipoprotein Bcontaining lipoproteins by the liver[J].Biochimica et biophysica acta,1999,1440(1):1-31.
[11] LU S,HUFFMAN M,YAO Y,et al.Regulation of MTP expression in developing swine[J].J Lipid Res,2002,43(8):1303-1311.
[12] TERASAWA Y,CASES S J,WONG J S,et al.Apolipoprotein Brelated gene expression and ultrastructural characteristics of lipoprotein secretion in mouse yolk sac during embryonic development[J].J Lipid Res,1999,40(11):1967-1977.
[13] WETTERAU J R,LIN M C M,JAMIL H.Microsomal triglyceride transfer protein[J].Biochim Biophys Acta,1997,1345(2):136-150.
[14] CARTWRIGHT I J,PLONN D,HIGGINS J A.Intracellular events in the assembly of chylomicrons in rabbit enterocytes[J].J Lipid Res,2000,41(11):1728-1739.
[15] 尹靖東,齐广海,霍启光.家禽脂类代谢调控机理的研究进展[J].动物营养学报,2000,12(2):1-7.
[16] BENSADOUN A,ROTHFELD A.The form of absorption of lipids in the chicken,Gallus domesticus[J].Proc Soc Exp Biol Med,1972,141(3):814-817.
[17] HIGASHI Y,ITABE H,FUKASE H,et al.Transmembrane lipid transfer is crucial for providing neutral lipids during very low density lipoprotein assembly in endoplasmic reticulum[J].J Biol Chem,2003,278(24):21450-21458.
[18] NIELSEN L B,SULLIVAN M,VANNIREYES T,et al.The DNA sequences required for apolipoprotein B expression in the heart are distinct from those required for expression in the intestine[J].J Mol Cell Cardiol,1999,31(4):695-703.
[19] NIELSEN L B,PERKO M,ARENDRUP H,et al.Microsomal triglyceride transfer protein gene expression and triglyceride accumulation in hypoxic human hearts[J].Arterioscler Thromb Vasc Biol,2002,22(9):1489-1494.
[20] BORN J,VNIANT M M,YOUNG S G.Apo B100containing lipoproteins are secreted by the heart[J].J Clin Invest,1998,101(6):1197-1202.
[21] WALZEM R L,HANSEN R J,WILLIAMS D L,et al.Estrogen induction of VLDLy assembly in egglaying hens[J].J Nutr,1999,129:467-472.
[22] IQBAL J,RUDEL L L,HUSSAIN M M.Microsomal triglyceride transfer protein enhances cellular cholesteryl esterification by relieving product inhibition[J].J Biol Chem,2008,283(29):19967-19980.
[23] SHELTON J M,LEE M H,RICHARDSON J A,et al.Microsomal triglyceride transfer protein expression during mouse development [J].J Lipid Res,2000,41(4):532-537.
[24] PLONN D,SCHULZE H P,KAHLERT U,et al.Postnatal development of hepatocellular apolipoprotein B assembly and secretion in the rat[J].J Lipid Res,2001,42(11):1865-1878.
