75例无精子症患者病因分类及分析
2019-06-10贺勇凯周青高瑞松林群芳刘慧英王帅朱治亚闵杰张仲楠
贺勇凯 周青 高瑞松 林群芳 刘慧英 王帅 朱治亚 闵杰 张仲楠


[摘要]目的通过综合无精子症患者生殖器彩超检查、性激素(TSH、LH、E2、T、PRL)水平检测、染色体检查结果等,统计分析其病因,研究总结无精子症患者的病因构成情况。方法选取2015年1月~2017年10月湖南中医药大学第一附属医院男科门诊就诊共75例无精子症患者,收集患者生殖系统彩超、性激素水平、染色体检查结果、既往病史资料等资料,分析患者病因,按输精管道是否通畅区分梗阻性和非梗阻性无精子症两大类。梗阻性无精子症根据彩超、MRI等明确男性生殖管道发育是否正常,区分为先天性梗阻(包括附睾、输精管、精囊腺发育异常或缺如)和获得性梗阻(生殖管道无明显发育异常);非梗阻性无精子症则根据血清性激素水平、染色体核型、Y染色体微缺失等区分为睾丸因素(包含由于饮食习惯、内分泌、温度、睾丸扭转、外伤及隐睾等原因导致的无精子症)和睾丸前因素(包含由于染色体异常、Y染色体微缺失等原因导致的无精症)进行分类、比较。结果在所有75例患者中,梗阻性无精子症占26.67%(20/75),非梗阻性无精子症占66.67%(50/75),其中睾丸生精功能障碍占44.00%(33/75),染色体异常占16.00%(12/75),AZF缺失占6.67%(5/75);其他原因中药物性导致的占1.33%(1/75);原因不明5.33%(4/75)。结论睾丸生精功能障碍、生殖道梗阻、染色体异常是导致无精子症的主要原因,仍有少数患者病因不明。
[关键词]男性不育;无精子症;病因分类;生殖道梗阻
[中图分类号]R698
[文献标识码]A
[文章编号]2095-0616(2019)02-07-06
据世界卫生组织(WHO)统计,全世界约有10%~15%的育龄夫妇患有不孕不育症,其中由男性因素导致的不育症约占30%~50%[1]。而其中无精子症发病率占男性不育的10%~20%[2]。因此,对于无精症患者病因的探究对于此病的诊断、治疗方案的选择都有重要作用。本文通过综合无精子症患者各种检验结果,统计分析患者病因,研究无精子症患者的病因构成情况,为无精子症患者的诊治提供一定的理论依据。
1 资料与方法
1.1 纳入标准
患者均经过至少3次或以上精液常规分析,并将精液离心沉淀后,经高倍镜镜检未能找到精子而确诊为无精子症。标准参照WHO人类精液检查与处理实验室手册(第5版),无精子症:禁欲2~7d,連续3次或3次以上精液检查未发现精子。
1.2 一般资料
在2015年1月~2017年10月我院男科就诊的无精子症患者中采用随机数字表法进行简单随机抽样无精子症患者75例。精液检查结果以本院精液常规检查结果为准,不育病史0.5~12年,年龄21~50岁,平均(28.9±5.7)岁,同时记录患者所有检查结果及其他一般情况(包括精液量、睾丸大小、附睾是否有病理性改变、精索静脉曲张情况、精囊腺是否存在及大小、生殖系统感染史、染色体核型及基因缺失情况等)。见表1。所有均为湖南地区患者,饮食习惯无明显差别,排除泌尿系肿瘤
等相关遗传病史,排除长期放射线接触史,排除心、肝、肾等其他器官严重病变史。
1.3 诊断方法
无精子症诊断明确后,再予以以下检查,明确病因,(1)彩色超声多普勒检查:检查部位为阴囊、睾丸、附睾、精索;(经直肠)前列腺、精囊腺;所有彩超均由本院彩超室采用PHILIPSHDI5000型超声检查仪检测。(2)血清性激素水平检测:取静脉血,测定血清生殖激素雌二醇(E2)、促黄体生成素(LH)、促卵泡生成素(FSH)、睾酮(T)水平及泌乳素(PRL)水平,所有检测均由本院检验科完成。
(3)外周血细胞培养染色体分析:常规无菌操作抽取肝素抗凝全血置于淋巴细胞培养基中培养,制备染色体标本,G显带。分析染色体数目和结构的异常。(4)Y染色体AZF微缺失检测:采用多重PCR方法对DNA进行AZF微缺失检测,检测位点包括AZFa区(sY84、sY86)、AZFb区(sY124、sY127、sY128、sY133、sY134、sY143)、AZF区(sY152、sY239、sY242、sY254、sY255)、AZFb/c(sY145)和sY82。(5)其他:对于彩超诊断不清晰或需进一步诊断的,予以生殖系统MRI等检查。
1.4 诊断分类
根据前述无精子症检查流程的结果,按输精管道是否通畅区分梗阻性和非梗阻性无精子症两大类;梗阻性无精子症根据彩超、MRI等明确男性生殖管道发育是否正常,区分为先天性梗阻(包括附睾、输精管、精囊腺发育异常或缺如)和获得性梗阻(生殖管道无明显发育异常),非梗阻性无精子症则根据血清性激素水平、染色体核型、Y染色体微缺失等区分为睾丸因素(包含由于饮食习惯、内分泌、温度、睾丸扭转、外伤及隐睾等原因导致的无精子症)和睾丸前因素(包含由于染色体异常、Y染色体微缺失等原因导致的无精症)。
1.5 统计学方法
采用SPSS19.0软件对数据进行统计学分析。采用Fisher精确概率法统计分析精液量的减少程度是否与生殖道先、后天梗阻有关;精索静脉曲张程度与无精子症患者有、无生殖道梗阻是否有关。P<0.05为差异有统计学意义。
2 结果
本组75例无精子症患者,根据病史、体检、辅助检查等资料,可得出以下结果。
2.1 梗阻性无精子症(OA)
20例可诊断为梗阻性无精子症,占26.67%,其中3例为先天性输精管、精囊发育不良。后天性病因中,属外科手术创伤引起的有1例,附属性腺及输精管道感染引起的16例。见表2。
2.2非梗阻性无精子症(NOA)
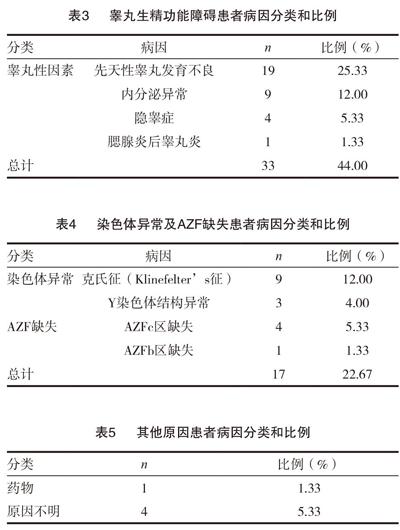
根据生殖激素异常、两侧睾丸平均体积小于12mL,染色体及AZF检测,50例可诊断为非梗阻性无精子症,占66.67%,其中33例为睾丸生精功能障碍,占44.00%,这其中包括19例先天性睾丸发育异常,9例内分泌异常;1例腮腺炎后睾丸炎,4例隐睾症;染色体数目和结构异常者12例,占16.00%,其中克氏征9例,Y染色体结构异常3例;AZF缺失5例,占6.67%,其中AZFc区缺失4例,ZAFb区缺失1例。见表3~4。
2.3其他原因患者病因分类和比例
药物性病因1例,患者既往长期服用雷公藤多苷片史;仍有4例完善相关检查后未能明确病因。见表5。2.4异常检查结果及相关病史在各类病因中的分布
同时,我们通过分析患者异常检查结果及相关病史在各类病因中的分布情况得到如下表格。见表6。
3讨论
本组患者中梗阻性无精子症(OA)占26.67%,既往大样本研究中OA约占无精症的20%~50%[3-4]。梗阻性无精子症按病因不同又可以分为先天性梗阻性无精子症和后天获得性输精管梗阻。先天性梗阻性无精子症病因主要包括附睾发育不良、附睾与睾丸之间游离、双侧输精管缺如(CBAVD)或闭锁、精囊腺缺如(CASV)和射精管缺如等。本组患者中有2例双侧输精管缺如(CBAVD)患者,CBAVD在不育男性中发病率可达2%~6%[5],占梗阻性无精子症患者的15%~20%[6],患者多无特异性临床表现,可伴有肾脏、睾丸、精囊腺发育异常等临床表现[7],现主流观点认为其病因与囊性纤维化病(CF)关系密切[8],是CF在生殖系统的一种表现,主要与囊性纤维化跨膜转运调节物(CFTR)基因的突变有关[9];本组中1例精囊腺缺如,目前其发病率尚缺少明确资料,病因尚不明确。后天获得性输精管梗阻病因主要包括感染、外科创伤和继发于肿瘤等。本组后天获得性输精管梗阻中生殖系统感染有16例,占后天获得性输精管梗阻患者中的94.12%,表明生殖系统感染是后天获得性输精管梗阻的主要病因,有研究认为长期吸烟是其主要危险因素[10],但仍需进一步研究证实;本组中1例手术损伤患者,询问病史患者儿童时期曾经行腹股沟疝修补术。有调查表明腹股沟疝修补术是医源性输精管梗阻的重要病因,尤其在儿童期腹股沟疝修补术极易损伤输精管[11]。
本组患者中非梗阻性无精子症(NOA)占66.67%,大体符合既往研究比率[12-14]。此类患者体查可发现睾丸偏小,测量体积小于12mL,性激素水平多可发现异常[15]。NOA可分为睾丸因素引起的NOA和睾丸前因素引起的NOA。睾丸因素引起的NOA主要包括先天性睾丸发育不良、内分泌异常、继发于隐睾症或腮腺炎以及由于高温、射线、化学物质损伤等。先天性睾丸发育不良均可导致高促性腺激素的表现,由于睾丸萎缩,发育不良等,性激素合成和分泌减少,垂体的促性腺激素(FSH和LH)反馈性分泌增多。内分泌异常主要包括低促性激素性性腺功能减退和高泌乳素血症。低促性激素性性腺功能减退是由于LH和FSH合成、分泌减少,不能刺激睾丸的发育,导致睾丸发育不全,性激素分泌减少,从而出现不育、勃起功能障碍、第二性征发育不全等临床表现[16-17]。高泌乳血症(HPRL)是近年来男性不育的研究热点。相关研究显示,血清泌乳素水平与卵泡刺激素、睾酮、黄体生成素水平均无相关性,是独立于其他性激素的一个重要监测指标[18]。泌乳素(PRL)为应激性激素,呈脉冲式分泌并有昼夜节律性。PRL升高可干扰促性腺激素释放激素(GnRH)释放及垂体对GnRH的反应,使卵泡刺激素和黄体生成素分泌减少,睾酮合成分泌减少而导致男性不育[19],但目前高泌乳素血症的具体发病原因及发病机制仍不清楚,有待进一步研究[20-21]。睾丸前因素引起的NOA包含由于染色体异常、Y染色体微缺失等原因导致的无精症。染色体异常主要有数目和结构的异常,本组中含染色数目体异常患者9例,外周血染色体检测均提示为46,XXY,符合克氏征在无精症患者染色体异常的多发性[22-23]。同时,本组患者内还发现2例Y染色体结构异常患者,染色体检测分别提示为46.X,del(Y)(q11)、46.XY,15p3+,Y染色体结构异常检出率为2.6%,较高于正常人群染色体异常发生率(0.47%)[24],可能与样本量较小或区域发病率不同有关。75例患者共检测出AZF缺失患者为5例,占6.67%。有报道男性不育患者中AZF缺失率为1%~55%[25],而其中AZFc区的缺失率最高,AZFa区最低[26],各区缺失的临床表现也各有差异[27]。
75例患者中有1例药物引起所致,患者既往因肾病综合征连续服用雷公藤多苷片1.5年,婚后1年发现不育。体格检查、彩超、性激素水平检测、遗传学检查均未提示明显异常,考虑为药物引起不育。以往调查发现雷公藤多苷片副作用多集中于血液系统,对于生殖系统的损害较少报道[28-29]。但也有相关研究显示雷公藤对于生殖系统有着多方面的损害[30]。75例患者中仍有4例患者病因不明,考虑可能由于全身其他疾病引起,需进一步复查及完善其他相关检查。
分析患者异常检查结果及相关病史在各类病因中的分布情况发现:(1)统计发现精液量的减少程度是否与生殖道先、后天梗阻有关(P=0.011),且先天性梗阻性無精子症患者精液量明显减少,验证了精液组成大部分来源于精囊腺与前列腺[31],输精管下端的梗阻并不会明显减少精液量;先天性梗阻性无精子症患者均出现了附睾的病理性变化,主要表现为附睾结节或囊肿,彩超下附睾内呈网格状改变,而后天获得输精管梗阻患者中虽然大部分患者(14/17)附睾也有相同病变,但仍有少数未出现典型的表现,对于此种差异的出现,结合患者病史,发现未出现典型表现的患者病程均较短,我们猜测在输精管道梗阻后附睾产生典型的病变需要一定的时间,具体出现时限及发生机制尚需进一步研究;(2)由于睾丸发育不良、内分泌因素及克氏征导致的无精子症患者均可导致患者睾丸体积减小,因此,对于在临床查体中发现患者睾丸体积减少,应首先高度怀疑以上病变,并予以针对性的检查和治疗;(3)统计发现精索静脉曲张程度与生殖道是否梗阻无相关性(P=0.253);(4)有生殖系统感染病史的患者存在于各类型的病因患者中,且后天获得性输精管梗阻无精子症患者中,除去1例属手术并发症外,其余患者均有明确的生殖系统感染史,符合生殖系统感染是后天获得性输精管梗阻的主要病因的主流观点[10],另外,生殖系统感染的发生在正常人群与无精子症患者中发病率是否有差异,以及对于睾丸发育异常或内分泌异常等所导致的生殖系统免疫、血液动力学方面的改变对男性生殖系统感染疾病的易感性会产生何种影响尚未有深入研究。
同时,不同病因所导致的无精子症的治疗方案和预后都有着巨大差别,如梗阻性无精子症现可采用手术治疗,其中输精管附睾显微吻合术
(MVF)是目前临床的主要手术治疗方法,有统计研究表明其再通率可达70%~80%,自然受孕率在20%~40%[32-34],即使无法手术治疗,或者手术失败者,仍可采用卵胞浆内单精子显微注射技术
(ICSI)达到生育的目的,预后相对较好;而对于非梗阻性无精子症,目前仍然没有高效稳定的治疗方法,现临床大多尝试通过显微取精的方式采用ICSI技术尝试生育,然而取精成功率具有很大的不确定性,介于0~65%[35-36],且不可回避的是,单次ICSI周期的成功率仍然有限,超过50%夫妇需要2次甚至多次ICSI周期,费用昂贵女方需要承受更多的痛苦,同时,ICSI还将增加遗传风险[37]。
综上所述,无精子症患者病因纷繁复杂,本研究发现睾丸生精功能障碍、染色体异常、生殖道梗阻仍是导致无精子症的主要原因,但仍有少数特发性无精症患者病因不明。由于无精症患者大多无特异性临床症状表现,其病因诊断主要依靠各项辅助检查,而各个病因的治疗预后相差甚远,因此能熟悉无精症患者群体中的病因构成,及早明确病因诊断,确定治疗方法显得尤为重要。
[参考文献]
[1]Martin RH.Cytogenetic determinants of male fertilty[J]. Hum Reproud Up date,2008,14(4):379.
[2]MurrayKS,JamesA,McGeadyJB,etal.Theeffectofthe new 2010 World Health Organization criteria for semen analyses on maleinfertility[J].Fertil Steril,2012,98(6): 1428-1431.
[3]蒲军,吳小候,唐伟,等.640例无精子症病因分析[J].重庆医科大学学报,2010,35(2):317-319.
[4]陈斌,张正果,王鸿祥,等.1027例无精子症的精确诊断和治疗体会[J].北京大学学报(医学版),2010,42(4):409-412.
[5]宁晔,胡洪亮,李铮.囊性纤维化跨膜转导调节因子与男性不育[J].生殖与避孕,2011,31(3):186-191.
[6]Elhanbly S,El-Saied MA,Fawzy M,et al.Results of vasovasostomy or va-soepididymostomy after failed percutaneous epididymal sperm aspirations Fertil Steril,2015,104(3):602-606.
[7]杨彬.先天性双侧输精管缺如的十大临床特点[J].中国男科学杂志,2016,30(1):67-69.
[8]Augarten A,Yahav Y,Kerem BS,et al.Production scale plasma nanocoating for electronic devices[J].Lancet,1994,344(8395):1473-1474.
[9]Li H,Wen Q,Li H,et al.Prospective analysis ofoutcomes after microsurgical intussusception vasoepididymostomy[J]. Cyst Fibors,2012,11(4):316-323.
[10]王岩斌,洪锴,唐文豪,等.178例梗阻性无精子症危险因素及临床特征分析[J].中国性科学,2016,25(9):84-86.
[11] Khodari M,Ouzzane A,Marcelli F,et al.Azoospermia and a historyof inguinal hernia repair in adult[J].Progres en Urologie,2015,25(12):692-697.
[12]Donoso P,Tournaye H,Devroey P.Which is the bestsperm retrieval technique for non-obstructive azoospermia A systematic review[J].Hum Reprod Update,2007,13(6): 539-549.
[13]Fogle RH,Steiner AZ,Marshall FE,et al.Etiologyofazoospermia in a large nonreferral inner-citypopulation[J].FertilSteril,2006,86(1):197-199.
[14]Jarow JP,Espeland MA,Lipshultz LI. Evaluation oftheazoospermic patient. [J].Urol,1989,142(1):62-65.
[15]唐文豪,姜辉,马潞标,等.非梗阻性无精子症患者睾丸体积、生殖激素水平与睾丸穿刺取精结果的相关性
研究[J].中华男科学杂志,2012,18(1):48-51.
[16]侯开波,王喜良,白雪,等.12例男性低促性腺激素性性腺功能减退不育治疗结果[J].中国优生与遗传杂
志,2012,20(1):105-106.
[17]程国隆,宋荣.男性无精子症患者血清生殖激素水平与睾丸生精功能的相关性分析[J].中国当代医药,2017,10(10):36-38.
[18]王國镇,殷奖悠,陈露,等.血清泌乳素检测在男性不育症中的临床价值[J].中日友好医院学报,2014,28
(6):341-342.
[19]Bungum M,Bungum L and Giwercman A.(2011) Spermchromatin structure assay(SCSA):a tool in diagnosis andtreatment ofinfertility[J].Asian J Androl,2011,13:69-75.
[20]王佳宁.高泌乳素血症的病因及诊疗进展[J].医学综述,2012,18(21):3629-3632.
[21]岳焕勋.高泌乳素血症与男性不育[J].实用妇产科杂志,2016,32(7):489.
[22]杜涛,沈昌理,张睿,等.男性非梗阻性不育患者染色体核型异常及多态性分析[J].中国优生与遗传杂志,2015,23(6):45-46.
[23]郝小燕,宋红雨,王旭初.睾丸生精功能障碍患者染色体异常核型及多态性分析[J].中国优生与遗传杂志,2016,24(3):46-47.
[24]Nejad ES,Saedi T,Saedi S,et a1.Comparison of in vitro fertilisation success in patients with polycystic ovary syndrome and tubal factor [J].Gynecol Endocrinol,2011,27(2):117-120.
[25]Pryor JL,Kent-Fisrt M,Muallem A,et al.Microdeletions in the Y chromosome of infertile men[J].Engl J Med,1997,336(8):534-539.
[26] Sachdeva K,Saxena R,Majumdar A,et al.Use of ethnicity specific sequence tagsite markers for Ychromosome microdeletion studies[J].Gene Test Mol Biomarkers,2011,15:451-459.
[27]李座祥,汪朝晖,王媛媛,等.无精子症和严重少精子症患者Y染色体微缺失和基因缺失研究[J].生殖医学杂志,2006,7:217-221.
[28]赵叶.182例雷公藤多苷片不良反应分析及预防措施[J].山东中医杂志,2012,31(8):572-573.
[29]印成霞.55例雷公藤多甙片/雷公藤多苷片致不良反应文献分析[J].中国药物警戒第,2013,10(8):478-482.
[30]袁玉丽,周学平.雷公藤生殖毒性研究进展[J].中华中医药杂志,2013,28(10):2997-2999.
[31]双卫兵.男性生殖道疾病与生育调节技术[M].人民卫生出版社,2015:138
[32]ChanPT,BrandellRA,GoldsteinM.Prospectiveanalysisofoutcomesaftermicrosurgicalintussusceptionvasoepididymostomy[J].BJUInt,2005,96(4):598-601.
[33]Chan PT,Brandell RA,Goldstein M.Prospective analysisofoutcomes after microsurgical intussusception vasoepididymostomy[J].BJU Int,2005,96(4): 598-601.
[34]张国喜,白文俊,许克新,等.“套叠式”输精管附睾吻合术治疗梗阻性无精子症[J].中华男科学杂志,2008,22(4):50-52.
[35]Zhang FB,Li LJ,et al.Clinical characteristics and treatment of azoospermia and severe oligospermia patients with Y-chromosome micro deletions[J].Mol Reprod Dev,2013,80(11):908-915.
[36] Stahl PJ,Masson P,Mielnik A,et al.A decade of experience emphasizes that testing for Y microdeletions isessential in American men with azoospermia and severe oligozoospermia[J].Fertil Steril,2010,94(5): 1753-1756.
[37]Hansen M,Kurinczuk JJ,Bower C,et al. The risk of major birth de-fects after intracytoplasmic sperm injection and in vitro fertilization[J].N Engl J Med,2002,346(10): 725-730.
