CRISPR/Cas系统在植物抗病毒中的应用
2019-06-04闫洪波高艳丽孙世卫窦炎丹吴志明
闫洪波,高艳丽,孙世卫,窦炎丹,吴志明
(1. 河北经贸大学生物科学与工程学院,河北 石家庄 050061;2. 衡水学院生命科学系,河北 衡水 053000;3. 河北省农林科学院经济作物研究所,河北 石家庄 050051)
在自然界中,植物病毒侵染植物的现象相当普遍。植物病毒可以感染许多重要的农作物,是影响农业生产的重要因素之一。植物病毒在世界各地广泛分布, 除一小部分是DNA病毒外,大部分的植物病毒基因组是单链RNA,属于RAN病毒。一种病毒可以侵染多种植物,而同种植物又可被多种病毒侵染。病毒侵染植物后破坏植物叶绿体正常的结构和功能从而使光合作用效率降低,还会导致呼吸作用增加、体内碳运输失调、可溶性氮化物积聚和生长调节物质活性降低,严重影响植物生长发育、产量以及品质,使农业生产受到巨大的损失。据统计,全世界仅粮食作物每年因病毒病导致的损失高达200亿USD,经济作物每年因病毒病造成的损失高达600亿USD[1]。因此提高植物对植物病毒的抵抗力具有重要的经济价值。
规律成簇间隔短回文重复序列及其相关系统(clustered regularly interspaced short palindromic repeats/CRISPR associated, CRISPR/Cas system)是细菌和古细菌抵御外来DNA元件侵染的获得性免疫系统[2]。近年来,CRISPR/Cas基因编辑技术经过不断完善和改造,成为具有广阔应用前景的第3代基因编辑技术,广泛应用于动物、植物和微生物的基因定点插入/缺失突变、敲除、多位点同时突变和小片段删除等精确操作[3-4]。国内外利用CRISPR/Cas系统针对病毒的研究比较少,而且大多数研究是针对动物病毒和微生物噬菌体的,针对植物病毒研究的报告更少,为此本文总结分析CRISPR/Cas系统在植物抗病毒中的应用研究进展,并对其他相关系统抗病毒应用前景进行探讨,以期全面了解CRISPR/Cas系统在植物抗病毒中的应用。
1 CRISPR/Cas系统
1.1 CRISPR/Cas系统的发现
规律成簇间隔短回文重复序列及其相关系统(CRISPR/Cas)[2]存在于大约50%的细菌和90%的古细菌基因组中[5],是细菌和古细菌抵御外来噬菌体、质粒或其他移动元件[6]侵染的获得性免疫系统[5, 7-11]。CRISPR 位点最早由 Ishino等[12]在大肠杆菌(Escherichia coli)基因组中发现,随后Bult等[13]描述了产甲烷古细菌(Methanocaldococcus jannaschii)基因组中的18个CRISPR位点。不过直至Jansen等[14]对40余种原核生物基因组中的CRISPR位点进行描述后才被正式命名。此后由于多项研究发现CRISPR中的间隔区(spacer)与侵染细菌的病毒、质粒等外源核酸序列一致[15-17],Makarova等[18]提出CRISPR具有免疫防御作用的假说。Barrangou等[19]发现嗜热乳酸链球菌(Streptococcus thermophilus)的CRISPR可以通过从侵染的噬菌体基因组上获取新的间隔DNA序列,获得对该噬菌体的特异性免疫能力,由此证实了CRISPR系统的防疫功能。
1.2 CRISPR/Cas系统分类
为了应对来自病毒不断变化的选择性压力,CRISPR/Cas系统进化出了具有不同功能的Cas基因(图1)。因此,Cas效应物是高度多样化的,根据Cas效应物是单体酶还是大型多亚基复合物把它们分为两个大的系统,这两个系统又可以分为6个类型(Ⅰ-Ⅵ),并且可进一步细分为多达32个不同的亚型[20-21]。Cas效应物是多亚基效应复合物,被定义为第1类CRISPR/Cas系统,该类包括Ⅰ型、Ⅲ型和Ⅳ型。第2类CRISPR/Cas系统是单一蛋白Cas效应物,该类包括Ⅱ型、Ⅴ型和Ⅵ型CRISPR/Cas类型。
1.2.1 Ⅱ型 CRISPR/Cas系统
Ⅱ型是第一个已知的第2类系统,含有特征性Cas9效应蛋白,可以定位、结合和切割与其指导性crRNA互补的双链DNA(dsDNA)靶标。Ⅱ型CRISPR系统中的Cas9蛋白同时具有加工crRNA和切割双链DNA的功能[22]。2012年,Jinek等[23]对细菌的Ⅱ型CRISPR系统进行改造和优化,成功地在体外定点切割了环状质粒DNA和线性寡聚核苷酸片段。2013年,Cong等[24]利用CRISPR/Cas在人类细胞中实现了内源基因的定点敲除,此后利用该系统在多种动植物和微生物实现了基因组编辑[25]。
Ⅱ型CRISPR/Cas系统已被广泛研究,这为后来发现的其他效应物提供极好的研究基础。图2比较了Ⅱ型Cas9与Ⅴ型Cas12、Ⅵ型Cas13特征性效应物之间差异:Cas9、Cas12靶向切割DNA,而Cas13a切割对象是RNA;Cas9需要crRNA和tracrRNA,而Cas13a是一种双组件系统,只需要一条crRNA介导;Cas13a对crRNA的加工并非必须,尤其是Cas13a靶标单链RNA时;Cas9蛋白识别的PAM(protospacer adjacent motif)序列位于目标靶序列的3′端,Cas12a蛋白识别的PAM序列则位于5′端,而 Cas13a识别PFS(protospacer flanking site)序 列 ,其由A、U或C碱基组成,位于原始间隔序列3′端的侧翼。从结构上来看,Cas9具有2个切割DNA的结构域-HNH和RuvC,Cas13a只含有HEPN结构域而且主要功能是切割RNA。

图1 Cas蛋白的功能分类Figure 1 Functional classification of Cas proteins
1.2.2 Ⅴ型 CRISPR/Cas系统
基于结构域组织的相似性,与Ⅴ型相关的效应物已被归类为Cas12家族的变体,按V-A-E型命名(表1)[20]。Cas12属于Ⅴ型CRISPR/Cas系统,该系统比CRISPR/Cas9更简单和更方便,在Cas12激活复合物中只需要单个crRNA就可以进行多重基因组编辑[26]。Cas12a(以前称为Cpf1)和Cas12b(以前称为C2c1)在结构和功能上都具有广泛的相似性[27-34]。另外两种Ⅴ型效应物Cas12d(以前称为CasY)和Cas12e(以前称为CasX)在体内研究中表现出依赖于RNA的DNA切割活性[35],而Cas12c(以前称为C2c3)是否具有活性尚未确立[36],但由于其分子量比较小,仍然具有极高的价值和潜在的生物技术应用前景。
1.2.3 Ⅵ型 CRISPR/Cas系统
在最近发现的CRISPR/Cas系统中,Ⅵ型在序列和功能上具有高度多样性[36-37]。Cas13是Ⅵ型系统的特征性效应物,靶向和切割RNA而不是DNA[37-38]。到目前为止,已经发现了3种Ⅵ型亚型(VI-A-C)[20](表1),其中Ⅵ-A型和相应的Cas13a效应物(以前称为C2c2)是最佳表征。
2 CRISPR/Cas系统抗植物病毒方面的应用
近几年,CRISPR/Cas9和CRISPR/Cas13系统已被用于植物抗病毒研究,这使得植物抗病毒育种研究发生了革命性的变化。该系统的稳健性、广泛的适应性和易于工程化已经证明了其作为植物抗病毒工具的潜力。
CRISPR/Cas介导的植物病毒抗性基本上可以分为两种方法。第1种方法的靶标是病毒基因组中影响病毒生活史的必需因子,第2种方法的靶标是负责植物基因组与病毒循环相关的宿主植物因子。
2.1 靶向病毒基因
2.1.1 CRISPR/Cas9靶向病毒基因
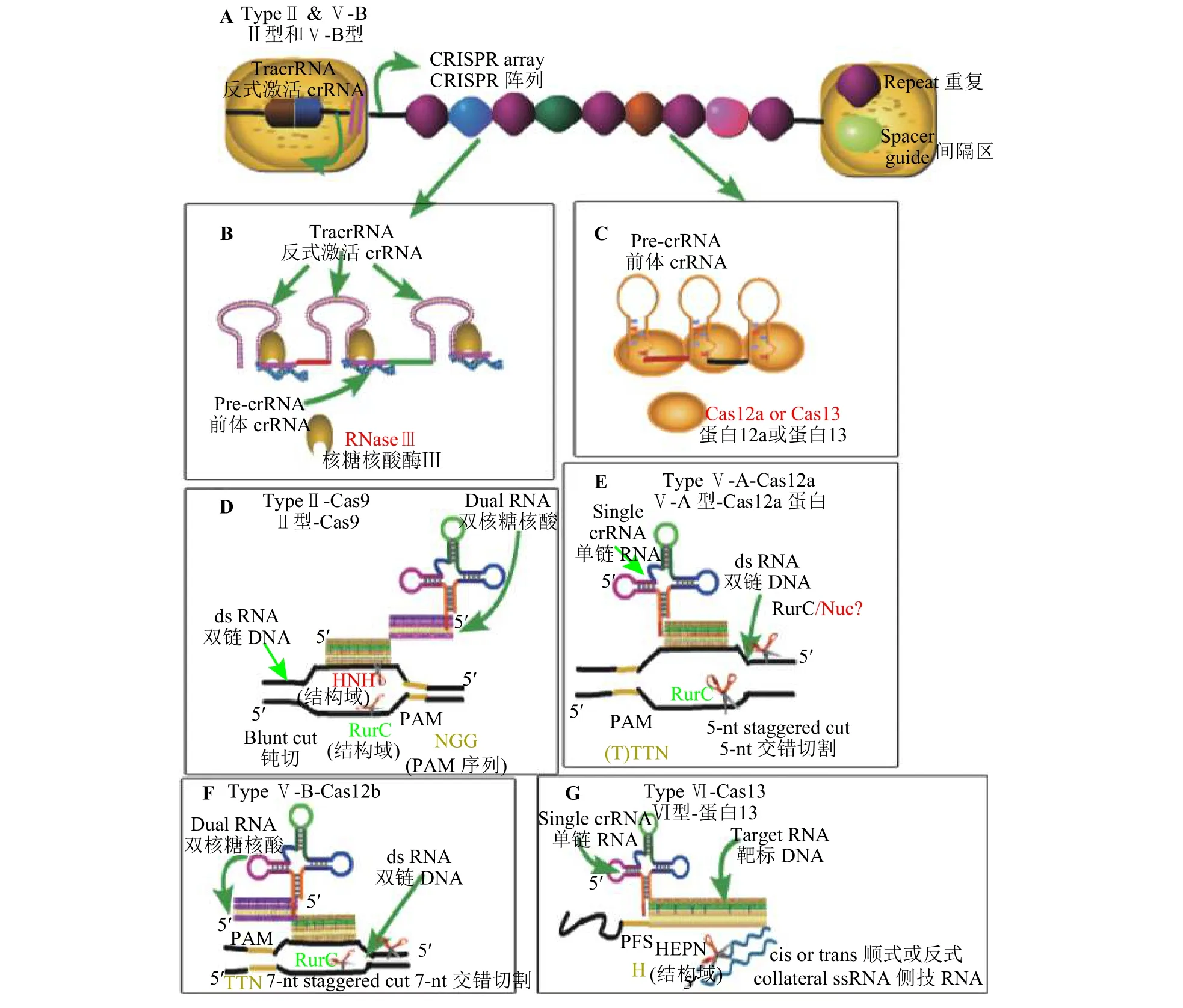
图2 第2类Cas效应物的靶向机制Figure 2 Targeting mechanisms of Class 2 Cas effectors
CRISPR/Cas9系统通过gRNA特异性靶向双生病毒(Geminivirus)的双链DNA,通过破坏复制必需的基因来抑制病毒复制(图3)。Ji等[39]在病毒靶序列处引入突变进行植物抗病毒研究,通过过表达对病毒感染具有高度抗性的Cas9和gRNA来开发稳定的转基因拟南芥(Arabidopsis thaliana)和本氏烟草(Nicotiana benthamiana)植物,结果显示两种植物对双生病毒、甜菜曲顶病毒(Beet curly top virus, BCTV)感染表现出高度的抵抗力,由此认为Cas9与gRNA的表达强度与病毒抑制水平相关联,并使用更高水平的Cas9表达,结果显示植物没有明显的病毒症状[39]。Baltes等[40]利用CRISPR/Cas9系统在转基因本氏烟草中靶向菜豆黄矮病毒(Bean yellow dwarf virus, BeYDV)的复制起始蛋白基因(Rep)并引入突变,结果也显示植物有病毒抗性。
Ali等[41]通过靶向病毒的Rep、外壳蛋白基因和保守的基因间隔区(IR),在本氏烟草植物中验证了Cas9/gRNA系统可以应用于抗番茄黄化卷曲病毒 (Tomato yellow leaf curl virus, TYLCV)、甜菜曲顶病毒和金钟花叶病毒 (Merremia mosaic virus, MeMV)工作。然而研究表明,靶向双生病毒的开放阅读框(ORF)会让病毒产生变体,导致植物的抗病性失效[42]。不过靶向保守的IR区域,可以做到对多种病毒产生广谱的高病毒抗性而不产生病毒变体,这提供了一种针对植物病毒的广泛和持久抗性的抗病毒策略[42]。
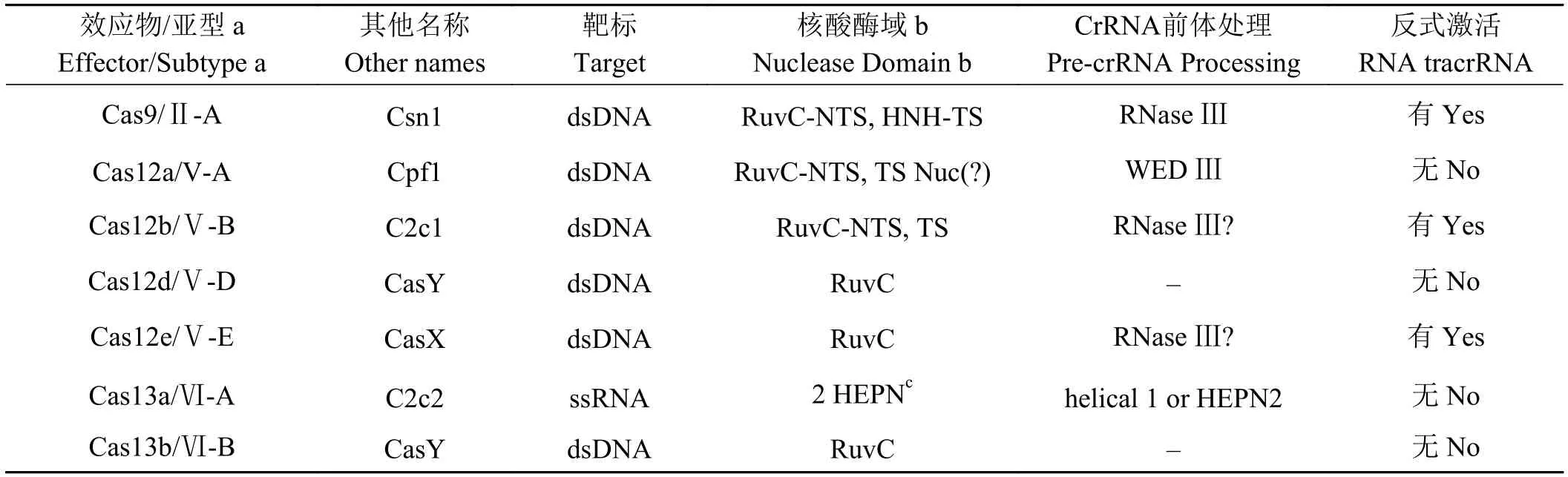
表1 Ⅴ型和Ⅵ型效应物的特征Table 1 Characterization of type Ⅴ and Ⅵ effectors

图3 CRISPR/Cas9系统靶向病毒基因Figure 3 CRISPR/Cas9 system targets viral genes
2.1.2 CRISPR/Cas13a靶向病毒基因
Cas13a是一种能够靶向和切割单链RNA(ssRNA)分子的第2类VI-A型核糖核酸酶,可以作为一种抗植物RNA病毒工具来进行开发。Aman等[43]使用可以表达绿色荧光蛋白(GFP)的芜菁花叶病毒(TuMV-GFP)为材料,通过分析CRISPR/Cas13a系统对该病毒感染、复制和传播特征的影响来研究其抗RNA病毒的功效,为此Aman等设计和构建了与TuMV-GFP基因组的4个不同区域序列互补的crRNA:GFP中的2个靶标序列(GFP1和GFP2)、辅助蛋白(HC-Pro)和外壳蛋白(CP)序列。结果发现TuMV-GFP在本氏烟草中无论瞬时表达还是稳定的过表达系中,这4个靶标crRNA都可以导致GFP蛋白含量降低,同时也减少了TuMV-GFP RNA基因组在叶片中的积累,显示TuMV病毒复制和传播被CRISPR/Cas13a减弱,证实了CRISPR/Cas13a抗TuMV病毒的有效性[43]。
2.2 靶向宿主植物因子
2.2.1 CRISPR/Cas9靶向宿主植物因子
为了让植物产生对RNA病毒的抗性,可以使CRISPR/Cas9系统靶向负责病毒感染必需的植物基因[44-46],如图4所示。植物RNA病毒需要宿主因子如真核生物翻译起始因子(eIF)来维持它们的生命周期。包括eIF4E和eIF(iso)4E在内的许多植物基因已经在不同植物中被鉴定为抗马铃薯Y病毒(potyviruses)隐性等位基因[45-46]。CRISPR/Cas9技术已被用于黄瓜(Cucumis sativus)eIF4E基因的定向编辑[46],通过回交在T3代筛选出eIF4E基因被敲除的纯合非转基因黄瓜,这种黄瓜具有明显的病毒抗性[46]。另一项研究显示,在拟南芥中使用CRISPR/Cas9技术敲除eIF(iso)4E基因,结果产生具有芜菁花叶病毒 (Turnip mosaic virus, TuMV)抗性的非转基因植物[45]。因此,利用这一策略可以获得具有病毒抗性经遗传编辑的非转基因作物,这种方法也能使植物获得对RNA病毒的广谱和持久的抗性。
2.3 CRISPR/Cas与RNAi抗植物病毒的区别
自20世纪后期以来,基因工程已被广泛用在重要经济作物的抗病毒育种。在CRISPR/Cas之前,RNA干扰(RNAi)技术是一种控制植物病毒的有效手段[47-49]。全球商业化生产的抗木瓜环斑病毒(Papaya ringspot virus, PRSV)番木瓜 (Carica papaya)就是RNAi技术成功应用的一个例子[50]。然而通过进化,植物病毒已经发展出了一系列针对RNAi的防御措施[51]。CRISPR/Cas系统利用结合和切割核酸的序列特异性RNA指导的内切核酸酶复合物用来抗病毒[52]。CRISPR/Cas技术相对于RNA干扰(RNAi)或人工微RNA(amiRNA)具有额外的优势,其通过破坏病毒生命周期必需的基因而不是在RNA水平上沉默这些基因使植物获得病毒抗性[53-54]。这个方法的一个重要优点是目前植物病毒还没有进化出针对这个方法的防御机制。另外,通过CRISPR/Cas技术的序列特异性抗病毒策略也可以避免RNAi的潜在脱靶效应和解决amiRNA介导的沉默的病毒抗性不能持久性的问题[53-54]。
3 前景及展望
CRISPR/Cas为代表的基因组编辑技术,不仅已经在植物基因研究的多个领域得到了广泛应用,而且CRISPR/Cas介导的植物抗病毒工作也在短短的几年里迅速发展起来。由于CRISPR/Cas技术在迅速的发展中,预计在植物病毒研究中会有新的CRISPR/Cas相关工具被开发出来,应用领域也将得到拓展,这也许会给植物抗病毒育种带来革命性变化[55]。
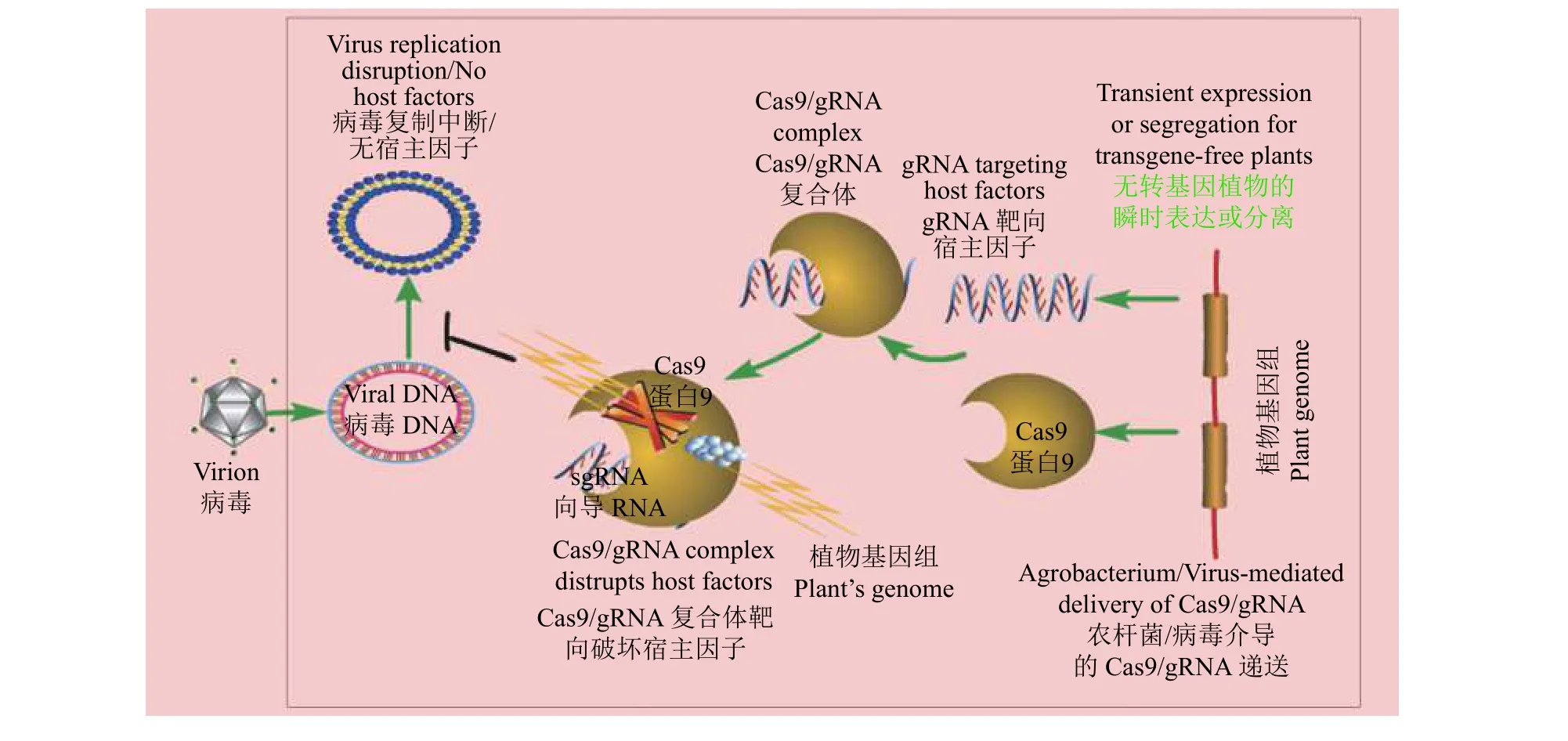
图4 CRISPR/Cas9系统靶向植物基因Figure 4 CRISPR/Cas9 system targets plant genes
有研究表明,CRISPR/Cas12a系统与CRISPR/Cas9相比更有利于精确基因编辑[56]。Port和Bullock[57]在果蝇(Drosophila)中使用CRISPR/Cas12a系统证明,tRNA-sgRNA系统可以促进基因组编辑;Kim等[58]利用大豆中的FAD2和烟草中的AOC证明了CRISPR/Cas12a系统相对精准度高,脱靶率低。因此,CRISPR/Cas12a在植物抗病毒方面有巨大开发潜力,是未来研究植物抗病毒育种的一种新工具。
CRISPR/Cas系统之外还有一些核酸酶系统可以作为潜在的植物抗病毒蛋白来进行研究开发。Jin-soo Kim[59]等指出,NgAgo能够作为一种DNA引导的核酸内切酶靶向性切割RNA。因此NgAgo也许在未来可以被开发成植物抗病毒的工具。除此之外,MpAgo被发现具有RNA依赖的RNA切割酶活性和RNA介导的DNA切割酶活性[60];TpAgo和RsAgo也被发现具有RNA介导的DNA切割酶活性[61-62]。这些Ago蛋白也许将来也可以被开发成抗植物病毒工具。
目前在动物病毒和医学上已经开发出利用Cas13a的特异性高灵敏度酶促解锁(Specific high-sensitivity enzymatic reporter unLOCKing,SHERLOCK)快速检测病毒技术以及其改进型SHERLOCKv2检测技术[63-64]。Chen等[65]将Cas12a单链DNA酶激活与等温扩增相结合,创建的DNA内切酶靶向的CRISPR反式报告检测系统 (DNA endonuclease targeted CRISPR trans reporter, DETECTR)。因此,可以预计 CRISPR/Cas技术在植物病毒检测以及细菌或真菌病害分型领域将得到展开和推广。
不过CRISPR/Cas在植物病毒研究中也面临多重挑战,主要包括:1) CRISPR抑制蛋白的广泛存在[66],对CRISPR/Cas抗病毒产生的效果和对细胞毒性需要进行深入分析;2)目前利用CRISPR/Cas系统抗病毒,一般需要转入Cas蛋白基因,Cas蛋白在植物体内表达对植物生长发育的影响还需要深入的研究;3)采用针对宿主因子编辑策略抗病毒时,宿主因子被修饰后对植物生长发育的影响需要深入研究;4)病毒自身容易发生频繁的基因突变来逃避宿主免疫系统的监测,虽然可以通过设计多种gRNA组合使用的策略来降低这种影响,但是长期多种gRNA组合使用对病毒进化的影响也值得考虑。
