氮源对Nannochloropsis oculata生化组成、超微结构及生产的影响
2019-05-25王玉仙杨海麟
王 鑫, 王玉仙, 赵 犇, 杨海麟
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
近年来人们对健康的追求不断提升,由于ω-3族长链多不饱和脂肪酸具有预防心脑血管疾病等医疗功效,逐渐被市场青睐。微拟球藻属(Nannochloropsis)微藻是一种优质的水产养殖饲料,富含二十碳五烯酸EPA(Eicosapentaenoic acid,20:5-Δ5,8,11,14,17),其胞内油脂及 EPA 含量受光照[1]、氮源种类及浓度[2-3]等因素影响。微藻油脂是制备生物柴油的理想原料[4],由于微拟球藻在氮匮乏条件下油脂质量可达藻体干质量的55%~68%,已被研究者视为生产生物柴油的潜力藻种之一。近年来,研究者对微拟球藻属多个种进行全基因组测序及基因注释[5]、功能基因克隆表达[6]等研究工作,并针对其开发了高效的电转化同源重组技术[5],微拟球藻现已成为模式藻种之一。
氮源是微藻生长主要营养元素之一,是组成蛋白质和DNA的重要元素,在培养基中主要以硝酸盐、亚硝酸盐、铵盐及尿素形式提供。藻类代谢硝酸盐需要经过三大步骤:1)外界环境中的硝酸盐在专一性透酶作用下进入细胞质,此步骤需要消耗能量; 2)硝酸盐经NAD (P)H-硝酸盐还原酶(EC 1.6.6.2)及铁氧还蛋白-亚硝酸盐还原酶(EC 1.7.7.1)催化还原为铵根离子,此步骤需要消耗大量还原力;3)铵根离子经谷氨酰氨合酶-谷氨酸合酶循环被加载到碳骨架上。铵盐的吸收代谢不需要还原酶的参与。绿藻的硝酸盐还原酶(EC 1.6.6.2)主要位于叶绿体中的蛋白质核上[7];绿藻的亚硝酸盐还原酶(EC 1.7.7.1)主要位于叶绿体区域,包括类囊体及蛋白质核上[8]。因此,藻类还原硝酸盐主要的能量源于叶绿体的光反应过程中产生的ATP和NADPH。
陆向红等[3]研究发现,眼点微拟球藻更易同化铵根离子。本研究显示,眼点微拟球藻细胞代谢不同类型氮源(氯化铵、乙酸铵、硝酸钠)的途径及能量需求差异,在微观方面会造成主要生化组分及细胞超微结构差异,宏观方面会造成微藻生物量及生产强度差异。
1 材料与方法
1.1 材料与仪器
眼点微拟球藻(Nannchloropsis oculata):购自中国海洋大学微藻种质库; 培养基:人工海水添加f/2营养元素。
LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;FA 1004电子天平:上海上天精密仪器有限公司;JY 1002电子天平:上海精密科学仪器有限公司;DK-8D电热恒温水槽:上海精宏实验设备有限公司;T6新世纪紫外可见光光度计:北京普析通用仪器有限责任公司;DZS-706A多参数分析仪:上海仪电科学仪器股份有限公司;HYL-A全温摇瓶柜:太仓市强乐实验设备有限公司;DHG-9140A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;GC-2010气相色谱仪:日本SHIMADZU;R-501旋转蒸发仪:无锡申科仪器有限公司;3K15离心机:德国SIGMA。
1.2 实验方法
1.2.1 预培养实验 采用500 mL鼓泡瓶反应器培养,装液量为400 mL,起始藻浓度调整至0.1 g/L左右,置于恒温光照摇瓶柜中,培养条件为:温度(25 ± 1) ℃,光强 13 μmol/(m2·s),培养基中初始硝态氮浓度为3 mmol/L,预培养5 d至其生长进入对数生长中期后,8 000 r/min离心10 min,弃去上清液,再用灭菌去离子水重悬清洗藻体后离心弃上清液,最后用不含氮的培养基重悬。
1.2.2 不同类型氮源补料实验 将预培养获得的种子液调节质量浓度至0.1 g/L并分配至500 mL鼓泡瓶反应器,装液量为400 mL,分别补加氯化铵、乙酸铵、硝酸钠浓缩液,并控制每组初始氮元素浓度约为3 mmol/L,控制培养基pH 8~9范围内。培养5 d至各组生长进入对数生长中期,取样测定各组生化组分、油脂和脂肪酸组成以及细胞超微结构,培养30 d至各组生长进入稳定期后,计算细胞生产强度。
1.2.3 生物量测定 参照巩波等[9]方法,采用紫外可见光光度计测定各组样品在688 nm处的吸光值,计算培养液中微拟球藻质量浓度。
生物量(g/L) =0.182 8A688-0.009(R2=0.993)
1.2.4 生化组分测定 分别取藻液1、2、2、2 mL测定叶绿素a、总蛋白质、总油脂、总糖。叶绿素a质量浓度测定采用潘欣等[10]的二甲基甲酰胺(DMF)法测定。
叶绿素 a(mg/L) =12.7A663-2.35A645
总蛋白质质量测定采用福林酚法[11],以牛血清白蛋白BSA作标准曲线。
总蛋白质质量(μg) =714A660-40(R2=0.996)
总油脂质量测定采用磷酸香草醛法[12],以微拟球藻藻油作标准曲线。
总油脂质量(μg)=87A530-2.7(R2=0.999)
总糖质量测定采用硫酸苯酚法[13],以葡萄糖作标准曲线。
总糖(μg)=278A485-8.6(R2=0.995)。
1.2.5 脂肪酸组成检测 取10 mL藻液,8 000 r/min离心10 min,弃上清液,60℃干燥箱烘干1 h。加入0.5 mol/L NaOH/甲醇 2 mL,60℃水浴 1 h,冷却至室温,加入4℃保存的25%三氟化硼甲醇溶液2 mL,60℃水浴30 min,冷却至室温,加入饱和NaCl溶液1 mL,2 mL正己烷,振荡 60 s,静置2 min分层,取正己烷相用于检测。检测前样品要用无水Na2SO4脱水,0.22 μm有机滤膜过滤后上样,防止损坏气相色谱柱。色谱柱型号:Agilent HP-INNOWAX(30 m×0.25 mm×0.25 μm),火焰离子检测器 FID。升温程序:130℃恒温2 min,每分钟10℃的升温速率升高到180℃,之后每分钟4℃的升温速率升高到240℃并保持6 min。进样口温度250℃,检测器温度250℃。载气N2流速为3 mL/min,H2流速为40 mL/min,空气流速为 400 mL/min,分流比为 10∶1,进样量为 1 μL。
1.2.6 藻油提取 取100 mg冻干微拟球藻藻粉,加入石英砂充分研磨,将获得的粉末平分至40 mL具塞聚丙烯离心管中,各加入20 mL甲醇∶氯仿∶去离子水(体积比 2∶1∶0.8),剧烈振荡混匀,8 000 r/min离心10min,将上清液合并后各取15mL加入到30mL具塞玻璃离心管,加入氯仿及去离子水调整甲醇∶氯仿∶去离子水(体积比 2∶2∶1.8),振荡混匀,3 000 r/min离心10 min,合并下层氯仿层于旋蒸瓶中,设置40℃、50 r/min旋蒸去除氯仿后得藻油。
1.2.7 油脂分离 取1 g藻油,加入10 g正己烷∶乙醚(体积比 1∶1),室温搅拌 1 h,分装至 10 mL 离心管,8 000 r/min离心10 min,将上层液倒入旋蒸瓶,设置40℃、50 r/min旋蒸去除溶剂后得中性藻油;下层残油中加入10 g丙酮,混匀后于4℃静置12 h,分装至10 mL离心管,8 000 r/min离心10 min,将上层液倒入旋蒸瓶,设置40℃、50 r/min旋蒸去除溶剂后得极性藻油。
1.2.8 藻细胞透射电镜观察 取10 mL藻液,8 000 r/min离心10 min,弃上清液,用PB缓冲液(pH 7.5)重悬后离心,弃上清液,重复此操作两次。用2.5 g/dL戊二醛4℃固定48 h,充分漂洗后用1 g/dL锇酸4℃固定2 h,用酒精、丙酮梯度脱水各30 min,然后用Epon812包埋聚合 (35℃ 16 h,48℃ 24 h,65℃48 h)。金刚石刀超薄切片后用200目铜网收集。经醋酸铀和柠檬酸铅双重染色后,TEM-2100透射电子显微镜观察[13]。
1.3 数据处理
采用origin软件进行分析,每个实验重复3次,实验所得值为平均值加上标准偏差。
2 结果与分析
2.1 氮源类型对眼点微拟球藻生化组分的影响
2.1.1 对主要生化组成的影响 氮源是微藻生长主要营养元素之一,在培养基中主要以硝酸盐、亚硝酸盐、铵盐及尿素形式提供。氮源类型差异会影响微藻氮代谢,进一步造成胞内生化组分的变化。图1显示了氯化铵、乙酸铵、硝酸钠这三种氮源对眼点微拟球藻胞内叶绿素a、总蛋白质、总碳水化物及总油脂质量分数的影响。
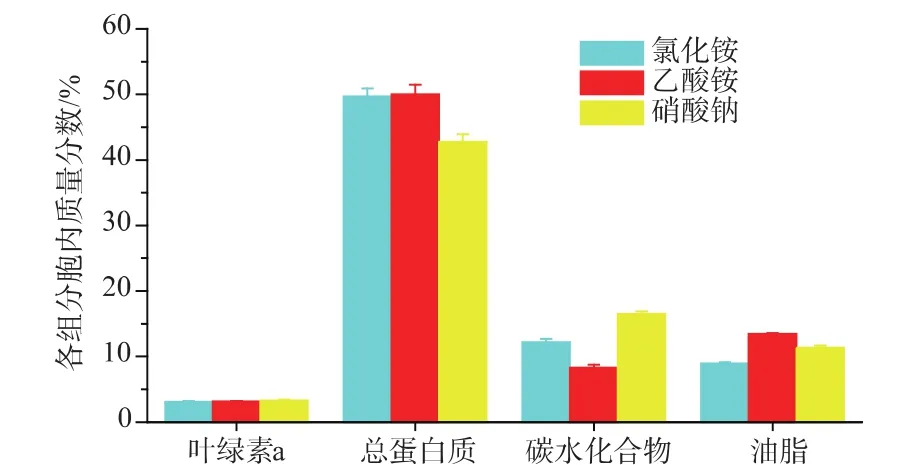
图1 不同氮源类型眼点微拟球藻胞内主要生化组分的变化Fig.1 Variations of the main biochemical composition of N.oculata grown under different kind of nitrogen sources
培养终了时,氯化铵、乙酸铵、硝酸钠组的胞内叶绿素 a质量分数分别为 3.12%、3.16%、3.32%;胞内总蛋白质质量分数分别为49.7%、50.0%、42.8%;胞内碳水化合物质量分数分别为12.2%、8.3%、16.5%;胞内油脂质量分数分别为8.9%、13.5%、11.4%。叶绿素a是微拟球藻仅含的叶绿素类型,其胞内叶绿素a质量分数受培养环境及营养因素影响。Sukenik等[1]研究发现光强与叶绿素a质量分数负相关; Simionato等[14]研究发现缺氮会造成叶绿素a质量分数降低。作者研究发现,氮源类型也会影响胞内叶绿素a质量分数,硝酸钠组叶绿素a质量分数比氯化铵、乙酸铵组分别提高了6.4%、5.1%。不同氮源类型同化吸收需要消耗的能量存在差异,同化一分子铵根离子需要消耗ATP及NADPH各一分子;硝态氮同化吸收,需要经硝酸盐还原酶[7]、亚硝酸盐还原酶[8]的催化生成铵根离子后才可被藻细胞直接利用,因此消耗的能量更多。微拟球藻同化氮源的最终能量来源为光能,增加叶绿素a质量分数有利于光能吸收,从而强化藻细胞光反应,产生大量的同化力(ATP、NADPH及还原态的铁氧还蛋白),用于同化硝态氮。
微拟球藻利用硝态氮合成蛋白质需要多种酶的参与,且消耗大量能量,因此硝态氮同化效率较铵氮低。作者研究发现,氯化铵、乙酸铵组蛋白质质量分数差异很小,但均高于硝酸钠组,且较之分别提高了16.1%、16.8%。
氯化铵、硝酸钠组碳水化合物质量分数大于油脂含量,乙酸铵组结果相反。研究表明,微拟球藻在缺氮培养条件下,碳元素主要流向油脂[2]; 氯化铵、硝酸钠组结果表明,在氮充足情况下,微拟球藻固定的碳元素主要流向碳水化合物。Schneider等[15]研究发现,微拟球藻利用乙酸盐合成脂肪酸,且主要用于延长碳链。乙酸铵组结果表明,微拟球藻利用乙酸铵一方面利用铵根离子合成蛋白质,另一方面利用乙酸合成油脂,因此乙酸铵组的油脂质量分数高于其余两组。
2.1.2 对油脂及脂肪酸组成的影响 氮源类型不仅影响微拟球藻胞内总油质量分数,对其油脂及脂肪酸组成也有影响。表1结果显示,极性油与中性油的比值均大于1,说明在氮源充足的条件下,微拟球藻主要合成结构性极性油,而储能性中性油合成较少。
进一步分析各实验组总油中的脂肪酸组成,结果见表 2。 微拟球藻主要脂肪酸为软脂酸(C16∶0)、棕榈油酸(C16∶1)和 EPA(C20∶5n-3),氯化铵、乙酸铵、硝酸钠组总油中EPA相对含量分别为25.2%、23.1%、26.6%,硝酸钠组EPA相对含量最高。不同脂肪酸在不同脂质中分布存在显著差异。Schneider等[15]研究发现,微拟球藻极性油中的单半乳糖基二酰甘油MGDG高含EPA(可达53.2%),且MGDG在极性油中的占比(可达28%)均高于其他极性油脂组分[16],这可能与MGDG在维持叶绿体膜完整性中起的作用有关[17]; 微拟球藻中性油中的三酰甘油TAG几乎不含EPA,而高含短链饱和脂肪酸。因此,EPA富集于极性油中,短链饱和脂肪酸富集于中性油内。硝酸钠组极性油与中性油比值最大,EPA相对含量最高; 乙酸铵组比值最小,EPA相对含量最低,C16∶0相对含量最高。
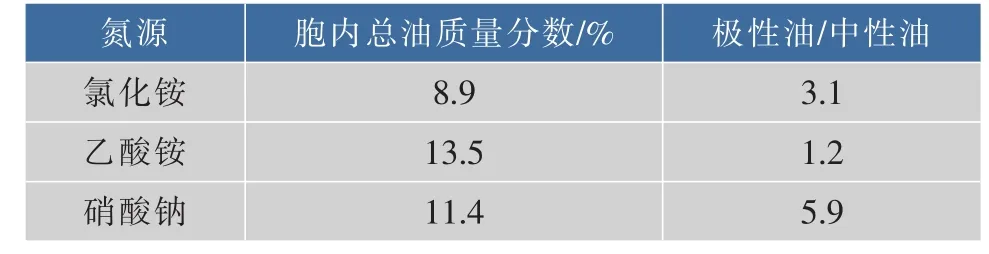
表1 氮源类型对胞内总油质量分数及油脂极性的影响Table 1 Effects of nitrogen sources on cellular lipid content and polarity of N.oculata
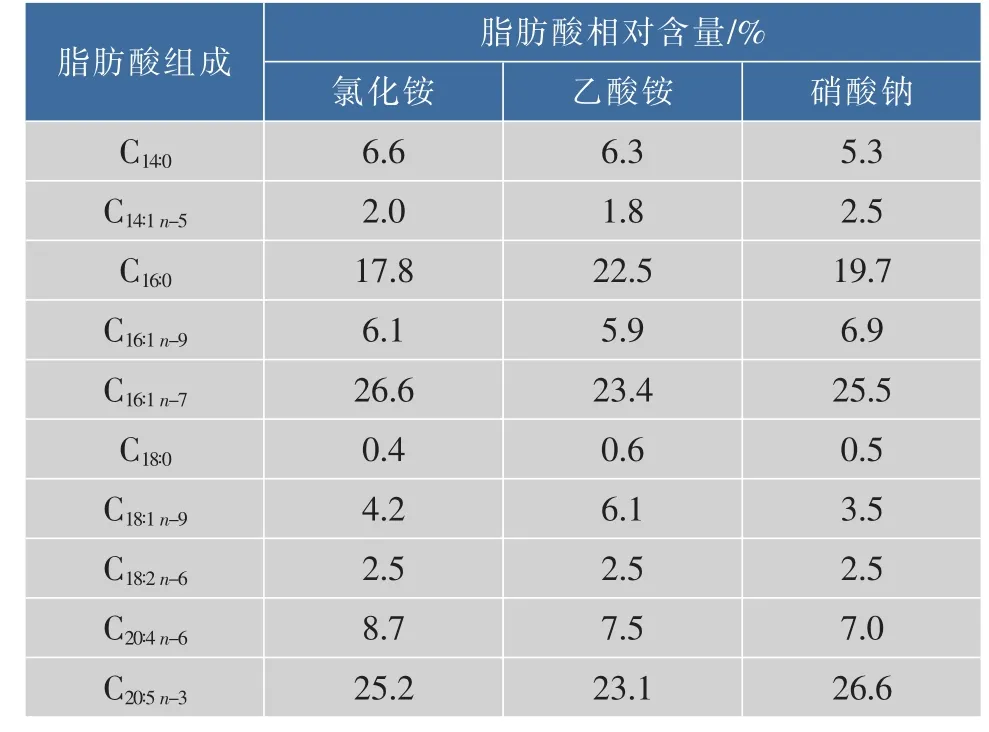
表2 氮源类型对眼点微拟球藻脂肪酸组成的影响Table 2 Effects of nitrogen sources on fatty acid profile of N.oculata
2.2 氮源类型对细胞超微结构的影响
培养环境及营养类型会对细胞超微结构产生相应影响,这是细胞适应环境及调整胞内代谢后产生的变化。图2展示了不同氮源类型下的微拟球藻细胞超微结构,2(a)-(c)分别为氯化铵、乙酸铵、硝酸钠组藻细胞透射电镜图。
表3结果显示,采用氯化铵、乙酸铵培养的眼点微拟球藻细胞尺寸明显大于硝酸钠组。Herman Campos等[18]研究了4种氮源(硝酸钠、尿素、氨水、氯化铵)对盐生微拟球藻细胞尺寸的影响。结果显示,采用尿素培养时细胞尺寸最小为2.9 μm,氨水及氯化铵组尺寸大于硝酸钠组。微拟球藻细胞尺寸越小,比表面积越大,营养及光能吸收效率越高。

图2 不同氮源类型眼点微拟球藻超微结构图Fig.2 Ultrastructure of N.oculata grown under different kind of nitrogen sources
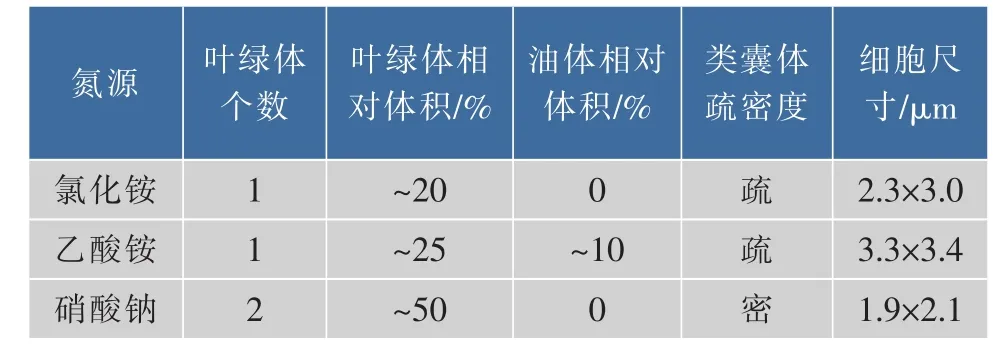
表3 不同氮源类型眼点微拟球藻细胞形态分析Table 3 Morphometric summary of cellular components of N.oculata grown under different kind of nitrogen sources
叶绿体是进行光合作用的专门细胞器,叶绿体大小、个数、类囊体密度对光合效率存在影响。不仅光强及氮源浓度会影响微拟球藻叶绿体数量及超微结构[1,14],本研究结果显示氮源类型也会产生影响。表3结果显示,硝酸钠组的叶绿体数量、相对体积、类囊体密度均高于氯化铵、乙酸铵组,因此硝酸钠组光合效率更高。硝酸钠组叶绿体量及质方面的改变是微拟球藻适应硝态氮代谢后产生的。
油体是微藻细胞内主要用于储存能量的细胞器,微拟球藻在缺氮胁迫情况下可积累大量三酰甘油并存储于油体中,油体几乎充满整个细胞[14]。本研究显示在氮源充足情况下,乙酸铵组也存在少量油体,相对体积约占细胞体积的10%,其余两组均无明显的油体存在,造成差异的原因可能是眼点微拟球藻利用乙酸盐合成的过量的脂肪酸被储存于油体中。
2.3 氮源类型对生物量及生产强度的影响
氮源类型在微观上影响了眼点微拟球藻的生理生化,宏观上则表现为其生物量和生产强度差异。图3显示氯化铵、乙酸铵、硝酸钠组的最终生物量分别为 817、873、775 mg/L; 生产强度分别为23.4、25.3、22.0 mg/(L·d)。 因此,采用乙酸铵生产微拟球藻生物质最佳,其生产强度分别比氯化铵、硝酸钠组提高了6.9%和12.6%。陆向红等[3]研究了尿素、氯化铵、乙酸铵对眼点微拟球藻生长的影响,发现乙酸铵为氮源时,眼点微拟球藻生物量最大。
3 结 语
氮源类型对眼点微拟球藻的生理生化及生产均会造成影响。采用铵盐培养的眼点微拟球藻胞内蛋白质质量分数、细胞尺寸明显大于硝酸钠组,生物量及生产强度也高于硝酸钠组。乙酸铵组生物量及生产强度最大,分别为 873 mg/L 和 25.3 mg/(L·d)。采用硝酸钠培养眼点的微拟球藻叶绿素a质量分数、叶绿体数量、相对体积、类囊体密度均高于铵盐组,EPA相对含量最高,为26.6%;总碳水化合物质量分数最高,为16.5%。乙酸铵培养的微拟球藻存在油体,总油质量分数最高,为13.5%。
