借助传感器探究碳酸钠与碳酸氢钠的热稳定性
2019-05-15徐建菊吴晓红
徐建菊 吴晓红


摘要: 对酒精灯加热条件下碳酸钠与碳酸氢钠时导管插入澄清石灰水均出现浑浊的现象,进行理论分析并设计实验进行探究。用二氧化碳传感器测定在酒精灯加热条件下,碳酸钠、碳酸氢钠试样及灼烧约1小时的碳酸氢钠密闭体系内二氧化碳浓度的变化情况。结果表明,用酒精灯加热时,碳酸氢钠不稳定易分解,而碳酸钠很稳定不易分解。通过分析此现象,有助于深化学生对碳酸钠与碳酸氢钠热稳定性的理解。
关键词: 碳酸钠; 碳酸氢钠; 热稳定性; 二氧化碳传感器; 实验探究
文章编号: 10056629(2019)4006304中图分类号: G633.8文献标识码: B
1 问题的提出
《普通高中化学课程标准(2017年版)》在对素养4“科学探究与创新意识”划分的水平4中指出“能用数据、图表、符号等处理实验信息;能对实验中的‘异常现象和已有结论进行反思、提出质疑和新的实验设想,并进一步付诸实施”[1]。由此可知实验过程中出现的“异常现象”隐含着可挖掘的潜在知识和价值。笔者在进行碳酸钠与碳酸氢钠热稳定性区别的实验时发现了“异常现象”,即酒精灯在加热碳酸钠和碳酸氢钠固体时,将导管插入澄清石灰水中,澄清石灰水都变浑浊了。对于碳酸钠和碳酸氢钠热稳定性的比较,人教版高中化学教材安排在“科学探究”栏目中,进行套管实验,实验过程中师生一起得出关于碳酸钠和碳酸氢钠的热稳定性,即碳酸钠加热不分解,碳酸氢钠加热易分解[2];鲁科版高中化学教材安排在“活动·探究”栏目中,得出的结论是:“实验表明,在酒精灯加热的条件下,碳酸钠不能分解,而碳酸氢钠能分解生成碳酸钠、水和二氧化碳”[3];苏教版高中化学教材安排在“活动与探究”栏目中,通过实验得出关于碳酸钠和碳酸氢钠的化学性质对比的表格,表格中关于二者热稳定性是这样描述的:“碳酸钠稳定、碳酸氢钠不稳定”[4]。三个版本教材在对于二者热稳定性的描述中都能得出碳酸钠稳定而碳酸氢钠不稳定这一说法,可见笔者所得实验现象与教材描述不相符。基于这一实验现象,笔者设计了实验,借助维尼尔(Vernier)二氧化碳传感器实时采集密闭体系中二氧化碳浓度的变化来区别碳酸钠与碳酸氢钠的热稳定性。
2 实验原理
许多盐受热会发生分解反应,由于盐的种类不同,分解产物的类型、分解反应的难易有很大差别。对于无机含氧酸盐,较为普遍的是受热分解生成原始组成的氧化物或酸和碱,同种金属对应的碳酸盐较碳酸氢盐的热稳定性强[5]。
二氧化碳传感器在化学实验中能够测量二氧化碳气体的浓度,测量结果表示为体积分数,测量范围为0到100000ppm。借助二氧化碳传感器可以实时准确地测量碳酸钠和碳酸氢钠受热过程中体系二氧化碳濃度的变化,由二氧化碳浓度的变化来说明碳酸钠与碳酸氢钠热稳定性的区别。
3 实验过程
3.1 仪器、药品和材料
威尼尔(Vernier)二氧化碳传感器、数据采集器、USB数据线、电脑和配套软件、origin 7.5软件
碳酸钠(AR)、碳酸氢钠(AR)
酒精灯、火柴、止水夹、乳胶管、自制具支大试管、铁架台、药匙、称量纸、分析天平、烘干箱、蒸发皿、玻璃棒、三脚架
3.2 实验步骤
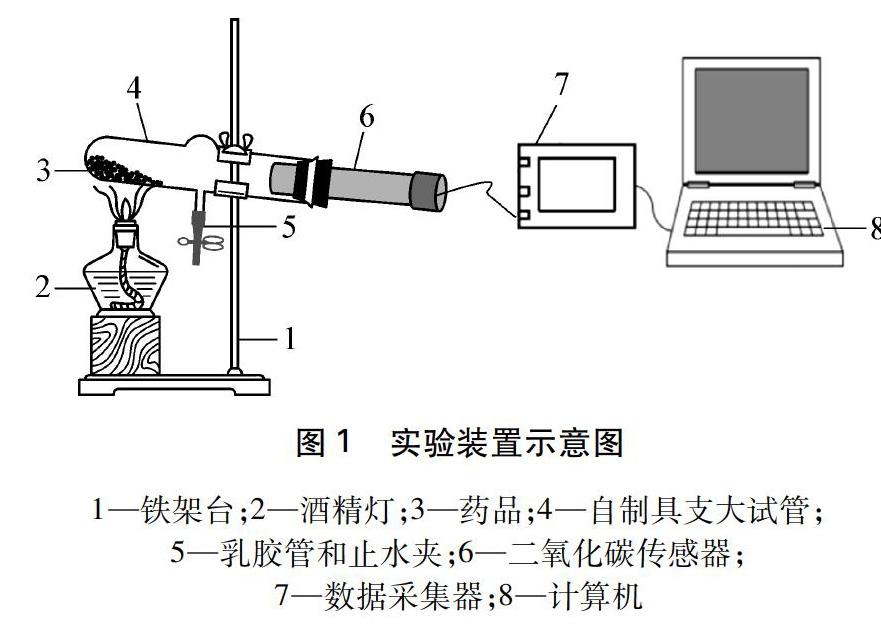
(1) 组装仪器: 如图1所示,连接好仪器,固定装置并检查装置的气密性。
1—铁架台;2—酒精灯;3—药品;4—自制具支大试管;5—乳胶管和止水夹;6—二氧化碳传感器;7—数据采集器;8—计算机
(2) 装药品: 称取约0.5g碳酸钠固体于自制具支大试管底部,塞上二氧化碳传感器。
(3) 开始实验: 打开电脑上软件,设置软件菜单栏中“实验”中“数据采集”为“持续采集数据”,点击“采集”按钮,传感器开始预先采集试管内二氧化碳浓度,待数据稳定后点燃酒精灯,先对试管底部预热再集中加热,实验持续到数据较为平缓时即可停止采集,保存实验数据,后期用origin 7.5软件完成作图。
(4) 清洗试管并干燥,称取约0.5g碳酸氢钠固体于试管底部,塞上二氧化碳传感器,重复步骤(3),保存实验数据并做相关的处理。
(5) 清洗试管并干燥,将灼烧约1h冷却后的0.5g碳酸氢钠固体于试管底部,塞上二氧化碳传感器,重复步骤(3),保存实验数据并做相关的处理。
4 图像分析
4.1 加热碳酸钠固体体系CO2随时间变化情况
由图2可知,曲线先缓慢上升后趋于平缓,体系二氧化碳浓度在增加,此情况下说明酒精灯加热能使碳酸钠固体分解。加热0.5g碳酸钠固体得到图2曲线大约用时1400s,对曲线进行线性拟合,得到一定时间内体系二氧化碳浓度的变化速率约为5.104ppm/s,图中停止加热时体系二氧化碳浓度约为12170ppm,即为1.217%。
4.2 加热碳酸氢钠固体体系CO2随时间变化情况
由图3可知,曲线呈急剧上升趋势,到一定时间后瞬间保持平衡(注: 本实验中二氧化碳传感器量程为0~100000ppm,超过该量程无法测量,故瞬间保持平衡),体系二氧化碳浓度在急剧增多,说明酒精灯加热能使碳酸氢钠固体快速分解。加热0.5g碳酸氢钠固体得到图3曲线大约用时100s,对曲线进行线性拟合,得到一定时间内体系二氧化碳浓度的变化速率约为1545ppm/s,图中停止加热时体系二氧化碳浓度约为100242ppm,即为10.0242%。
4.3 分析讨论
本实验中由图2、图3可得出相应的结论:“碳酸钠和碳酸氢钠固体在酒精灯加热的条件下都能分解产生二氧化碳”,这一结论与笔者实验(澄清石灰水变浑浊)相符合。然而在鲁科版教材中明确指出在酒精灯加热的条件下,碳酸钠不能分解,故而不能使澄清石灰水变浑浊,本文实验中的结论只有碳酸氢钠符合教材描述。基于这一现象,我们考虑到可能是以下几个问题所致: (1)传感器的问题;(2)药品的问题;(3)加热的问题。针对这几个问题,我们依次进行了试验,对于问题(1),我们用二氧化碳传感器检测了空气中二氧化碳浓度,检测结果约为295ppm,即空气中二氧化碳浓度约为0.0295%,该实验数据与人教版九年级化学教材中所说二氧化碳在空气中浓度约为0.03%[6]几乎相等。此外我们又进行了空白实验,只对试管进行加热,传感器采集到的二氧化碳浓度并未上升,由此可知传感器没问题,实验中的“异常现象”不是传感器所致;对于问题(2),我们更换另一分析纯的碳酸钠固体重复实验依旧得到图2;对于问题(3),其实质是温度的高低。查阅教材得知碱金属对应的碳酸盐其受热分解温度由上而下依次升高,分解温度依次是碳酸锂<碳酸钠<碳酸钾<碳酸铷<碳酸铯,书中给出碳酸锂的分解温度是1543K,即1300℃[7],由此可知碳酸钠热分解的温度高于1300℃。而借助手持技术中的高温传感器测得酒精灯的温度最高达不到1000℃[8],由此可知酒精灯加热条件下碳酸钠固体是不会分解的。若想让碳酸钠受热分解,热源提供的温度必须不小于其热分解温度。造成图2的现象只能说明是药品的问题,即碳酸钠固体中含有极少量的碳酸氢钠固体或其他受热极易分解的碳酸盐。为进一步用实验来说明问题,我们称取约0.5g碳酸氢钠固体,用酒精灯灼烧约1h,冷却后放入自制具支试管中,塞上二氧化碳传感器,重复步骤(3),得到图4。
4.4 加热灼烧后的碳酸氢钠固体体系CO2随时间变化情况
由图4可知,对灼烧约1h后的0.5g碳酸氢钠固体再次进行加热,曲线基本保持平缓与x轴重合(注: 有略微的上升趋势主要是因为灼烧时间长短导致极少量碳酸氢钠固体还未分解完全)。加热0.5g灼烧约1h后的碳酸氢钠固体得到图4曲線大约用时600s,对曲线进行线性拟合,得到一定时间内体系二氧化碳浓度的变化速率约为1.182ppm/s,图中停止加热时体系二氧化碳浓度约为920ppm,即为0.092%。此图已能说明一定的问题,若继续对0.5g碳酸氢钠固体灼烧,到一定时间后再用二氧化碳传感器进行数据采集,理论上会得到体系二氧化碳浓度基本保持不变的曲线,由此可进一步确定碳酸钠固体在酒精灯加热的条件下是不会分解的,实验中出现的现象是药品不纯所致。
5 结论
通过实验可知,当酒精灯作为热源进行加热时,碳酸钠固体很稳定不会分解,而碳酸氢钠固体不稳定易分解,且分解速率较快。导致这样的区别除物质本身的性质外还与受热温度密切相关,一旦受热温度达到碳酸钠固体分解温度时,碳酸钠也能分解。
6 结语
化学试剂的纯度常会影响实验结论与理论分析不相符的情况,当此现象出现时,教师的处理方式在一定程度上决定了学生知识的掌握情况和对待学习的态度。针对碳酸钠与碳酸氢钠热稳定性教学,倘若教师只是一味地给学生灌输碳酸钠加热不分解而碳酸氢钠加热易分解这一结论,而对其本质原因却不做解释,当实验过程中出现“异常”现象时,又叫学生如何去分析呢?综上,为避免学生“知其然而不知其所以然”这一现象的发生,教师在授课过程中应结合学生情况随时调整教学方式,当宏观现象不明显时教师可借助诸如二氧化碳传感器等手持技术进行实验探究活动,使实验现象数据化、直观化,方便学生理解和记忆。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[M]. 北京: 人民教育出版社, 2018: 91.
[2]宋心琦主编. 普通高中课程标准实验教科书·化学1[M]. 北京: 人民教育出版社, 2007: 56.
[3]王磊主编. 普通高中课程标准实验教科书·化学1[M]. 济南: 山东科学技术出版社, 2007: 64~65.
[4]王祖浩主编. 普通高中课程标准实验教科书·化学1[M]. 南京: 江苏教育出版社, 2014: 52.
[5][7]武汉大学, 吉林大学等校编. 无机化学(下册)[M]. 北京: 高等教育出版社, 1994: 707~710.
[6]王晶, 郑长龙. 义务教育课程标准实验教科书·化学(上册)[M]. 北京: 人民教育出版社, 2012: 27.
[8]吴晓红, 刘万毅, 任斌. 基于手持技术的中学化学实验案例[M]. 北京: 冶金工业出版社, 2016: 7~8.
