紫色红曲霉固态发酵豆渣产红曲色素的工艺研究
2019-05-13孔维宝杨树玲张爱梅牛世全
孔维宝,陈 冬,杨 洋,杨树玲,张爱梅,牛世全
(1.西北师范大学 生命科学学院,兰州 730070; 2.金徽酒股份有限公司,甘肃 陇南 742308)
豆渣是豆制品加工过程中的主要副产物,我国作为大豆生产大国、进口大国和消费大国,据测算每年产生2 000多万t的湿豆渣,产量大、来源广[1]。豆渣营养丰富,富含膳食纤维、蛋白质、钙、磷、铁、维生素等多种营养成分,是目前动物日粮中最常用的蛋白饲料,但高纤维含量以及多种抗营养因子的存在,导致豆渣不易被机体降解消化,使其利用率降低,且在加工过程中产生的豆腥味无法去除,最终导致豆渣的开发利用效果不佳[2-3]。研究表明,微生物发酵豆渣不仅能有效缓解这些不利因素,还可进一步提高其营养价值,是豆渣高效利用的有效途径之一[4]。
红曲霉(Monascus)为一种小型丝状腐生真菌,其代谢过程中可产生红曲色素、Monacolin类胆固醇合成抑制剂、抑菌性物质等多种生理活性物质,尤其是红曲色素被视为安全性极高的天然食用色素,还可预防多种疾病,有望替代化学合成色素,在食品领域广泛使用[5-6]。以红曲霉进行固态发酵是获取其代谢产物的主要途径之一,目前固态发酵法生产红曲色素主要以大米为原料进行发酵,但以大米为固态发酵基质生产红曲色素的成本较高,在工业上很难实现大规模生产[7]。因此,从绿色环保和有效开发利用农业废弃物的角度出发,将豆渣、豆粕、玉米、麦麸等一些廉价的农产品及其加工废弃物用作固态发酵基质,用来发酵生产红曲霉次级代谢产物及微生物饲料的研究具有重要的实际应用价值。已有的研究表明红曲霉可利用多种农林废弃物进行固态发酵生产生物活性物质[8]。基于此,本文主要探讨了以紫色红曲霉(Monascuspurpureus)固态发酵豆渣产红曲色素的可行性,对以豆渣为固态发酵基质产红曲色素的工艺进行了优化,以期筛选出廉价高效的有机固态发酵基质和工艺参数,为红曲霉固态发酵制剂(营养强化剂或功能饲料)的开发提供实验依据和技术参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种与试剂
紫色红曲霉(M.purpureus)菌株由作者所在实验室从市售红曲米中分离、鉴定并保藏。
无水乙醇、硫酸镁、硝酸钠、磷酸二氢钾、甘油,均为分析纯;红曲红标准品(上海源叶生物科技有限公司)。
1.1.2 仪器与设备
DHP-9080B改良恒温恒湿培养箱(上海琅玕实验设备公司),GI54TW高压蒸汽灭菌锅(致微仪器有限公司),AC2-4S1生物安全柜(新加坡艺思高),CP124C分析电子天平(上海奥豪斯仪器有限公司),TG20-WS离心机(湖南湘立科学仪器有限公司),FCD-3000恒温鼓风干燥箱(上海琅玕实验设备公司),UV-2800紫外可见分光光度计(尤尼柯仪器有限公司)。
1.1.3 培养基
菌种保藏培养基:马铃薯葡萄糖琼脂培养基(PDA)。
种子培养基:葡萄糖30 g/L,蛋白胨10 g/L,KH2PO41 g/L,MgSO4·7H2O 1 g/L,自然pH。
固态发酵基质:分别以干燥的豆渣(大豆制品加工废弃物)、大米、大豆粉、去皮大豆粉和小麦麸皮为发酵基质,各称取20 g后加一定量的蒸馏水混匀调节初始含水量,121℃灭菌20 min。
1.2 实验方法
1.2.1 发酵种子液的制备
取4℃冰箱保存的M.purpureus接种于PDA斜面培养基,30℃活化培养5~7 d,向活化后的PDA斜面培养基中加入5 mL无菌水,轻轻刮下孢子,制成孢子悬浮液。吸取2 mL孢子悬浮液接种于含有100 mL种子培养基的250 mL锥形瓶中,于200 r/min、30℃恒温振荡培养箱中培养2 d。
1.2.2 发酵培养
向固态发酵培养基中接入一定量发酵种子液,控制温度30℃、湿度60%~65%的条件下发酵培养。
1.2.3 红曲色素的测定
标准曲线制作:精密称取10 mg红曲红标准品,用70%乙醇溶解定容至100 mL,配制成质量浓度为0.1 mg/mL红曲红溶液。精密吸取1、2、3、4、5、6 mL至10 mL容量瓶中,70%乙醇定容至刻度,得到10、20、30、40、50、60 μg/mL的红曲红标准溶液。70%乙醇作空白,分别测定各质量浓度溶液在505 nm处的吸光值,并以质量浓度(y)为纵坐标,505 nm处的吸光值(A)为横坐标绘制标准曲线,得线性回归方程为y=0.097A+0.002 1,R2=0.998 53。
红曲色素测定:将发酵后的固态基质冷冻干燥后粉碎,称取1.00 g样品加入10 mL 70%乙醇,60℃水浴提取2 h后,3 000 r/min离心10 min,取上清液;沉淀物在相同条件下重复提取2次,合并上清液,定容、稀释后测定505 nm处的吸光值。按照标准曲线方程计算红曲色素含量。
1.2.4 数据统计与分析
采用Origin 9进行数据统计,SPSS 22和Latin.lnk正交设计助手用于数据分析。
2 结果与分析
2.1 不同固态发酵基质对M. purpureus产红曲色素的影响
不同固态发酵基质大米、去皮大豆粉、大豆粉、豆渣和小麦麸皮分别加入10、15、20 mL水调整基质初始含水量分别为33.33%、42.86%、50%,按10%的接种量接入发酵种子液,按1.2.2发酵培养14 d后,测定发酵固体样品中的红曲色素含量,探究不同固态发酵基质对M.purpureus产红曲色素的影响,结果如图1所示。

图1 不同固态发酵基质对红曲色素含量的影响
由图1可知,固态发酵基质初始含水量低,不利于红曲色素的产生,整体来看,在基质初始含水量50%的条件下产红曲色素的效果相对较好。原因在于固态发酵中几乎没有游离水,微生物生长所需水分主要依赖于基质初始含水量,较低的基质初始含水量加上后期的蒸发,导致基质较干,不足以满足微生物大量生长繁殖对水分的需求,从而抑制了紫色红曲霉的生长[9]。整体来看,大米和豆渣发酵基质产红曲色素的效果最好,且两者差距不大,远高于去皮大豆粉、大豆粉和小麦麸皮产红曲色素的量。由于大米主要成分为淀粉,被红曲淀粉酶降解为葡萄糖加以利用,为紫色红曲霉的生长提供了丰富的碳源,此外大米发酵基质保湿效果也相对较好,利于色素的积累[10-11]。而大豆的蛋白质、脂肪、膳食纤维含量较高,为紫色红曲霉的生长提供了丰富的碳、氮源。豆渣是大豆经物理压榨或高温处理得来的,加工过程中更容易使一些不溶性膳食纤维大分子转变为小分子低聚体的膳食纤维降解物,被微生物利用,同时豆渣颗粒度大于大豆粉,不易粘连成块,增加了CO2和O2的通透性,不仅促进了紫色红曲霉生长,还增加了红曲色素的积累[12]。通过比较去皮大豆粉和大豆粉的红曲色素的量可以推测,大豆皮中可能存在某种物质能够促进紫色红曲霉发酵产红曲色素,也可能由于大豆皮的存在增大了发酵基质间的孔隙,增加了通气性。基于发酵基质廉价且能高产红曲色素的目标,本文选取豆渣做进一步的优化实验。
2.2 不同营养因子对M.purpureus固态发酵豆渣产红曲色素影响的单因素实验
2.2.1 甘油添加量的影响
甘油作为能被红曲霉快速利用的常用碳源之一,不仅价格低廉容易获得,还可使菌体生长过程完成后仍保持碳代谢的饥饿状态,促进红曲色素的大量积累[13-14]。以豆渣为固态发酵基质,在接种量10%、豆渣加水量15 mL的条件下,按1.2.2发酵培养14 d,考察不同甘油添加量(1%、3%、5%、7%、9%)对M.purpureus产红曲色素的影响,结果如图2所示。

图2 甘油添加量对红曲色素含量的影响
由图2可知,甘油添加量在1%~5%时,红曲色素含量呈现急速上升趋势,甘油添加量为5%~7%时,红曲色素含量缓慢上升,当甘油添加量在7%~9%时,红曲色素含量出现下降趋势,且甘油添加量为7%时红曲色素含量达到最大值。该现象可能是由于低浓度的甘油作为碳源促进了紫色红曲霉生物量的积累,逐渐提高红曲色素含量。当甘油添加量大于7%时,碳源积累过多降低了发酵底物的pH,抑制产物积累[15]。
2.2.2 NaNO3添加量的影响
NaNO3是促进红曲霉产红曲色素的最佳氮源之一。以豆渣为固态发酵基质,在豆渣加水量15 mL、接种量10%条件下,按1.2.2发酵培养14 d,考察不同NaNO3添加量(0.01%、0.04%、0.07%、0.10%、0.13%、0.16%)对M.purpureus发酵产红曲色素的影响,结果如图3所示。

图3 NaNO3添加量对红曲色素含量的影响
由图3可知,NaNO3添加量在0.01%~0.04%时,红曲色素含量呈现上升的趋势,NaNO3添加量在0.04%~0.16%时,红曲色素含量逐渐降低,且豆渣中NaNO3添加量为0.04%时红曲色素含量达到最大值。NaNO3为紫色红曲霉的生长繁殖提供氮源,在低浓度NaNO3的添加范围内,氮源被紫色红曲霉充分利用,增加生物量的同时提升了红曲色素含量。当NaNO3添加量达到饱和后,不再被紫色红曲霉利用,此时高浓度的NaNO3抑制了紫色红曲霉的生长代谢[16]。
2.2.3 KH2PO4添加量的影响
以豆渣为固态发酵基质,在豆渣加水量15 mL、接种量10%条件下,按1.2.2发酵培养14 d,考察不同KH2PO4添加量(0.1%、0.2%、0.3%、0.4%、0.5%)对M.purpureus发酵产红曲色素的影响,结果如图4所示。

图4 KH2PO4添加量对红曲色素含量的影响
由图4可知,KH2PO4添加量在0.1%~0.2%内,红曲色素含量缓慢上升,在0.2%~0.4%的范围内,红曲色素含量迅速增加,KH2PO4添加量在0.4%~0.5%时,红曲色素含量呈现下降趋势,且KH2PO4添加量为0.4%时红曲色素含量达到最大值。无机盐浓度可以显著影响菌体细胞的生长和红曲色素的形成,因此低浓度的无机盐有益于紫色红曲霉的生理活动,而当浓度过高时主要表现为抑制等负面效应,该结果与周建建等[17]结果趋势相似。
2.2.4 MgSO4添加量的影响
以豆渣为固态发酵基质,在豆渣加水量15 mL、接种量10%条件下,按1.2.2发酵培养14 d,考察不同的MgSO4添加量(0.1%、0.2%、0.3%、0.4%、0.5%)对M.purpureus发酵产红曲色素的影响,结果如图5所示。

图5 MgSO4添加量对红曲色素含量的影响
由图5可知,MgSO4添加量在0.1%~0.2%内,红曲色素含量逐渐上升,在0.2%~0.4%的范围内,红曲色素含量急速下降,在0.4%~0.5%时,红曲色素含量呈现平稳状态,MgSO4添加量为0.2%时红曲色素含量达到最大值,此时MgSO4促进了紫色红曲霉的生理活动和红曲色素的产生,当添加量大于0.2%时,浓度过高则抑制了紫色红曲霉的生长。
2.2.5 抗坏血酸添加量的影响
抗坏血酸能够在一定程度上提高红曲色素的稳定性,同时还能促进红曲霉的生长和色素的产生[18]。以豆渣为固态发酵基质,在豆渣加水量15 mL、接种量10%条件下,按1.2.2发酵培养14 d,考察不同的抗坏血酸添加量(0.5%、1%、1.5%、2%、2.5%)对M.purpureus产红曲色素的影响,结果如图6所示。
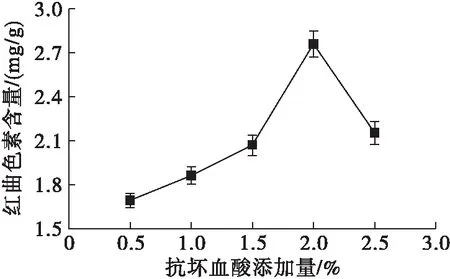
图6 抗坏血酸添加量对红曲色素含量的影响
由图6可知,抗坏血酸添加量在0.5%~1.5%的范围内,红曲色素含量缓慢上升,在1.5%~2%内,红曲色素含量急速上升,当抗坏血酸添加量由2%逐渐增加到2.5%时,红曲色素含量呈下降趋势,且在抗坏血酸添加量为2%时,红曲色素含量达到最大值。由于紫色红曲霉产红曲色素的最佳条件为中性偏酸,而少量抗坏血酸的添加使发酵环境逐渐偏酸性,利于红曲色素的积累,当抗坏血酸添加量超过2%时过酸的发酵环境开始抑制紫色红曲霉的生长[19]。
2.3 不同发酵条件对M. purpureus固态发酵豆渣产红曲色素影响的单因素实验
2.3.1 基质初始含水量的影响
在豆渣中加入蒸馏水,得到不同初始含水量(30%、40%、50%、60%和70%)的基质,在接种量10%条件下,按1.2.2发酵培养14 d,考察初始含水量对发酵的影响,结果如图7所示。

图7 基质初始含水量对红曲色素含量的影响
由图7可知,当初始含水量从30%增加到50%时,红曲色素含量逐渐上升,当初始含水量从50%增加到60%时,红曲色素含量急速下降,初始含水量从60%增加到70%时,红曲色素含量缓慢降低后趋于平稳。初始含水量在50%时,红曲色素含量达到最大值。造成上述现象的主要原因是初始含水量低使得紫色红曲霉生长受到抑制,到发酵后期,由于微生物对水分的消耗及蒸发损失造成物料较干,抑制微生物生长。当含水量过高时,减少了基质内气体的交换,不利于微生物生长[20]。郑虹等[7]以大米和玉米的混合物为固态发酵基质,含水量约为57%时红曲色素含量较高;王金字等[9]以糯米为固态发酵基质,在初始含水量为50%时红曲色素含量最高;Babitha等[21]以菠萝蜜种子粉为基质,50%的含水量条件下产色素效果较好。可以看出,初始含水量在50%左右时,紫色红曲霉固态发酵产红曲色素效果较好。
2.3.2 接种量的影响
接种量的多少会影响到整个发酵的效果,一般要求适量。通常采用大的接种量可以缩短菌体繁殖达到高峰的时间,使产物的形成提前到来,并可减少杂菌的生长机会,但接种量过大也会导致单位体积内养料和溶氧不足,干扰菌体繁殖代谢[16]。在豆渣中加入15 mL蒸馏水,设置不同接种量(2%、4%、6%、8%、10%),按1.2.2发酵培养14 d,考察接种量对发酵的影响,结果如图8所示。

图8 接种量对红曲色素含量的影响
由图8可知,当接种量从2%增加到8%时,红曲色素含量呈现先缓慢上升,后急速上升的趋势。当接种量大于8%时,红曲色素含量呈现下降趋势,从而确定豆渣培养基产红曲色素的最佳接种量为8%。
2.3.3 发酵时间的影响
在豆渣中加入15 mL蒸馏水、接种量10%条件下,按1.2.2分别发酵培养6、8、10、12、14 d,考察发酵时间对发酵的影响,结果如图9所示。
由图9可知,发酵时间从6 d逐渐增加到12 d时,红曲色素含量也随之增加,且在发酵时间为12 d时,红曲色素含量达到最大值。微生物发酵都有一个最佳时间,发酵时间过短,不利于目标产物(红曲色素)的积累,发酵时间过长,由于营养物质的消耗及多种代谢产物的积累导致环境不利于菌体生长,导致红曲色素含量下降[22]。
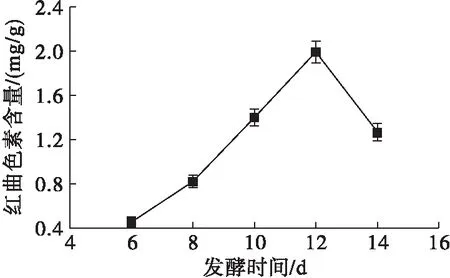
图9 发酵时间对红曲色素含量的影响
2.4 正交实验优化
结合单因素实验结果,固定豆渣初始含水量50%、接种量8%、发酵时间12 d,以甘油添加量(A)、NaNO3添加量(B)、KH2PO4添加量(C)、MgSO4添加量(D)和抗坏血酸添加量(E)为考察因素,以红曲色素含量为响应值,采用Latin.lnk正交设计助手设计L16(45)的五因素四水平正交实验,正交实验因素水平见表1,正交实验设计及结果见表2。

表1 正交实验因素水平

表2 正交实验设计及结果
由表2可知,5个因素对M.purpureus固态发酵豆渣产红曲色素的影响程度大小顺序为抗坏血酸添加量>甘油添加量>KH2PO4添加量>NaNO3添加量>MgSO4添加量。固态发酵产红曲色素的最优固态发酵培养基组合为A2B2C1D2E3,即:甘油6%,NaNO30.04%,KH2PO40.3%,MgSO40.2%,抗坏血酸2.2%。在优化的培养基组合下进行3次验证实验,红曲色素含量可达(6.03±0.11)mg/g。
3 结 论
(1)从大米、去皮大豆粉、大豆粉、豆渣和小麦麸皮5种固体基质中筛选出廉价的大豆制品加工副产物——豆渣作为适宜生产红曲色素的固态发酵基质。
(2)采用单因素实验和正交实验,确定以紫色红曲霉固态发酵豆渣产红曲色素的优化培养基组成为豆渣初始含水量50%,添加甘油6%、NaNO30.04%、KH2PO40.3%、MgSO40.2%、抗坏血酸2.2%;最佳培养条件为控制湿度60%~65%、接种量8%、30℃发酵12 d。在最佳条件下,发酵豆渣中红曲色素含量可达(6.03±0.11)mg/g。
(3)以豆渣为主要原料固态发酵生产红曲色素具有良好的可行性和经济性。一方面经紫色红曲霉发酵的豆渣可作为提取生产红曲色素的原料,另一方面富含生物活性物质的红曲豆渣可直接作为功能性生物饲料或红曲制剂,可显著提高豆渣的利用度和附加值。
