二甲胺盐酸盐与氯胺生成NDMA动力学研究
2019-04-28唐丽娜张跃军
唐丽娜,贾 旭,张跃军
二甲胺盐酸盐与氯胺生成NDMA动力学研究
唐丽娜,贾 旭*,张跃军
(南京理工大学化工学院,江苏 南京 210094)
研究了二甲胺盐酸盐与氯胺反应生成N,N-亚硝基二甲胺(NDMA)的动力学.采用隔离法测定得到反应物浓度与时间的变化关系,进而采用尝试法求解反应级数、速率常数、速率方程和活化能.结果表明:对于二甲胺盐酸盐与氯胺反应生成中间体的第一步过程,反应物两者的反应级数均为一级,反应速率常数在5,15和25℃下分别为1.5361×10-3,1.8707×10-3,7.7217×10-3mol-1×min-1,反应活化能a为51.27kJ/mol.由反应速率常数和活化能数值可以看出温度高有利于反应的进行.所得结果可为含二甲胺基及其同系物与氯胺整体反应的动力学研究,以及原水处理过程中消毒副产物NDMA生成风险的判定提供实验依据.
N,N-亚硝基二甲胺;二甲胺;盐酸盐;氯胺;动力学;活化能
N,N-亚硝基二甲胺(NDMA)是最简单的双烷基亚硝胺,为半挥发性黄色油状液体,具有较高的水溶性和强致癌性[1-4].自1989年在加拿大饮用水中首次检测到并确认其是与氯消毒剂使用有关的副产物[5-9]以来,世界各地不少水厂均有NDMA检出的报道.关于饮用水中NDMA的研究也得到了高度的重视.研究表明:当水体有氯胺,含有二甲胺基官能团化合物与其在一定条件下会生成消毒副产物NDMA[10-12],并且二甲胺(DMA)作为最简单的二甲胺基官能团化合物被认为是最直接的前驱物[13-16],研究确定了其与次氯酸盐、氯胺生成NDMA的可能性,特别是对其与氯胺反应的分步反应动力学常数进行了确认,但具体求解过程未涉及,反应物的反应级数和反应活化能数据没有述及[14].近年来在原水处理过程中,无论是水体本身或者原水处理絮凝剂中不可避免的可能含有二甲胺和二甲胺的各种盐[17],其中二甲胺盐酸盐在原水处理过程中与水体中的氯胺生成消毒副产物NDMA尚未有动力学方面的研究报道.
本文采用隔离法测定二甲胺盐酸盐与氯胺反应的反应物浓度与时间的关系,进而用尝试法研究该反应的动力学,由此拟合计算二者反应的反应级数、速率常数、速率方程和活化能等,旨在可为含二甲胺基的同系物与氯胺反应的动力学研究,以及水处理过程中遇到的二甲胺的各种盐类物质生成消毒副产物NDMA风险的判定提供实验依据.
1 材料与方法
1.1 材料和仪器
材料:氯化铵(³99.5%),国药集团化学试剂有限公司;次氯酸钠(活性氯³7.5%),西陇化工有限公司;N,N-二乙基-1,4-苯二胺(³96.0%),成都市科龙化工试剂厂;二甲胺盐酸盐(³99.0%),异丙醇,阿拉丁试剂有限公司;盐酸(=36%~38%)国药集团化学试剂有限公司;异丙醇(³99.5%)阿拉丁试剂;EDTA四钠(=99%),Strem公司;醋酸钠(=99%)Strem公司.以上试剂均为分析纯.
仪器:722N可见分光光度计,上海仪电分析仪器有限公司;PHS-25型pH计,上海雷磁仪厂.
1.2 分析方法
反应物氯胺和二甲胺盐酸盐浓度依据文献[14,18-19]方法测定.
1.2.1 一氯胺分析检测 一氯胺溶液作为本次研究的反应物,是由氯化铵和次氯酸钠在缓冲溶液中,通过控制pH值和按氯氮比4:1(投加的次氯酸钠有效氯质量和水中氨氮的质量比)在暗处反应一定时间配制而成(含有游离氯,一氯胺定量的溶液)[14].
一氯胺采用N,N-二乙基-1,4-苯二胺(DPD)的分光光度法定量[18].控制pH值在6.2~6.5范围内时,N,N-二乙基-1,4-苯二胺(DPD)可与水中游离的氯发生氧化还原反应形成红色的络合氧化产物的反应原理,测量游离氯的量.再依据DPD和少量碘化钾(KI)共存时,氯胺也能同时与DPD发生反应使溶液红色加深,依据此原理可测定游离氯与氯胺的总量[18].测定的总量扣除游离氯量后,就可以得到一氯胺的量.
由于游离氯标准溶液不稳定且不易获得,本文采用高锰酸钾溶液配制氯标准储备液和标准使用液, 再经其在由无氯纯水配置的缓冲溶液中与定量DPD溶液反应,在515nm处测定吸光度,余氯与吸光度的关系,用于制备氯标准曲线[18].
采用DPD-KI和DPD溶液同步与两个相同量反应液反应,测定515nm处吸光度,分别得到的是一氯胺-游离氯总含量的吸光度和游离氯含量的吸光度,再由两者的差值和氯标准曲线,可以求得反应液中的一氯胺吸光度和浓度(标准曲线法,标准曲线由一氯胺溶液制得)[18].
1.2.2 二甲胺盐酸盐浓度的测定 二甲胺盐酸盐定量采用二甲氨基二硫代甲酸铜比色法[19].二甲胺盐酸盐与检测试剂二硫化碳、氯化铜反应生成二甲氨基二硫代甲酸铜,在紫外波长430nm显色,基于此,采用分光光度法在该波长下,测得吸光度与二甲胺盐酸盐浓度变化关系(标准曲线法),再利用反应液与试剂反应后的实际样品吸光度大小,求得二甲胺盐酸盐的浓度.
1.3 实验原理与方法
1.3.1 反应式及动力学方程求算 根据文献[14]所述,二甲胺与氯胺反应生成NDMA的历程如下.
(1)
式中:12分别代表各步反应的反应速率常数,由于2>>1,即生成中间体UDMH过程为反应速控步骤.本文对式(1)进行简化,假设可以列出以下方程.
A+B®C (2)
式中:A为二甲胺盐酸盐;B为氯胺;
根据式(2)可以列出如下动力学方程
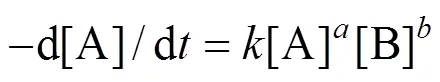
式中:[A]为不同时刻反应物A的浓度,mol/L;[B]为反应物B的浓度;为反应速率常数;为反应物A反应级数;为反应物B反应级数.
动力学研究中采用的是隔离法和尝试法.隔离法是除一种反应物外保持其它反应物大量过剩,以求取这种反应物分级数的方法;尝试法又称积分法或微分法(取决于尝试时用的公式),当实验测得了一系列C~动力学数据后,对数据进行级拟合作图,若为直线则反应即为级.因此,该反应过程中当控制反应物B的浓度远大于反应物A的浓度,即[B]³[A]时,式(3)可以写成如下格式:
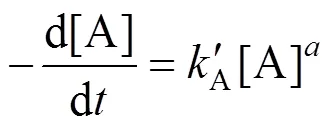
对式子两边进行积分得到:
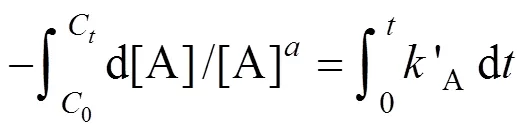
1.3.2 动力学研究设计 假定反应物A浓度符合级动力学模型,例如:一级或二级动力学模型,即当=1或2,分别对式(5)积分得到:
ln(C/0)=A¢+(6)
或
1/C-1/0 =A¢(7)
式中:C、0分别为时刻和初始时刻的反应物A浓度;为积分常数.对于不同假定的值,可以依次类推.
对于反应物B的反应级数和反应速率常数和反应物A的求解类似.
在特定实验温度下,通过实验测出某反应物浓度随时间变化的规律,对数据进行拟合,确定该反应物的反应级数和假级速率常数及其以该反应物为基的反应速率常数.由此方法,分别求取各反应物为基的速率常数,再取平均值,可得到该反应的速率常数.最终,得到反应动力学表达式.基于此,本文动力学研究实验采用隔离法和尝试法,依据隔离法得到若干组实验测得的C~数据,采用尝试法进行一级和二级拟合,即将数据用ORIGIN软件分别对数据ln(C/0)~或1/C~拟合等,拟合曲线为=+者,可用来确定反应物二甲胺盐酸盐和氯胺反应物各自的反应级数和假定的该级数速率常数,即反应级数和假级速率常数.由此,再求取各反应物为基的速率常数及其平均值,得到反应的总速率常数,最终得到反应物二甲胺盐酸盐与氯胺反应动力学表达式.
进一步,根据阿伦尼乌斯公式=-a/RT可知,温度时速率常数的对数与1/之间的线性关系.可按照上述方法,通过求取不同温度下的,再以ln对1/作图,从而求出活化能.本文将研究3种温度下的反应速率常数,根据ln对1/作图,斜率为-a,从而计算得到反应活化能.
1.3.3 实验方法 鉴于我国实际微污染原水处理现状,在前期预实验的基础上,选择温度分别为5,15和25℃,pH值为7.5条件下,进行二甲胺盐酸盐与氯胺反应生成NDMA过程第一步反应的动力学研究.
(1)25℃,pH值为7.5时二甲胺盐酸盐与氯胺反应级数和反应速率常数.取一定量二甲胺盐酸盐储备液于容量瓶中配制质量浓度为20mg/L (0.4437mol/L),再取二甲胺盐酸盐质量浓度20倍量的氯胺,约为400mg/L (7.770mol/L).用磷酸缓冲溶液调节溶液pH值为7.5,放入25℃水浴锅中,隔一段时间测定二甲胺盐酸盐的浓度,得到C~数据.对C~数据进行级拟合.由此,确认其反应级数和(假)速率常数A’.根据A和A’之间的关系,得到以二甲胺盐酸盐为基的速率常数A.
同理,二甲胺盐酸盐质量浓度取氯胺质量浓度的20倍,得到二甲胺盐酸盐与氯胺反应的氯胺浓度随时间变化曲线C~,再分别用假级拟合,例如,假一级和假二级速率方程拟合,确认其级反应级数和假级速率常数B.
联立动力学方程得到反应物各自为基的速率常数,通过求取A和B平均值得二甲胺盐酸盐与氯胺反应在25℃的反应速率常数.
(2)二甲胺盐酸盐与氯胺反应的活化能.在反应温度分别在5,15℃,按照步骤(1),测定各反应物的C~数据,进行线性拟合得到对应温度下的二甲胺盐酸盐与氯胺反应级数和反应速率常数以及反应速率方程表达式.根据阿伦尼乌斯公式,ln对1/作图,斜率为-E/,从而得到反应活化能E.
2 结果与讨论
2.1 25℃, pH=7.5时二甲胺盐酸盐与氯胺反应级数和反应速率常数
表1实验为氯胺过量的实验,其质量浓度为400mg/L(7.770mol/L);表2实验为二甲胺盐酸盐过量的实验,其质量浓度为400mg/L(8.8731mol/L),表中方程为数据C~进行ln(C/0)~或1/C~拟合得到的方程,2为拟合方程的相关系数.其中,数据处理过程中质量浓度均转化成物质的量浓度进行计算.
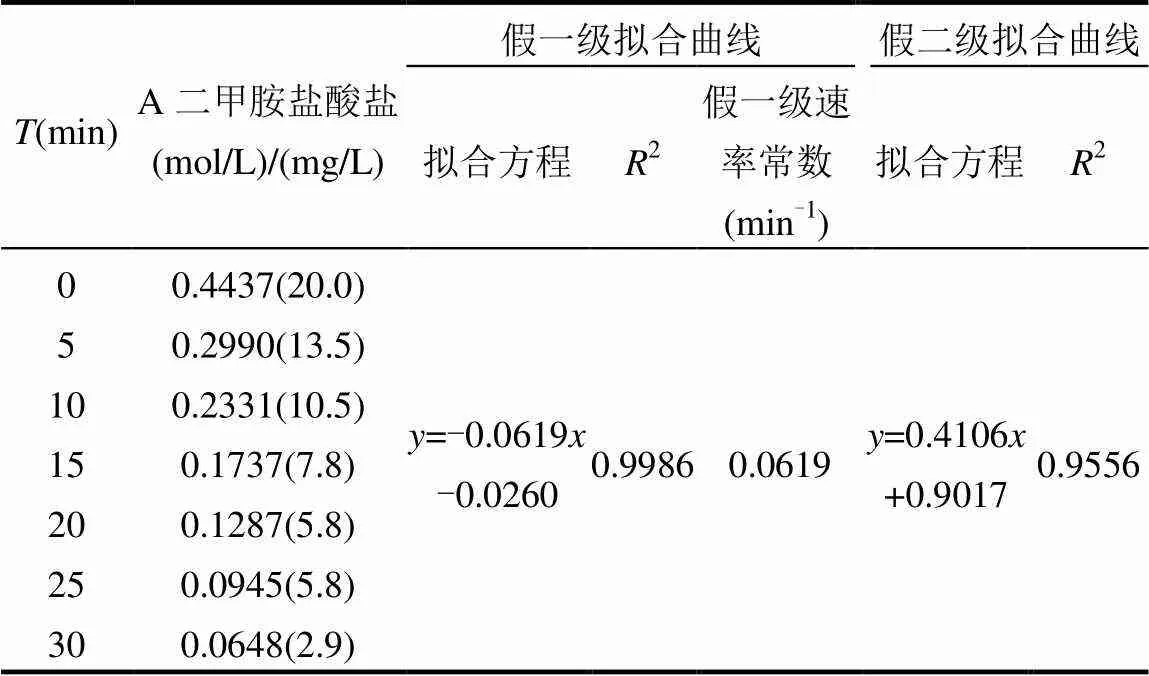
表1 二甲胺盐酸盐反应级数和速率常数
由表1数据进行二甲胺盐酸盐的一级和二级反应拟合作图,所得结果如图1、2所示.
由表1可以看出,在25℃,pH=7.5条件下,二甲胺盐酸盐的浓度~时间曲线一级拟合关系ln(C/C0)~线性较好(2=0.9986),且假一级速率常数为0.0619min-1,二级拟合关系1/C~线性较差(2= 0.9556),结合图1和图2,可以推断二甲胺盐酸盐衰减趋势符合一级反应动力学规律.
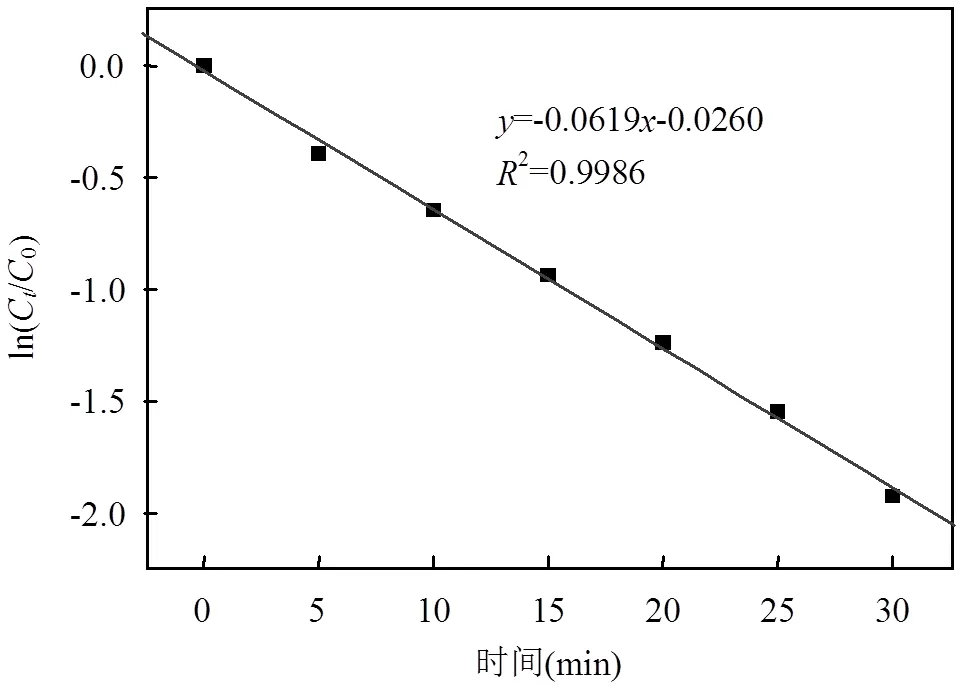
图1 二甲胺盐酸盐的一级反应拟合曲线
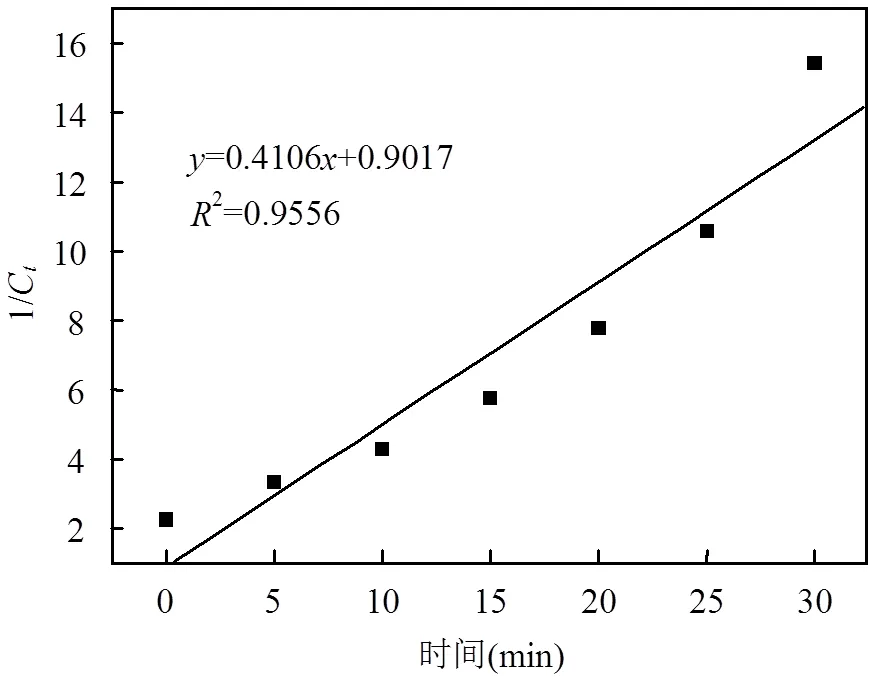
图2 二甲胺盐酸盐的二级反应拟合曲线
由表2数据进行氯胺一级和二级拟合作图,所得结果如图3、4所示.
从表2可以看出,在25℃,pH=7.5条件下,用隔离法实验时,氯胺的浓度~时间曲线按假一级拟合ln(C/C0)~具有较好的线性关系(2=0.9938),而二级拟合线性关系1/C~均较差(2=0.9232),可以推断氯胺的衰减趋势符合一级反应动力学规律.结合图3和图4,可以推断氯胺衰减趋势符合一级反应动力学规律.
由上述结果可以看出,二甲胺盐酸盐和氯胺的衰减趋势均符合一级动力学规律.由此得到以反应物为基础的速率常数及其平均值,即反应的速率常数.
二甲胺盐酸盐和氯胺反应的浓度~时间曲线分别求得的二级速率常数分别为7.4012×10-3,8.0421× 10-3mol-1·min-1,再由二者的平均值得到二甲胺盐酸盐和氯胺反应的速率常数7.7217×10-3mol-1·min-1,最终得到25℃下反应速率方程=7.7217×10-3[A][B].
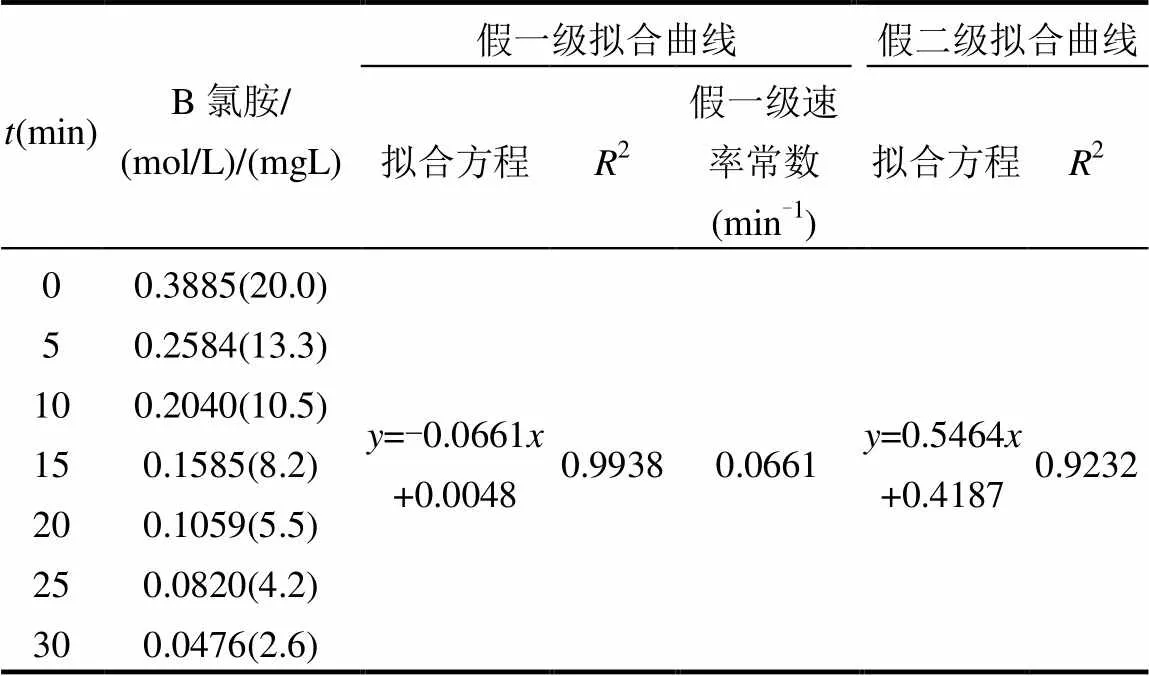
表2 二甲胺盐酸盐和氯胺反应中的氯胺反应级数和速率常数
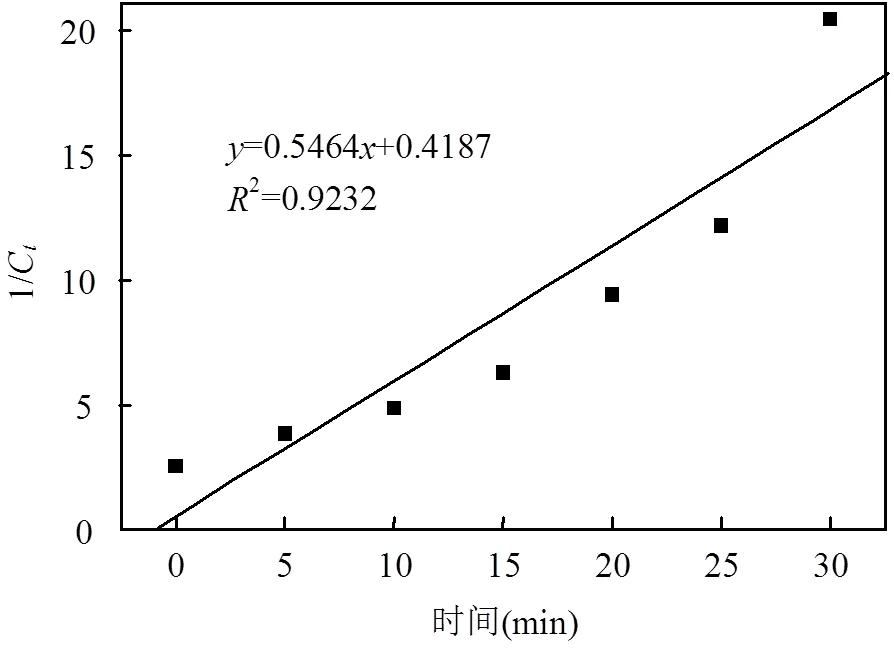
图4 氯胺二级拟合曲线
2.2 二甲胺盐酸盐与氯胺反应的活化能研究
其他条件按2.1不变,将反应温度分别设定为5和15℃,对二甲胺和氯胺测定C~数据,进行线性拟合等处理,最后得到二甲胺盐酸盐与氯胺在这2个温度条件下各自的反应级数、反应速率常数和平均值,见表3、4.结合2.1的研究结果可以求算得到反应的活化能,见表5.其中,表3中反应A为氯胺过量实验,B为二甲胺过量实验.
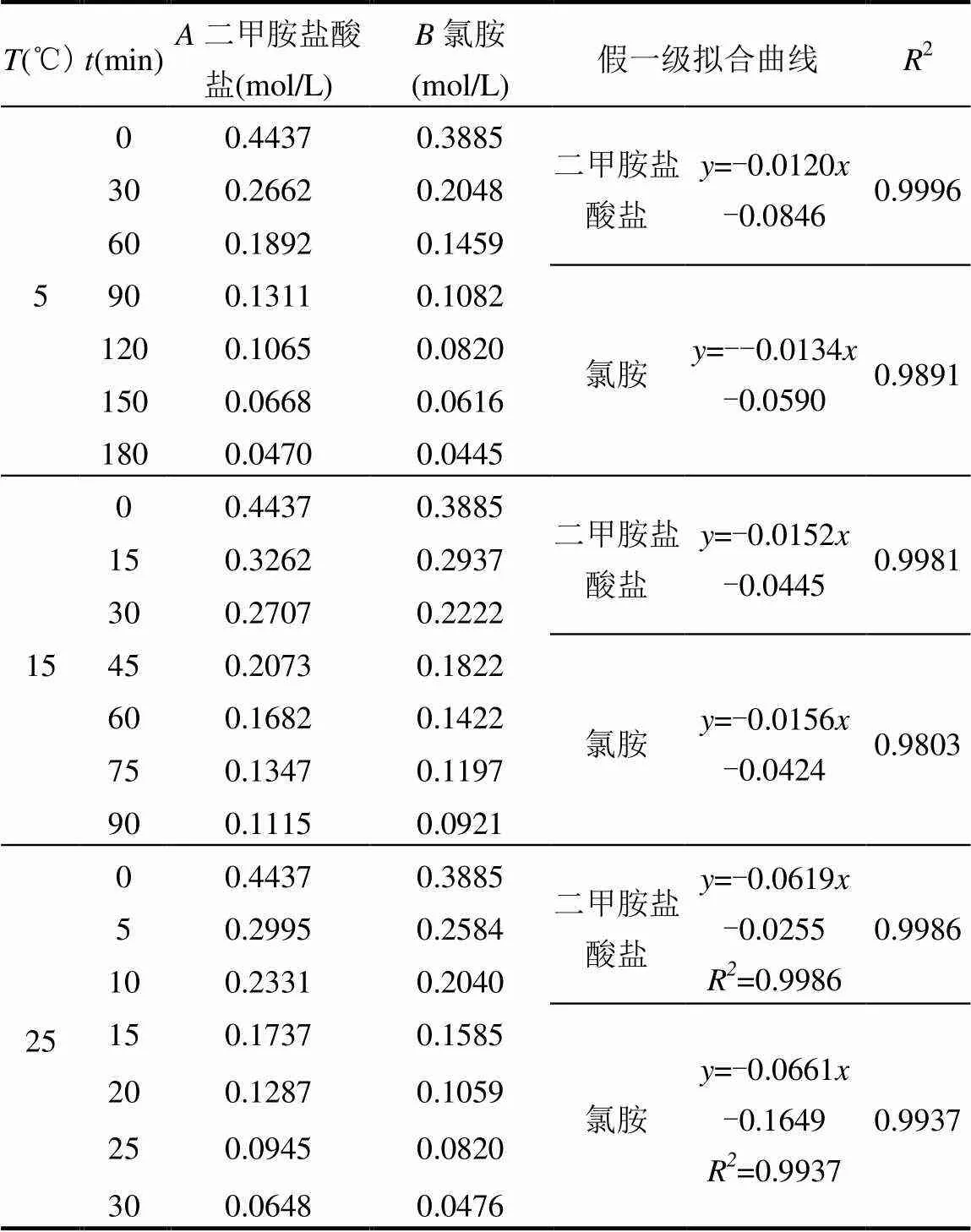
表3 不同温度下二甲胺盐酸盐和氯胺反应拟合方程
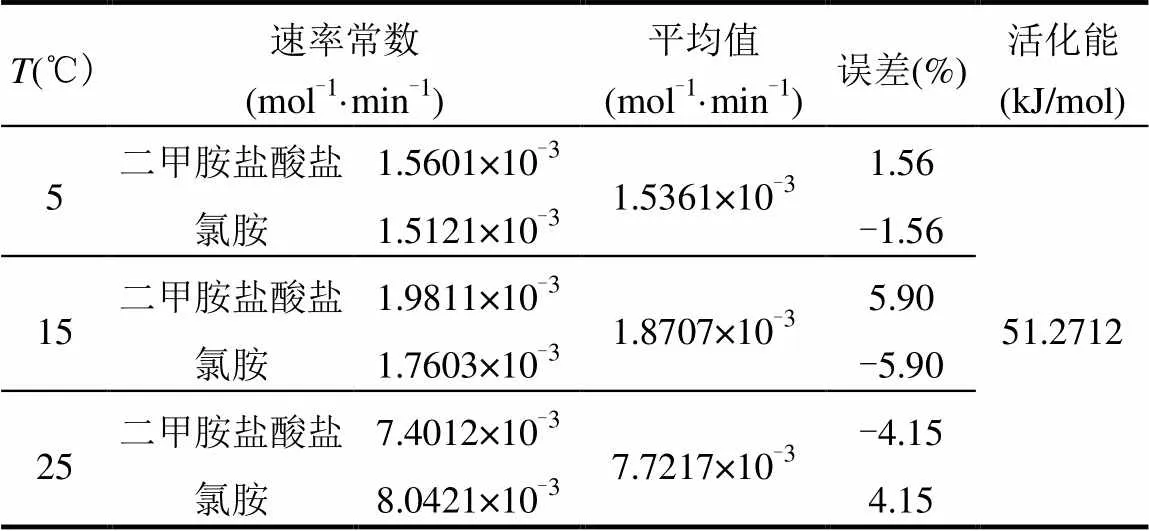
表4 5、15和25℃下二甲胺盐酸盐和氯胺反应速率常数及平均值
从表3、4可以得到,根据实验1.3.2速率方程推导式和表中数据得到以二甲胺盐酸盐和氯胺为基求得的反应速率常数,取两者平均值就可以得到二甲胺盐酸盐与氯胺反应的速率常数.5、15和25℃条件下的反应速率常数分别为1.5361×10-3,1.8707×10-3, 7.7217×10-3mol-1·min-1.

表5 二甲胺盐酸盐和氯胺反应速率方程及活化能
由表5可以看出:5、15和25℃条件下反应速率方程分别为:=1.5361×10-3[A][B],=1.8707×10-3[A] [B]和=7.7217×10-3[A][B].由速率常数求得反应活化能为51.2712kJ/mol.随着温度的上升,反应速率增大,活化能大于0,即升温有利于反应的进行.
2.3 讨论
2.3.1 选用二甲胺盐为反应物的合理性 众所周知,一方面, 由于二甲胺在室温下是气体,沸点仅为7 ℃,故虽然其易溶于水,但是其水溶液在室温条件下,二甲胺极容易挥发,即使是处在极低浓度,其浓度还是不稳定.因此,在实验过程中对其浓度测定的可靠性会有影响.相比于文献已有的二甲胺与氯胺反应动力学过程的研究[13],本文采用二甲胺的盐酸盐为反应物,由于二甲胺盐酸盐在水中溶解度比二甲胺高,且具有稳定性好,不易挥发等特点,因此研究二甲胺盐酸盐与氯胺反应动力学过程所得结果可能更为准确、可靠.由本文实验结果可知25℃,pH值7.5条件下时二甲胺盐酸盐与氯胺反应速率常数为7.7217×10-3mol-1·min-1,而文献[13]中25℃,pH值为7条件下二甲胺与氯胺反应的反应速率常数为7.68× 10-2mol-1·min-1,产生这样大的差异可能是反应原料和pH值条件不同对反应产生的影响.但是,值得注意的是,文献[13]研究在除给出速率常数外,未能提供更多的反应动力学信息.另一方面,实际上在自然水体中,由大分子逐步降解产生小分子胺(包括氨分子),极少能够以其分子形态的较高浓度形式存在,他们一旦生成就极易与水体中的无机盐阴离子(包括盐酸盐)结合而以盐形态的较高浓度形式存在.因此,选用二甲胺盐酸盐作为反应物研究,有利于提高实验结果可靠性,且更贴近自然水体实际情况,并具有一定的代表性.
2.3.2 反应历程对实验误差的影响 通常,实验结果的误差可分为随机误差和系统误差.随机误差是指操作者和实验过程随机发生的干扰对测定结果的影响;而系统误差则是指采用的实验方法固有的误差,例如,对本次研究应该是采用的检测方法本身的精度,反应物浓度设置,包括隔离法中两反应物浓度差的选定和一致性,等等.然而实际上,在本文实验测定二甲胺盐酸盐和一氯胺反应动力学参数过程中,除了上述通常所指的各种误差外,还存在来自于反应过程的干扰.由式(1)可知,二甲胺和一氯胺首先反应生成中间体UDMH等组分,最后才生成消毒副产物NDMA.因此,除了实验参数测定过程的随机和系统误差外,还会有这些生成的中间产物参与的、同步消耗反应物的反应发生.特别是,一氯胺是极具氧化性的物质,完全可以对第一步反应生成的中间体进行进一步氧化,而消耗自身浓度.这样,实验测定的C~定量关系会受到影响.
虽然在理论上,本文在任一指定温度下,应用隔离法和尝试法测得的以两个反应物为基的反应速率常数值应该一致,但是实际上两者并不一致,不但存在差距,而且这个差距(表4中以反应物为基的速率常数平均值),随着温度升高而变大,说明生成的中间产物对反应物浓度与时间关系C~测定结果的明显影响和这个影响的温度效应.依据动力学参数求取方法的特点,研究过程如采用隔离法和初始浓度法(防止反应产物的干扰),同步提高隔离法中反应物浓度差的一致性,就有可能进一步提高上述研究结果的精度和可靠性.
3 结论
3.1 二甲胺盐酸盐与氯胺反应动力学研究结果表明:用隔离法测得各反应物假一级拟合线性较好(相关系数均³0.9803),假二级拟合线性较差(相关系数均£0.9556),因此可以推断,对二甲胺盐酸盐和氯胺的反应为二级反应,而对每个反应物均符合一级反应动力学规律.
3.2 同一温度条件下,由二甲胺盐酸盐和氯胺各自为基求得的反应速率常数较接近,取两者平均值可得反应的速率常数.随着温度的增加,速率常数增大,且反应活化能大于0,说明升温有可加快反应的进行.
3.3 采用不同于文献以二甲胺为原料的动力学研究方法,以二甲胺盐酸盐为反应物,不仅可以使反应体系中二甲胺分子在较高浓度下稳定存在,提高其实验参数测定可靠性,而且可能更为符合实际水体中二甲胺的存在状况.
3.4 除了通常实验的随机和系统误差对动力学参数检测结果有影响之外,在本文研究的反应体系中,反应生成的各种中间体均可能参与消耗反应物的反应过程,影响动力学参数测定结果精度.用隔离法与初始浓度法组合有可能改进现有隔离法与尝试法组合方法的实验参数测定的精度和可靠性.
[1] 陈忠林,殷世忠,杨 磊,等.新型消毒副产物N-亚硝基二甲胺的研究进展[J]. 中国给水排水, 2007,23(22):6-11.Chen Z L,Yin S Z,Yang L,et al.N-Nitrosodimethylamine: A new disinfection by-product in water [J].China Water & Wastwater, 2007, 23(22):6-11.
[2] Nawrocki J, Andrzejewski P. Nitrosamines and water [J]. Journal of Hazardous Materials, 2011,189(1/2):1-18
[3] Chowdhury S, Rodriguez M J, Sadiq R. Disinfection byproducts in Canadian provinces: Associated cancer risks and medical expenses [J]. Chemical Hazards in Industry, 2011,187(1):574-584.
[4] Mitch W A, Sharp J O, Trussell R R, et al. N-Nitrosodimethylamine (NDMA) as a drinking water contaminant: A review [J]. Environment Engineering Science, 2003,20(5):389-404.
[5] Charrois J W A, Boyd J M, Froese K L, et al. Occurrence of N- nitrosamines in Albertapublic drinking-water distribution system [J]. Environment Engineering Science, 2007,6(1):103-114.
[6] Bei E, Shu Y, Li S, et al. Occurrence of nitrosamines and their precursors in drinking water systems around mainland China [J]. Water. Research, 2016,98:168-175.
[7] Wang W, Yu J, Wei A, et alOccurrence and profiling of multiple nitrosamines in source water and drinking water of China [J]. Science of the Total Environment, 2016,551-552:489-495.
[8] 吕 娟,沈 静,曹先仲,等.药物对A/A/O系统中NDMA及其总前体物去除的影响 [J]. 中国环境科学, 2015,35(5):1335-1342. Lv J, Shen J, Cao X Z, et al. Effects of pharmaceuticals on the removal of NDMA and NDMA total precursors in an anaerobic/ anoxic/ oxic System [J]. China Environmental Science, 2015,35(5):1335-1342.
[9] 韩 莹,王济禾,李 军,等.氧化铜催化零价铁还原水中亚硝基二甲胺 [J]. 中国环境科学, 2017,36(6):2100-2105. Han Y, Wang J H, Li J, et al. Copper oxide-catalyzed reduction of N-nitrosodimethylamine with zero-valent iron in water [J]. China Environmental Science, 2017,36(6):2100-2105.
[10] Ontario Ministry of the Environment and Energy .Drinking water protection—larger water works [EB/OL]. (2000-08-26)
[11] California Department of Health Services. NDMA in Californiadrinking water [EB/OL]. (2002-03-15)
[12] Leaveyroback S L, Krasner S W, Suffet I H. The effect of natural organic matter polarity and molecular weight on NDMA formation from two antibiotics containing dimethylamine functional groups. [J]. Science of the Total Environment, 2016,572:1231-1237.
[13] Sharma V K. Kinetics and mechanism of formation and destruction of N-nitrosodimethylamine in water – A review [J]. Separation purification Technology, 2012,88(2):1-10.
[14] Choi J, Valentine R L. Formation of N -nitrosodimethylamine (NDMA) from reaction of monochloramine: a new disinfection by-product [J]. Water. Research, 2002,36(4):817-824.
[15] Lim S, Lee W, Na S, et al. N-nitrosodimethylamine (NDMA) formation during ozonation of N, N-dimethylhydrazine compounds: Reaction kinetics, mechanisms, and implications for NDMA formation control [J]. Water. Research, 2016,105:119-128.
[16] West D M, Wu Q, Donovan A, et al. N-nitrosamine formation by monochloramine, free chlorine, and peracetic acid disinfection with presence of amine precursors in drinking water system. [J]. Chemosphere, 2016,153:521-527.
[17] 李潇潇.含PDMDAAC复合混凝剂的强化混凝脱浊效能及机制[D]. 南京:南京理工大学, 2012.Li X X. Studies on turbidity removel and mechanisms by enhanced coagulantion using composite coagulants containing poly- dimethyldiallylammonium [D]. nanjing: Nanjing University of Science and Technology, 2012.
[18] GB 5750.11-2006 生活中饮用水标准检验方法消毒剂指标 [S]. GB 5750.11-2006 Standard examination methods for drinking water disinfectants parameters [S].
[19] 张 勇,韩建荣,王春艳,等.环境空气中二甲胺的测定[J]. 干旱环境监测, 2008,22(4):193-195.Zhang Y, Han J R, Wang C Y, et al. Determination on dimethylamine in air [J]. Arid Environmental Monitoring, 2008,22(4):193-195
Kinetics of NDMA formation from dimethylaminehydrochlorate reacted with chloramine.
TANG Li-na, JIA Xu*, ZHANG Yue-jun
(Chemical Engineering School, Nanjing University of Science and Technology, Nanjing 210094, China)., 2019,39(4):1464~1470
The kinetics of NDMA formation from dimethylamine hydrochlorate reacted with chloramine were studied. The correlation between the reactant concentration and reacting time was measured by the isolation method, and then the order of reaction, the reaction rate constant, and rate equationas well as theactivation energy of dimethylamine hydrochlorate reacted with chloramine were obtained by the tentative method. The reaction of dimethylamine hydrochlorate with chloramine in first step to form an intermediate was second order and first order for both the salt and chloramine. The rate constants of dimethylamine hydrochlorate reacted with chloramines were 1.5361´10-3, 1.8707´10-3and 7.7217´10-3mol-1×min-1at 5, 15 and 25℃, respectively. The reaction activation energyawas 51.27kJ/mol. The observed rate constants and the activation energy suggested that the reaction was better under high temperatures. Our results could provide experimental data for the reactionkinetics of dimethylamine and its derivatives with chloramines to form NDMA, and for therisk analysis of NDMA as disinfection by-products in the raw water treatment.
N,N-nitrosodimethylamine (NDMA);dimethylamine;hydrochlorate;chloramines;reaction kinetics;activation energy
X131.2
A
1000-6923(2019)04-1464-07
2018-10-08
国家自然科学基金资助项目(21377054,51503100)
*责任作者, 副教授, jiaxu@njust.edu.cn
唐丽娜(1992-),女,安徽宿州人,南京理工大学硕士研究生,主要研究方向为环境水处理.
