走出思维定式 速解结构试题
2019-04-24宁夏王开山
宁夏 王开山
所谓思维定式,就是按照积累的思维活动、经验教训和已有的思维规律,在反复使用中形成的比较稳定的、定型化了的思维路线、方式、程序、模式。在试题解答中其积极的一面是:思维定式使人能够应用已掌握的方法迅速解决相关问题。消极的一面是:它容易使人形成一种呆板、机械、千篇一律的解题习惯,当新旧问题“形似质异”时,思维定式往往会使解题者步入误区。
笔者在教学中总结了物质结构试题解答中易形成的三种思维定式,与各位同行交流。
1.空间结构形成的思维定式
【例1】已知[Co(NH3)6]3+的立体结构如图1所示,各相邻的氨分子间的距离相等,Co3+位于正八面体的中心。若其中两个氨分子被Cl-取代,则所形成的[Co(NH3)4Cl2]+的同分异构体的总数为
( )
A.2 B.3 C.4 D.5
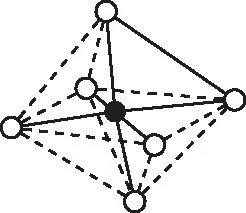
图1
【定式思维】八面体的基本结构是“一个平面,两个顶点”。
【错解】如图2,将图中6个NH3分别标记为1、2、3、4、5、6,其中3、4、5、6在一个平面内,1和2分别位于平面的正上方和正下方,则两个NH3被Cl-取代的方式有1,3取代、1,2取代、3,4取代、3,5取代,总数为4种,选择C。
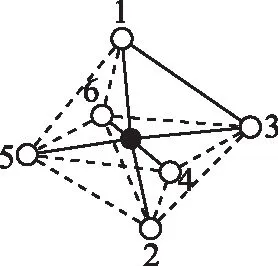
图2
【正解】根据题目信息,各相邻的氨分子间的距离相等,即该八面体为正八面体,两个NH3之间的关系只存在“邻位”和“对位”的关系,即同分异构体总数为2种,选择A。
2.均摊法形成的思维定式
【例2】最近发现一种由钛原子和碳原子构成的气态簇分子,如图3所示,顶角和面心的原子是钛原子,棱心和体心的原子是碳原子,它的化学式是。
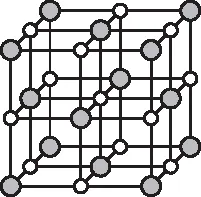
图3
【定式思维】采用均摊法可以确定化学式。
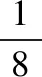
【正解】该分子为气态簇分子,分子式就是化学式。其分子式根据分子中各个原子的数目即可确定。该分子中钛原子数为14个,碳原子数为13个,即化学式为Ti14C13。
【例3】图4为某晶体的一部分空间结构示意图。图中“●”代表阳离子,“○”代表阴离子,则一个晶胞中含有的阳离子和阴离子数分别为。
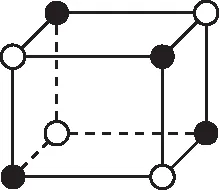
图4
【定式思维】这是一个晶胞,根据均摊法可以确定离子个数。
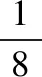
【正解】晶胞是构成晶体的最小重复单元,整块晶体可以看成是无数晶胞无隙并置构成的,所以上述立方体并不是完整的晶胞结构,该晶体的晶胞应该如图5所示:
图5
即该晶胞中阳离子和阴离子数均为4个。
3.元素种类与键的类型形成的思维定式
【例4】(2018·全国卷Ⅰ·35·节选)LiAlH4是有机合成中常用的还原剂,LiAlH4中存在(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
【定式思维】金属元素原子与非金属元素原子形成的是离子键。
【错解】Li、Al两种金属元素与非金属元素H形成的LiAlH4中,存在Li+、Al3+、H-,所以LiAlH4中只存在离子键,选择A。
【正解】常见元素电负性如下表:
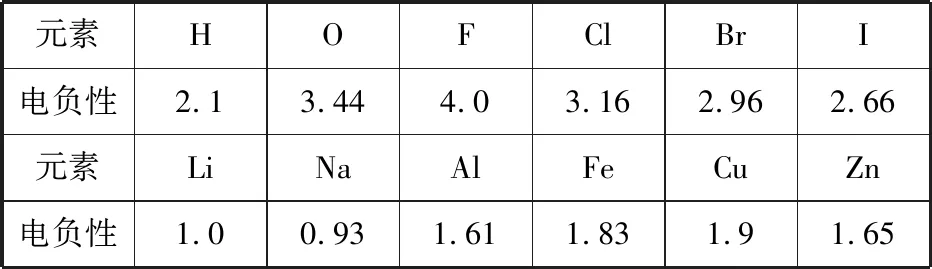
元素HOFClBrI电负性2.13.444.03.162.962.66元素LiNaAlFeCuZn电负性1.00.931.611.831.91.65
任何两种元素形成的化合物都不存在纯粹的离子键或共价键。一般来说,金属元素和非金属元素形成的化合物电负性差值小于1.7时,两种元素的原子之间主要为共价键成分,相应的化合物是共价化合物;金属元素和非金属元素形成的化合物电负性差值大于1.7时,两种元素的原子之间主要为离子键成分,相应的化合物为离子化合物。
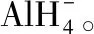
【例5】(2018·全国卷Ⅲ·35·节选)ZnF2具有较高的熔点(872℃),其化学键类型是;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________。
【解析】根据元素电负性之间的差值,ZnF2中主要含离子键,属于离子晶体;ZnCl2、ZnBr2、ZnI2中主要含共价键,属于分子晶体。分子的极性较小,能够溶于乙醇等弱极性溶剂。
【答案】离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主、极性较小
怎样才能走出思维定式呢?

