稳定表达TRPA1通道的HEK-293T细胞模型的建立
2019-03-13陈艳芬唐春萍张玉英杨超燕
黄 娟,明 露,陈艳芬,2,唐春萍,张玉英,杨超燕
(广东药科大学1.中药学院、2.广州市新药筛选模型体系构建与应用重点实验室、3.生命科学与生物制药学院,广东 广州 510006)
瞬时受体电位通道(transient receptor potential channel, TRP)是一类重要的阳离子通道[1]。瞬时感受器电位离子通道A1即TRPA1,又称为ANKTMI蛋白,是TRP的成员之一[2],存在于细胞膜或胞内细胞器膜上,其蛋白具有14氮-末端,锚定蛋白重复序列,锚蛋白序列的功能可能是与细胞内的骨架蛋白相互作用,以定位TRPA1在细胞膜的部分[3]。TRPA1主要分布在背根神经节、迷走神经节、三叉神经节等初级感觉神经元上,近年有文献报道,在一些非神经组织中可能也有表达[4-5]。TRPA1可以被伤害性冷刺激物激活,也能被一系列化学刺激激活,比如大蒜、芥子油、异硫氰酸盐类、丙烯醛等,其激活后,以Ca2+等阳离子进入胞内和胞内细胞器上相应通道开放后释放等形式,转导外界刺激信号[6-7]。目前研究表明,TRPA1通道在疼痛(包括神经源性疼痛、机械性疼痛、炎性痛、偏头痛、牙痛等多种疼痛)、冷觉、听觉等多种感觉生理功能上都有介导作用,成为当今学术研究的热点[8-9],因此,以TRPA1为治疗靶点,开发特异性调节剂有着广阔的应用前景[10-11]。但由于该通道主要表达在初级感觉神经元,难以获得高纯度和高活度的表达TRPA1通道的原位细胞。因此,本研究通过构建TRPA1重组真核表达载体,用脂质体转染的方法构建TRPA1离子通道HEK-293T细胞异源表达体系,为进一步阐明TRPA1信号通路和分子机制,以及筛选靶向TRPA1特异性调节剂奠定基础。
1 材料
1.1细胞、菌株及试剂人胚肾(HEK-293T)细胞株、大肠杆菌E.coliDH5α菌株,由本实验室保存;真核表达载体pcDNA3.1(-),购自Invitrogen;DMEM培养基,美国Hyclone公司产品;总RNA提取试剂TRIzol、GoScriptTMReverse Transcription 试剂盒、dNTP、Taq酶及buffer、DNA marker,均为Promega公司产品;pGEM-T Easy T4DNA连接酶、Taq聚合酶、EcoRV、NheI、XbaI及NotI(限制性内切酶)、胶回收试剂盒,均为美国MBI公司产品;LipofectamineTM2000试剂盒、G418,均为Invitrogen公司产品;质粒提取试剂盒,上海生工生物有限公司产品;兔多克隆抗体TRPA1(ab68847),Abcam公司产品;浓缩型SABC(链霉亲和素-生物素复合物)试剂盒、DAB显色试剂盒,均为武汉博士德产品;其他化学试剂为市售国产分析纯。
1.2仪器PCR仪(德国Whatman公司);电泳仪(北京市六一仪器厂);TOCAN领成全自动凝胶成像系统(上海领成生物技术有限公司);3-30 K低温高速离心机(美国Sigma公司);CO2恒温培养箱(美国SHELLAB公司)。
2 方法
2.1TRPA1基因的扩增及克隆先用RT-PCR扩增1.5 kb和1.9 kb的TRPA1基因片段。两个片段的PCR反应条件均为:cDNA 1 μL,Buffer 5 μL,dNTP(2 mmol·L-1)5 μL,Mg2+(25 mmol·L-1)3 μL,上、下游引物各1 μL(引物1:Forward primer:5′-GTGCTAGCATGAAGCGCAGCTTGAGGAGG GTTCT-3′,Reverse primer: 5′-AAATCTAGAAGAACTTTCATG CACTCGGG-3′;引物2:Forward primer:5′-GTTCTTCTAGATTT CTGCATGATACCT-3′, Reverse primer: 5′-TGCCTAGGCTAGA TCTGGGTGGCTAATAGAACAATGTGTT-3′),DOD-Plus Neo 1 μL,ddH2O 33 μL,共计50 μL。反应参数:98 ℃预变性3 min,97 ℃ 30 s,59 ℃ 30 s,72 ℃ 115 s,扩增36个循环,最后于72 ℃延伸10 min,4 ℃终止反应。将PCR产物经琼脂糖胶回收后,与pGEM-T Easy载体进行反应,然后将连接产物转化到大肠杆菌DH5α感受态细胞,用LB营养琼脂平板(含AMP 50 mg·L-1的抗生素)进行培养。将过夜培养好的细菌培养皿置于4 ℃冰箱中保存6~8 h,使蓝白斑变得更加清晰以便挑取阳性克隆。取经初步酶切检测后纯化的质粒DNA,送由上海生工公司采用双向测定法测序。
2.2TRPA1基因真核表达质粒的构建及鉴定测序确认后,用NheI和XbaI酶切消化1.9 kb质粒DNA(T-easy-1.9),XbaI和NotI酶切消化1.5 kb质粒DNA(T-easy-1.5),NheI和NotI酶切消化载体pcDNA3.1(-)DNA,分别胶中纯化回收所需要的目的片段。然后T4DNA连接酶16 ℃反应3 h,室温下静置1 h, 转化DH5α感受态大肠肝菌(步骤同“2.1”), 从含青霉素的LB平板上,挑选阳性克隆,d 2抽提质粒DNA,进行NotI单酶切和NheI+NotI进行双酶切反应鉴定。
2.3脂质体介导质粒转染HEK-293T细胞将HEK-293T细胞用含10% FBS的DMEM完全培养基置于37 ℃、5% CO2的恒温培养箱中培养,18~24 h待细胞贴壁后,更换新的培养基,继续培养。在倒置显微镜下观察,待细胞融合度达到80%~90%时,去除培养液,用2 mL的无菌PBS清洗2次,加入1 mL 0.25%的胰酶-EDTA消化,显微镜下观察细胞消化状态,如细胞缩小、变圆、细胞间的间隙变大后,快速加入2 mL的完全培养基终止消化,在离心机中以1 000 r·min-1离心4~5 min后,倒掉上清液,加入4~5 mL的完全培养基,置37 ℃、5% CO2的恒温培养箱中继续培养。
利用“2.2”方法提取目的基因真核重组质粒(pcDNA3.1-TRPA1)。将融合度90%~95%的HEK-293T细胞,以6×105每孔的细胞数接种于6孔板中,24 h后使用脂质体转染试剂 Lipofectamine 2000进行转染,将细胞置于37 ℃的CO2恒温培养箱中培养6 h后,更换为完全培养基继续培养。24 h后换液,加含浓度为150 mg·L-1G418的完全培养基进行筛选稳定的表达株,每2 d换液1次,挑选单个获得的细胞单克隆团,转移到6孔板继续培养。
2.4转染细胞TRPA1基因转录和蛋白表达的检测
2.4.1RT-PCR检测基因的转录 选取G418筛选出来的单克隆细胞株,用TRIzol试剂提取总RNA,同时提取非转染的HEK293-T细胞总RNA作为对照。根据TRPA1基因的序列设计引物,TRPA1上游引物: 5′-AACCGCATAGAGCTCCTCAA-3′,下游引物:5′-GAGGAATAAGGGCAACACGA-3′,进行反转录、PCR,最后PCR产物于1.5%的琼脂糖中进行电泳检测。
2.4.2免疫组化检测蛋白的表达 在灭菌的培养皿中铺上玻片,用于细胞爬片。在爬片上滴加细胞悬液,置于37 ℃、5% CO2培养箱中培养,使其贴壁。24 h后取出培养皿,PBS漂洗后,用4%多聚甲醛在室温下固定20 min,PBS漂洗,再加入0.25% Txiton,于37 ℃恒温箱孵育15 min,PBS漂洗;加入3% H2O2处理,室温15 min,PBS漂洗;加入血清封闭液,在37 ℃条件下处理30 min;甩干封闭液,加入一抗(1 ∶500稀释)4 ℃孵育过夜,阴性对照用PBS代替一抗;再加入二抗,37 ℃恒温培养箱中孵育40 min,PBS漂洗;滴加SABC适量,于37 ℃湿盒内孵育40 min,PBS漂洗;加DAB试剂进行显色处理,镜下掌握显色程度;最后复染,脱水,透明,封片。
3 结果
3.1TRPA1基因的RT-PCR扩增以前期提取的cDNA为模板,分别用特异性引物PCR扩增TRPA 1的基因片段。将PCR扩增产物进行1.5%琼脂糖凝胶电泳,分别获得大约1.9 kb和1.5 kb的目的基因片段(Fig 1),与预计结果相符。
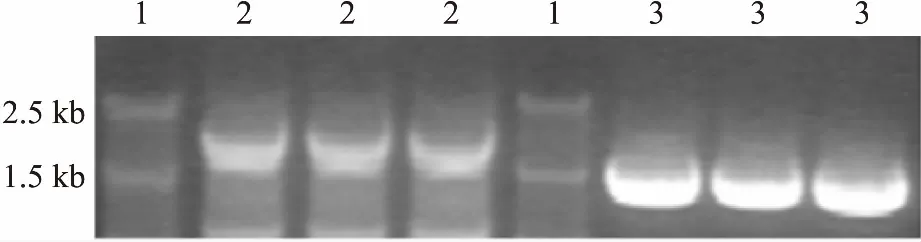
Fig 1 Detection of RT-PCR amplification products
1: DNA marker; 2: 1.9 kb PCR products; 3: 1.5 kb PCR products.
3.2T-easy-1.9和T-easy-1.5重组克隆质粒的酶切鉴定与测序将TRPA1基因片段分别克隆到T-easy克隆载体,从含青霉素的LB 平板上,挑取阳性克隆,T-easy-1.9重组克隆质粒计经Nhe Ⅰ和Xba Ⅰ双酶切鉴定,T-easy-1.5重组克隆质粒经Not Ⅰ和Xba Ⅰ双酶切鉴定,与预计结果相符,初步推测T-easy-1.9重组克隆质粒和T-easy-1.5重组克隆质粒克隆正确,基因片段已经克隆到T-easy载体。酶切检测后纯化的重组质粒DNA送由上海生工公司,采用双向测定法测序,与TRPA1基因库的序列一致。
3.3TRPA1真核重组表达质粒的酶切鉴定将胶回收纯化的目的基因片段与表达载体连接,转化DH5α感受态大肠杆菌,从含青霉素的LB平板上,挑选阳性克隆,抽提重组表达质粒pcDNA3.1-TRPA1,经NotI单酶切片段为8.4 kb,Nhe Ⅰ和Not Ⅰ双酶切片段大小为5 kb和3.4 kb(Fig 2),结果和预测一致。
3.4TRPA1基因转录和蛋白表达的RT-PCR及免疫组化检测结果将筛选得到的单克隆细胞株进行RT-PCR检测,结果表明转染TRPA1的HEK293-T细胞可检测到TRPA1基因的转录,而非转染的HEK293-T细胞则没有TRPA1基因的转录(Fig 3)。
细胞爬片固定后,进行免疫组化检测,以未转染TRPA1质粒的HEK-293T细胞作为阴性对照。Fig 4结果显示,没有转染TRPA1质粒的HEK-293T细胞胞质及膜上没有散在黄色物质,结果为阴性,而转染TRPA1质粒的HEK-293T细胞胞质及膜上有散在黄色物质,结果呈阳性表达,提示有TRPA1蛋白表达。
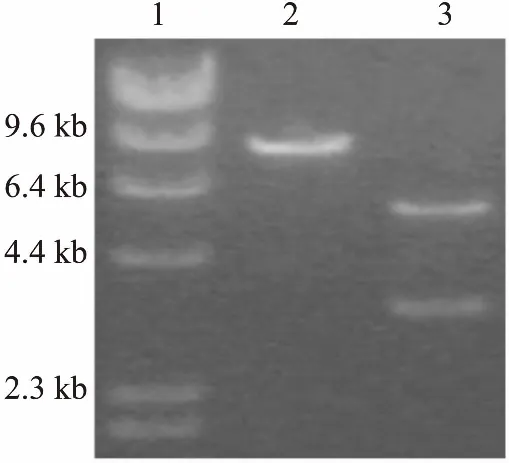
Fig 2 Restriction enzyme digestion of pcDNA3.1-TRPA1 recombinant expression plasmid
1: DNA marker; 2: NotI mono-enzyme digestion of pcDNA3.1-TRPA1; 3: Nhe Ⅰ and Not Ⅰ double-enzyme digestion of pcDNA3.1-TRPA1.
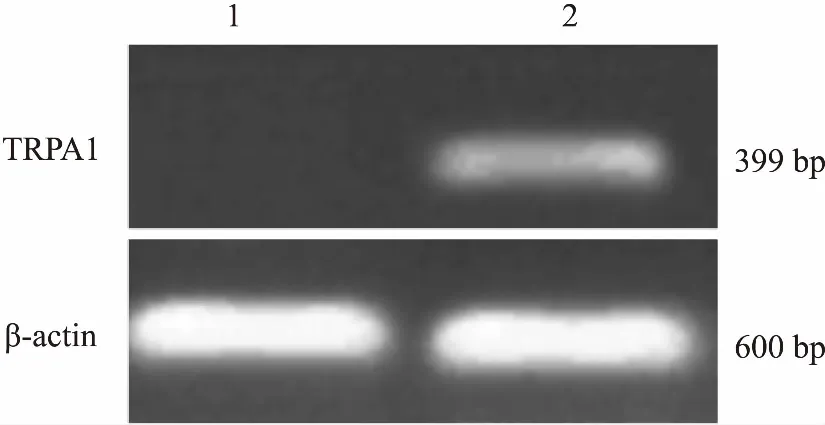
Fig 3 RT-PCR detection of TRPA1 transcription
1: Control of HEK-293T cells; 2: Stable expression of TRPA1 HEK-293T cells.
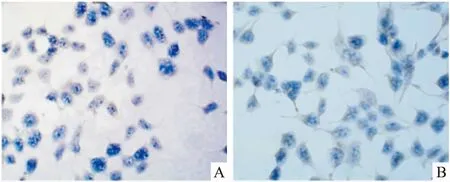
Fig 4 Expression of TRPA1 channel protein in HEK293T cells(×400)
A:Control of HEK-293T cells; B: Stable expression of TRPA1 HEK-293T cells.
4 讨论
2003年,Story等[2]首先报道了ANKTM1(TRPA1)是一种冷敏离子通道,接着Bautista等[12]用基因敲除法证明TRPA1在疼痛中的主导作用,自此TRPA1的激动剂与拮抗剂是医药领域近十年一直追逐的研究热点[13-14]。但是,由于TRPA1通道主要分布在三叉神经节、背根神经节等感觉神经元中,分离过程繁琐,原代培养条件比较苛刻,表达不够稳定,不太适合于广泛的药物筛选和作用机制研究,且国内的研究报道也比较缺乏。因此,本研究拟通过基因转染的方法,建立一个稳定表达TRPA1通道的细胞模型,为后续进一步探索TRPA1通道的功能研究奠定基础。
脂质体转染法是通过脂质双分子层所构成的囊状载体,包裹外源基因与细胞膜融合内吞而完成外源基因导入的一种生物学方法,此方法操作简单,且对细胞的毒性较低[15]。由于TRPA1基因片段较长,本研究分2个片段进行构建,选择合适的酶切位点,依次连接的构建策略。研究结果显示,使用T-easy克隆载体,含有氨苄青霉素抗性的编码基因和LacZ′编码基因,可根据氨苄抗性和α-互补原理,经蓝白筛选,挑出白色菌落,获得重组克隆载体。利用酶切和基因测序等方法对重组克隆载体进行鉴定,结果与预测一致。其次,重组表达载体的构建,本研究采用pcDNA3.1表达载体,含有巨细胞病毒强启动子(pCWV)序列,确保目的基因的高表达。最后,在模型鉴定方面,本研究将筛选得到的单克隆细胞株进行了RT-PCR和免疫组化检测,证实重组质粒转入HEK-293T细胞可稳定表达TRPA1基因,并且在后续的研究中利用该细胞模型进行了TRPA1的功能研究及药物筛选研究。
