银杏内酯B对外伤后神经细胞凋亡Omi/HtrA2信号通路影响的实验研究
2019-03-05陈方慧方金燕吴泽生陈子晞
陈方慧 王 弋 方金燕 吴泽生 陈子晞 谢 贇 肖 晨 赵 雪
银杏内酯B (ginkgolide B,GB) 是银杏叶的主要提取物,对血小板活化因子具有明显的拮抗作用,已用于治疗血栓形成、急性胰腺炎和心血管疾病等疾患[1]。GB可显著抑制神经细胞凋亡,但具体机制尚不明确[2]。Omi/HtrA2是一种由线粒体产生并可进入细胞质的丝氨酸蛋白酶。X染色体连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是内源性的caspases抑制物;而Omi/HtrA2通过降解XIAP来增强caspase活性从而参与线粒体凋亡途径发挥致凋亡作用[3~6]。线粒体Omi/HtrA2信号通路参与大鼠脓毒症性脑病、幼鼠癫痫持续状态和大鼠脑缺血/灌注损伤中的神经细胞凋亡过程[7~9]。但目前少有研究揭示该信号途径在颅脑损伤后神经细胞凋亡中的作用。本研究检测颅脑损伤大鼠海马组织细胞凋亡,观察Omi/HtrA2通路上XIAP、pro-caspase 3和pro-caspase 9等蛋白的表达及GB的干预作用,从而揭示大鼠颅脑损伤后Omi/HtrA2介导的神经细胞凋亡线粒体途径的激活及GB抗神经细胞凋亡的信号通路。
材料与方法
1.材料:健康Wistar大鼠(南京大学模式动物研究所,雄性,清洁级);GB(规格:10mg,批号:15291-77-7,上海诺辰生物技术有限公司);BCA蛋白定量试剂盒(批号:23256,美国Thermo Scientific公司);TUNEL试剂盒(批号:TUN11684817,北京嘉美纽诺生物科技有限公司);caspase-3和caspase-9底物(批号:T9281、T9275,美国Livemore公司);转印槽(型号:Trans-Blot,美国Biorad公司);电泳仪(型号:BG-caTANK,北京百晶生物技术有限公司);小型垂直电泳槽(型号:164-8001,美国Biorad公司);脱色摇床(型号:RCK 2D 200,上海达姆实业有限公司);生物倒置显微镜(型号:IX-71,中国奥林巴斯有限公司);低温高速离心机(型号:TD4,盐城凯特实验仪器设备有限公司);荧光分光光度仪(型号:B-500,上海元析仪器有限公司)。
2.方法:本实验设立假手术组、脑外伤组和治疗组,随机分配30只大鼠,每组10只。大鼠腹腔注射戊巴比妥钠(50mg/kg)麻醉后,取右侧冠状缝后1mm和中线旁开2mm为撞击位点,切开头皮后,钻直径5mm骨孔一枚,采用Feeney自由落体损伤装置,选择40g重击锤从25cm处自由坠落冲击撞杆,打击深度5mm,缝合头皮。脑外伤组和治疗组大鼠按上述标准制作大鼠颅脑损伤模型,假手术组大鼠切开头皮但未作自由落体打击。模型形成前0.5h,治疗组大鼠予以20mg/(kg·d) GB腹腔注射,其余两组大鼠腹腔注射1ml 0.9%氯化钠溶液,均连续用药3天。在第3天,取大鼠以80mg/kg戊巴比妥钠腹腔注射深度麻醉后断头处死,分离海马组织。假手术组、脑外伤组和治疗组3天内死亡大鼠依次是1、2和2只。大鼠死亡后补充成活大鼠,保证每组10只大鼠。3组大鼠病死率比较,差异无统计学意义(χ2=0.516,P=0.773)。
3.细胞凋亡检测: 采用石蜡包埋大鼠海马组织,切取厚约4μm切片,按照说明书采用TUNEL法检测海马组织神经细胞凋亡。凋亡神经细胞为细胞核呈现棕黄色或棕红色。在光学显微镜下计算10个高倍镜视野,每个视野计数100个细胞,总计1000个细胞,计算平均阳性率(%)。
4.蛋白表达的检测:采用BCA法测定大鼠海马组织蛋白浓度,采用Western blot法检测大鼠海马组织Omi/HtrA2、XIAP、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表达,结果用quality one软件分析杂交条带灰度值,以β-actin水平为内对照,比较相对灰度值。
5.蛋白活性的检测:采用四肽荧光底物法检测海马组织caspase-3和caspase-9蛋白活性。采用荧光分光光度计,取激发波长400nm和释放波长505nm处测定荧光强度。以未加脑组织时的荧光强度为参照值,计算荧光强度,最终比较相对荧光强度。

结 果
1.GB对大鼠海马神经元凋亡的影响:由图1和图2可见,3组大鼠凋亡的海马神经元比例比较,差异有统计学意义(F=157.806,P<0.01)。脑外伤组大鼠凋亡的海马神经元比例较假手术组显著升高(P<0.01),而治疗组大鼠凋亡的海马神经元比例较脑外伤组显著下降(P<0.01)。
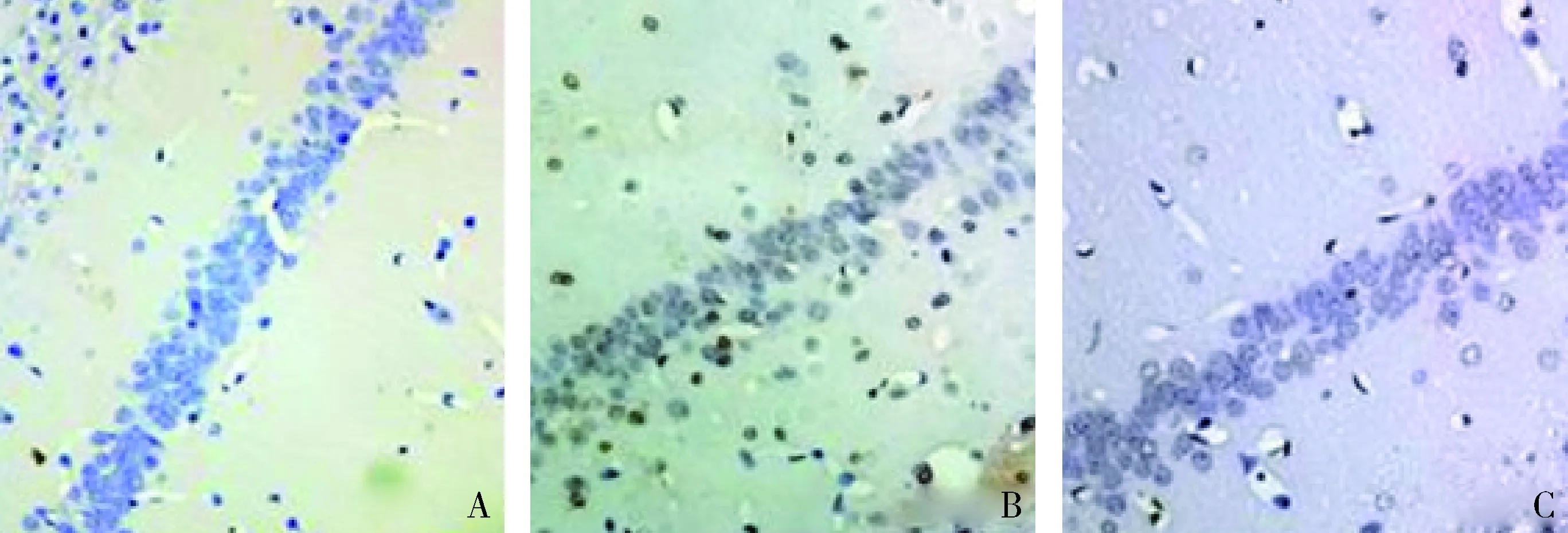
图1 GB对大鼠海马神经元凋亡的影响 (TUNEL,×100)A.假手术组;B.脑外伤组;C.治疗组
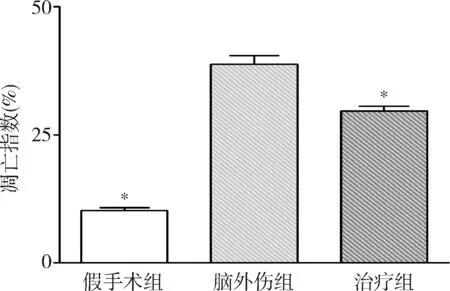
图2 GB对大鼠海马凋亡神经元比例的影响与脑外伤组比较,*P<0.01
2.GB对大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9、剪切PARP 和XIAP蛋白表达的影响:由图3~图8可见,3组大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9、剪切PARP 和XIAP蛋白表达比较,差异有统计学意义(F=85.538、104.546、89.650、63.168和53.096,P均<0.01)。脑外伤组大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表达均较假手术组显著升高(P<0.01),脑外伤组大鼠海马组织XIAP蛋白表达较假手术组显著下降(P<0.01);治疗组大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表达均较脑外伤组显著下降(P均<0.01),治疗组大鼠海马组织XIAP蛋白表达较脑外伤组显著升高(P<0.01)。
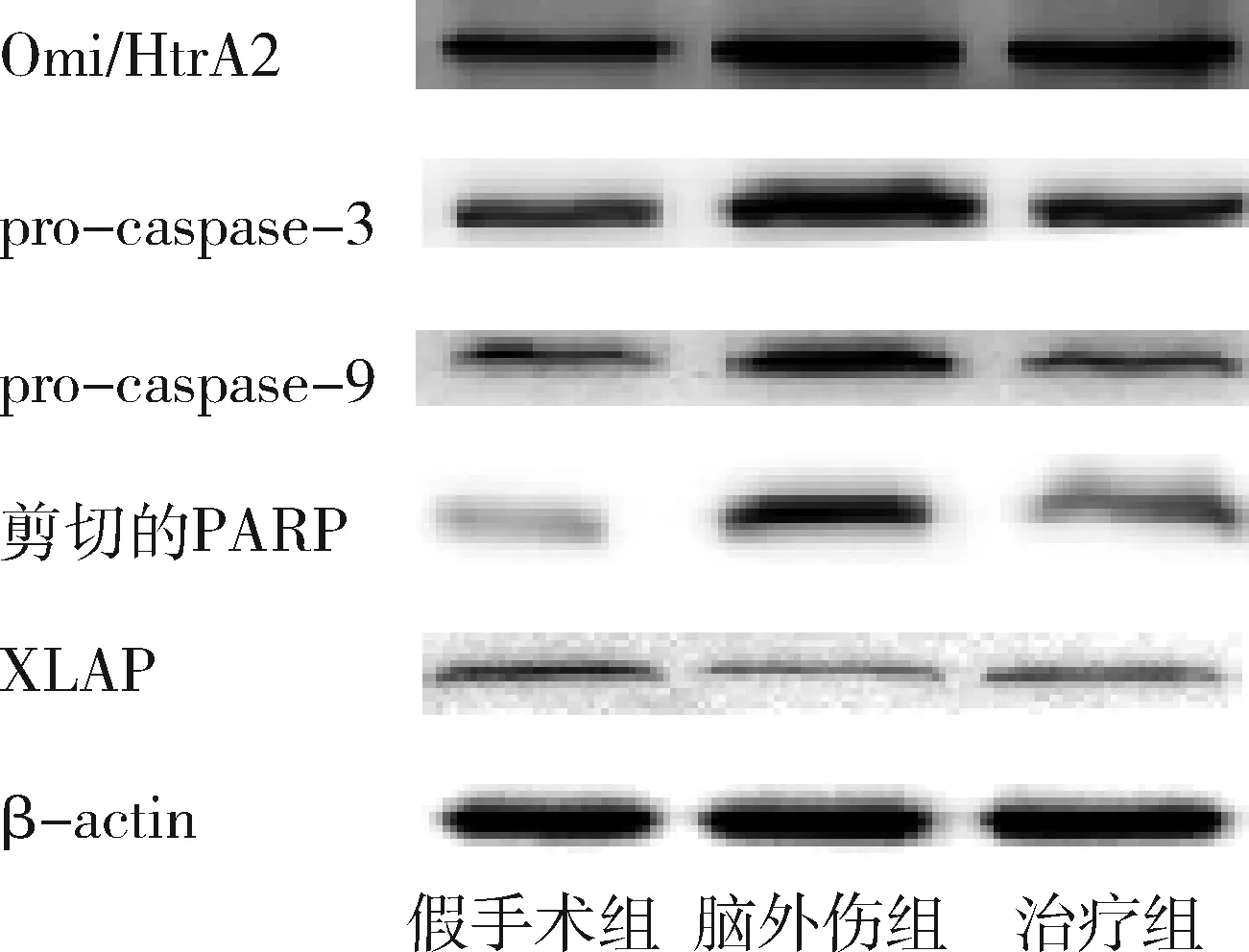
图3 GB对大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9、剪切PARP 和XIAP蛋白表达的影响
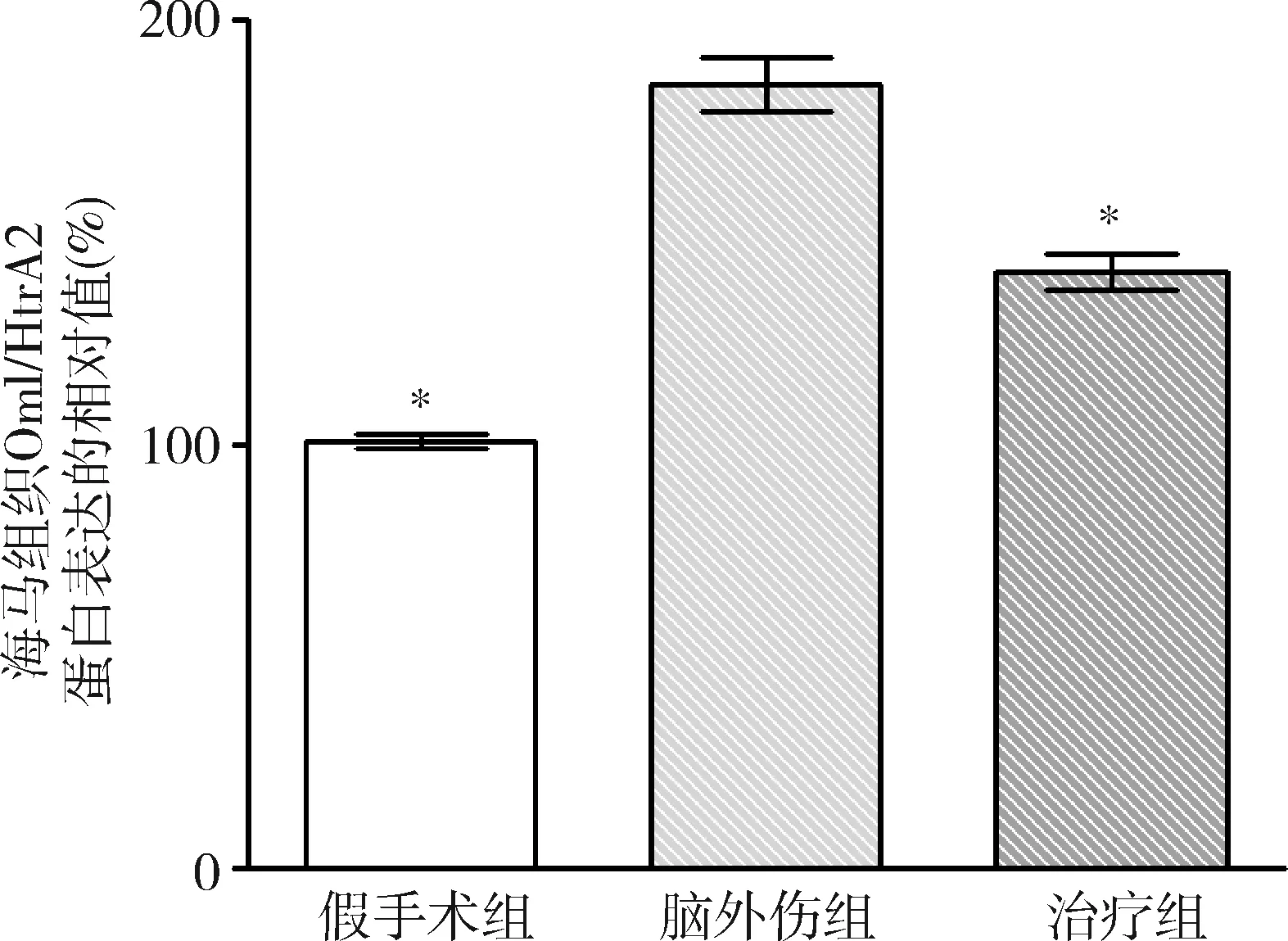
图4 GB对大鼠海马组织Omi/HtrA2蛋白表达相对值的影响与脑外伤组比较,*P<0.01
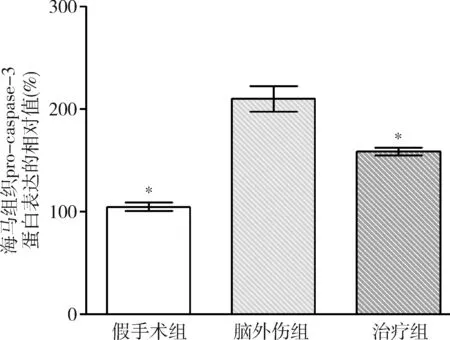
图5 GB对大鼠海马组织pro-caspase-3蛋白表达相对值的影响与脑外伤组比较,*P<0.01
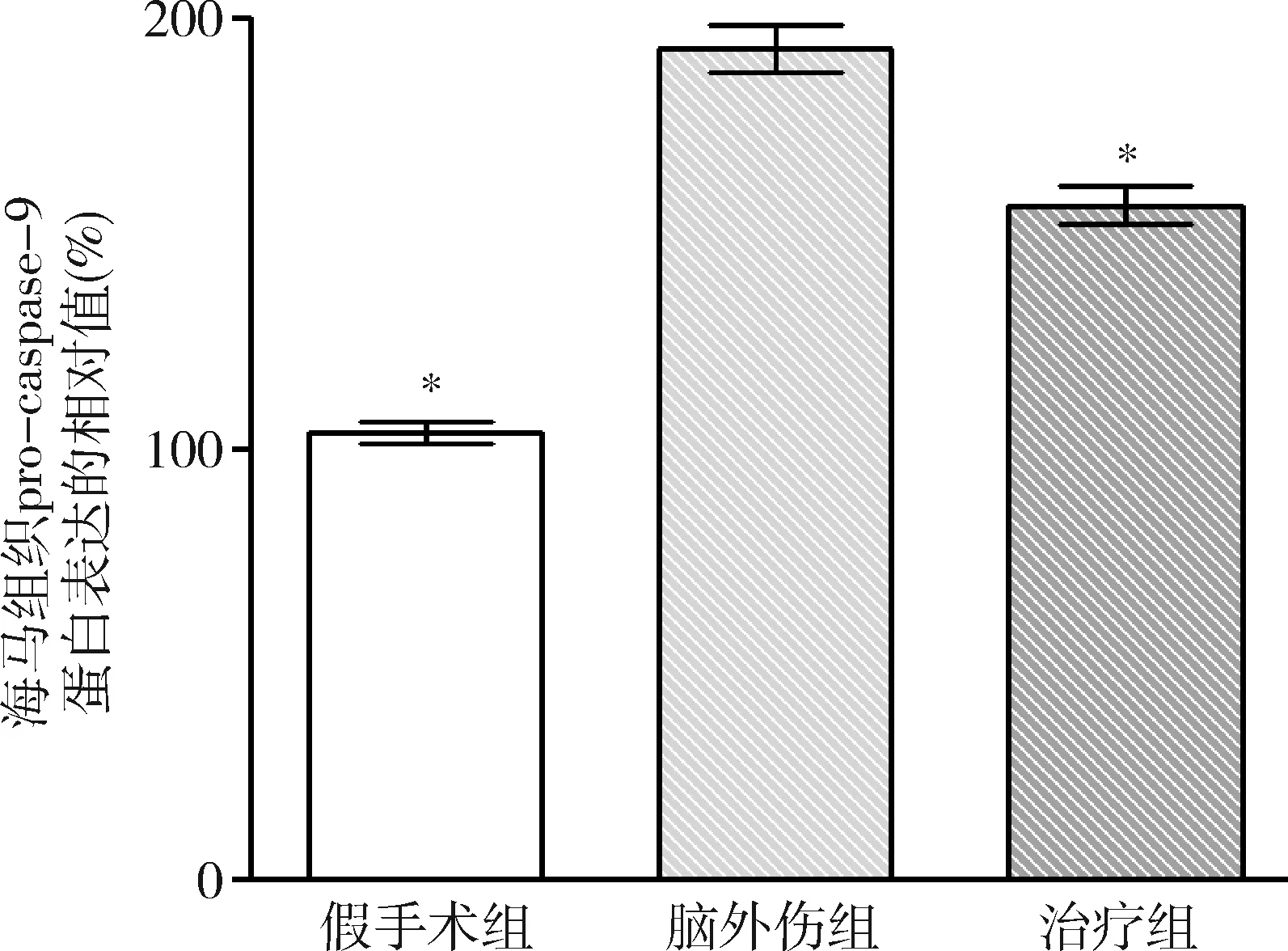
图6 GB对大鼠海马组织pro-caspase-9蛋白表达相对值的影响与脑外伤组比较,*P<0.01
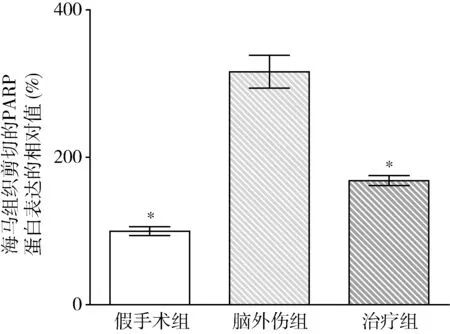
图7 GB对大鼠海马组织剪切的PARP蛋白表达相对值的影响与脑外伤组比较,*P<0.01
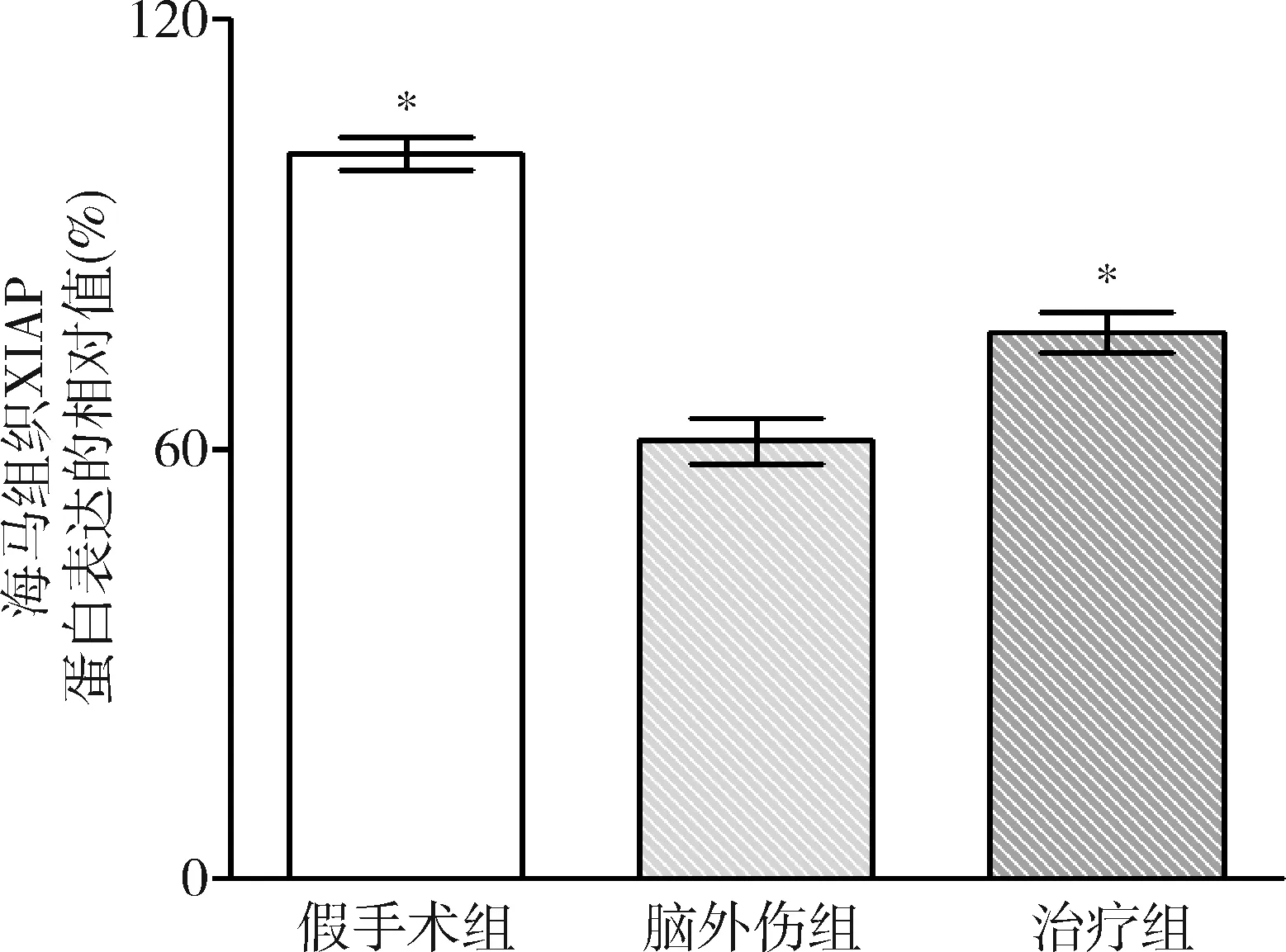
图8 GB对大鼠海马组织剪切的XIAP蛋白表达相对值的影响与脑外伤组比较,*P<0.01
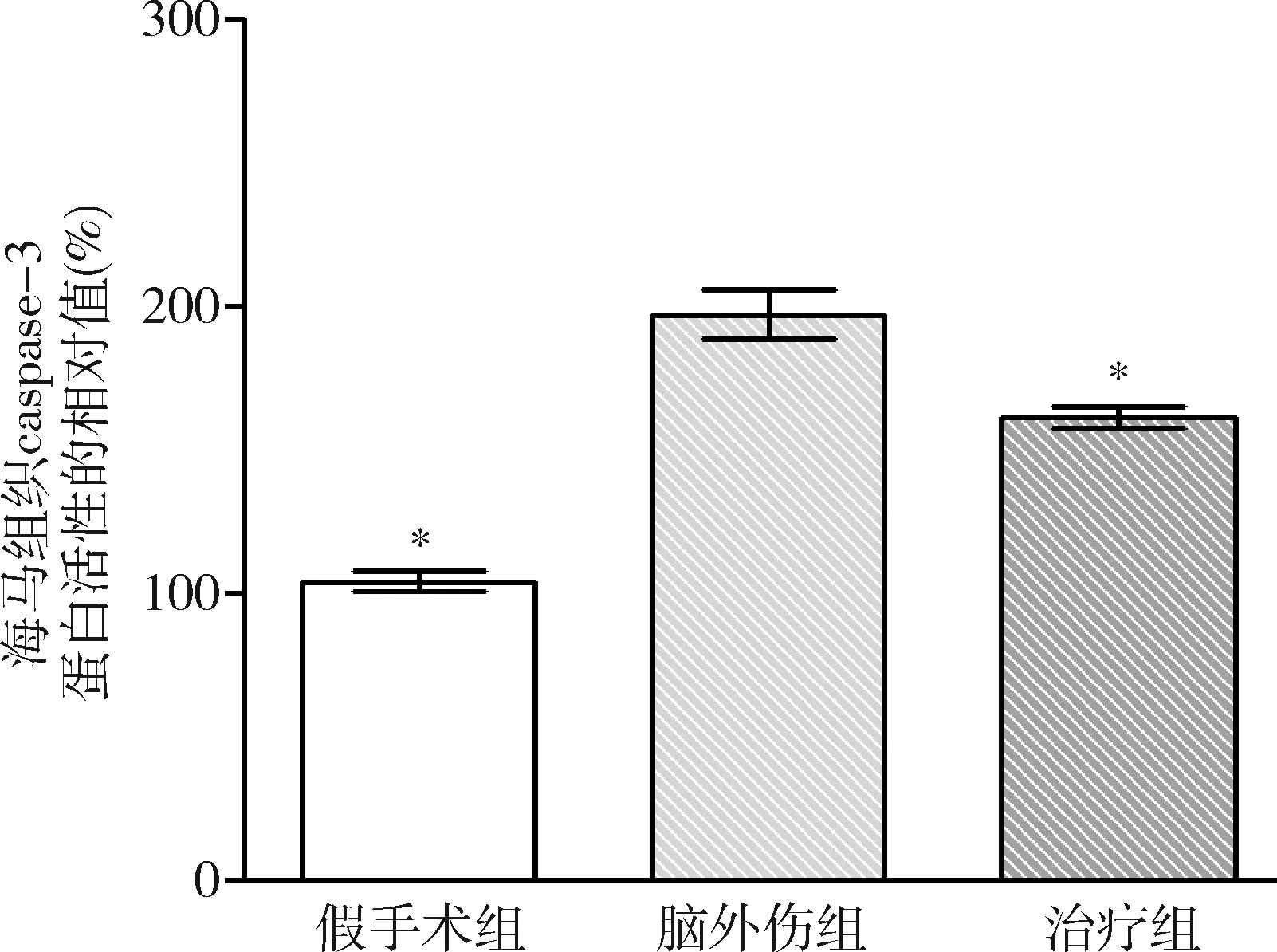
图9 GB对大鼠海马组织caspase-3蛋白活性相对值的影响与脑外伤组比较,*P<0.01
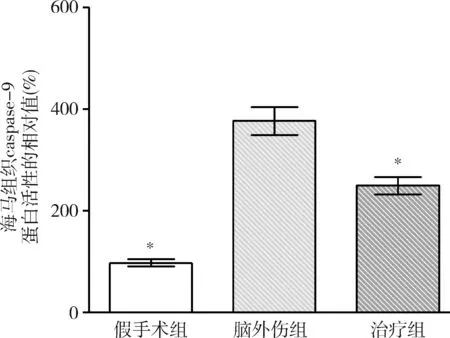
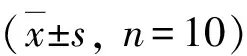
图10 GB对大鼠海马组织caspase-9蛋白活性相对值的影响与脑外伤组比较,*P<0.01
3.GB对大鼠海马组织caspase-3和caspase-9蛋白活性的影响:由图9和图10可见,3组大鼠海马组织caspase-3和caspase-9蛋白活性比较,差异有统计学意义(F=62.716和53.067,P均<0.01)。脑外伤组大鼠海马组织caspase-3和caspase-9蛋白活性均较假手术组显著升高(P均<0.01),治疗组大鼠海马组织caspase-3和caspase-9蛋白活性均较脑外伤组显著下降(P均<0.01)。
讨 论
颅脑损伤是一种严重的外伤形式,发生率居四肢创伤之后,但病死率和致残率居所有外伤之首。颅脑损伤后继发性脑损伤的病理生理机制相当复杂,涉及炎性反应、自由基反应、氨基酸毒性作用和细胞凋亡等[10~13]。哺乳细胞涉及外在途径、内在途径(即线粒体途径)和内质网途径在内的3种基本的细胞凋亡途径。线粒体凋亡是细胞凋亡的主要途径之一,是一种由凋亡基因调控的高度保守的死亡过程。炎性介质、缺血、缺氧及外伤等外在或内在的凋亡信号作用于线粒体,通过改变线粒体膜的通透性,导致线粒体内相关物质释放入胞质,从而介导线粒体乃至细胞的凋亡,因此线粒体可能在细胞凋亡中起到主开关的作用[14~16]。研究证实,线粒体途径参与颅脑损伤后神经细胞凋亡的过程[17~19]。然而,线粒体途径也涉及复杂的信号传递通路,剖析这些信号通路对进一步揭示外伤性脑损伤的病理生理机制具有重要意义,也为继发性脑损伤的药物治疗提供新思路。
Omi/HtrA2是一种在内质网合成,由MTS/MLS引导转运进入线粒体的丝氨酸蛋白酶。Omi/HtrA2在线粒体内可通过自身蛋白酶解或被加工肽酶降解形成成熟Omi分子,并储存在线粒体膜间隙中。线粒体膜在细胞受到刺激发生应激反应时通透性增加,Omi/HtrA2分子则从线粒体释放并进入细胞质[3~6]。XIAP是内源性caspases抑制物,可结合和抑制活化的caspase-9。Omi/HtrA2分子在细胞受到刺激后被释放到细胞质,从而降解XIAP,解除XIAP对caspase-9的抑制,导致下游caspase-3活化,从而DNA断裂发生凋亡,即Omi/HtrA2通过增强caspase活性参与线粒体凋亡途径发挥致凋亡作用[3~6]。线粒体Omi/HtrA2信号通路参与了脓毒症性脑病、癫痫持续状态幼鼠和脑缺血/灌注损伤大鼠神经细胞的凋亡过程[7~9]。本研究发现,颅脑损伤大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表达及caspase-3和caspase-9蛋白活性出现明显的升高,而XIAP蛋白表达出现了下调。因此,线粒体Omi/HtrA2信号通路可能参与了颅脑损伤后神经细胞凋亡。
银杏是地球上最古老的植物之一,具有独特的药理作用和治疗价值。GB为银杏叶提取物中主要的药效成分之一,为二萜类酸化合物[1]。GB能通过降低Bax和caspase-3表达,增加Bcl-2表达,抑制高糖诱导的内皮细胞凋亡[20]。GB可通过抑制核因子-κB/Toll样受体4途径影响神经炎性反应,从而降低脑出血或脑外伤大鼠的神经细胞凋亡[21,22]。目前,GB是否通过抑制细胞凋亡线粒体途径而降低神经细胞凋亡还不得而知。本研究发现,使用GB腹腔注射后,颅脑损伤大鼠海马组织Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表达及caspase-3和caspase-9蛋白活性出现明显的下降,而XIAP蛋白表达出现了上升。因此,可以推测,抑制线粒体Omi/HtrA2信号通路可能是GB抗神经细胞凋亡的机制之一。
