新疆芜菁果胶多糖组成分析及免疫活性评价
2019-02-18
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
新疆芜菁(BrassicarapaL.),属于十字花科(Cruciferae)芸苔属(Brassica)草本植物,主产于中国新疆天山西南、塔里木西北地区,在新疆南部种植非常广泛,是具有较长食用历史的药食同源植物[1]。《本草纲目》中记载芜菁“辛、苦、平,无毒,可升可降,能汗能吐,能下能利小便,又能明目解毒,其效甚伟”[2]。药理学分析表明,芜菁中含有黄酮、生育酚、多糖、皂苷等多种植物化学物质[3]。
植物多糖是由醛糖或酮糖组成的生物大分子,分为中性多糖和酸性多糖。果胶多糖是一种酸性多糖,可以分为聚半乳糖醛酸(HG)I型、聚鼠李半乳糖醛酸(RG-I)II型、聚鼠李半乳糖醛酸(RG-II)、木聚半乳糖醛酸(XGA)和芹糖聚半乳糖醛酸(AGA)[4],具有免疫调节[5]、抗肿瘤[6]、降胆固醇和血糖[7]等生物活性。新疆芜菁多糖也越来越受到关注,张谦筱等[8]采用水提醇沉法提取新疆芜菁粗多糖,并用Savege法除蛋白,活性炭脱色精制多糖;孙莲等[1]采用水提醇沉法提取新疆芜菁多糖,衍生化后采用RP-HPLC分离检测,结果表明新疆芜菁多糖由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖等6种单糖组成,单糖的摩尔比为1.0∶2.5∶5.4∶2.4∶3.4∶3.7;艾克拜尔江·阿巴斯等[9]研究发现新疆芜菁多糖对小鼠具有显著的降血糖作用;Wang等[10]研究发现,新疆芜菁多糖对DPPH自由基、羟基自由基具有明显的清除能力,清除能力与新疆芜菁多糖含量具有一定的相关性。然而,目前有关新疆芜菁果胶多糖组成分析、免疫调节活性的研究尚未见报道。
因此,本文从新疆芜菁中分离纯化得到果胶多糖纯品,采用HPGPC、傅立叶红外光谱、PMP衍生化分析等技术对新疆芜菁果胶多糖的组成进行分析,同时应用小鼠巨噬细胞RAW264.7模型对其免疫活性进行评价,以期为新疆芜菁果胶多糖在食品和医药领域的应用与开发提供理论依据和实践指导。
1 材料与方法
1.1 材料与仪器
新疆芜菁 新疆乌鲁木齐市北园春农贸市场;小鼠巨噬细胞RAW264.7 南京中医药大学;甲氮甲唑蓝(MTT)、单糖标品(鼠李糖、阿拉伯糖、核糖、甘露糖、葡萄糖、半乳糖、葡萄糖醛酸、半乳糖醛酸及岩藻糖,纯度>99%)、不同分子量普鲁兰多糖标品(5.9、11.8、22.8、112、212、404及788 kDa) Sigma公司;DMEM培养基、双抗(青霉素及链霉素)、胎牛血清(FBS)、0.25%胰蛋白酶消化液 Gibco公司;细胞因子(TNF-α、IL-1β和IFN-γ)ELISA测定试剂盒、一氧化氮(NO)检测试剂盒 南京建成生物工程研究所;乙醚、乙醇、丙酮、三氟乙酸等试剂 均为国产分析纯。
101A-1型自动恒温干燥箱 上海实验仪器有限公司;H1850R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;RE-2000A旋转蒸发器 上海羌强仪器设备有限公司;UV-2450紫外分光光度计 尤尼克有限公司;HH-4数显恒温水浴锅 金坛市杰瑞尔电器有限公司;KQ5200E超声波清洗器 昆山市超声仪器有限公司;BSZ-16OF自动部份收集器 上海精科实业有限公司;VERTEX33傅里叶变换红外光谱仪 Brucker公司;6890N高效液相色谱仪 美国Agilent公司;Synergy-2酶标仪 美国Biotek公司;SERIES 3111细胞培养箱 美国Thermo Scientific公司。
1.2 实验方法
1.2.1 新疆芜菁果胶多糖的提取及分离纯化 提取:参照宋思圆等[11]的方法,将干燥的新疆芜菁粉碎后过60目筛,加入80%的乙醇浸提24 h,重复2次,以去除其中的单糖、低聚糖、色素等杂质,料渣于25 ℃干燥备用。料渣采用液料比75 mL/g、提取温度93 ℃、提取时间4.3 h及提取次数3次进行热水浸提,浸提液抽滤取上清,50 ℃旋蒸浓缩至1/8原体积,加入3倍体积无水乙醇后置于4 ℃冰箱过夜,3000 r/min 离心10 min取沉淀,25 ℃干燥,得到即为粗多糖。
纯化:参照Wang等[10]的方法,称取100 mg粗多糖溶解于10 mL蒸馏水,上样至DEAE-Sepharose Fast Flow(2.6 cm×60 cm)纤维素阴离子交换层析柱中,以0.3 mol/L的NaCl溶液洗脱,流速1.0 mL/min,每管收集10 mL,苯酚-硫酸法[12]测定各管多糖含量,将洗脱液浓缩、透析、冻干得到初步纯化的新疆芜菁果胶多糖样品;称取150 mg初步纯化样品,溶于3 mL蒸馏水,上样至Sephacryl S-200 HR凝胶柱(1.6 cm×100 cm)中,蒸馏水洗脱,流速0.2 mL/min,每管5 mL,苯酚-硫酸法[12]测定各管多糖含量,收集洗脱液,浓缩、透析、冻干,即为新疆芜菁果胶多糖纯品。
1.2.2 新疆芜菁果胶多糖分子量测定
1.2.2.1 样品处理 纯化后的多糖样品及不同分子量的普鲁兰标准品用去离子水配成2 mg/mL的溶液,过滤后采用高效液相凝胶透析色谱法(HPGPC)进行检测。
1.2.2.2 色谱条件 参照Ye等[13]的方法。高效液相色谱连接示差检测器(RID)及TSK G4000 PWXL色谱柱;流动相:超纯水;流速:0.80 mL/min;进样量:20 μL;柱温:30 ℃。用5.9、11.8、22.8、112、212、404及788 kDa的普鲁兰多糖标品制备标准曲线,计算得新疆芜菁果胶多糖的分子量。
1.2.3 新疆芜菁果胶多糖理化性质分析 参照Dubois等[12]的方法,采用苯酚-硫酸法测定新疆芜菁果胶多糖的总糖含量;参照Blumenkrantz等[14]的方法,采用间羟联苯法测定新疆芜菁果胶多糖的糖醛酸含量;参照Bradford等[15]的方法,采用考马斯亮蓝法测定新疆芜菁果胶多糖的蛋白含量;参照Kawai等[16]的方法,采用氯化钡-明胶比色法测定新疆芜菁果胶多糖的硫酸基含量;参照Li等[17]的方法,采用福林酚比色法测定新疆芜菁果胶多糖的总酚含量。
1.2.4 新疆芜菁果胶多糖红外光谱分析 参照Saleem等[18]的方法,称取少量的纯化多糖样品(1~5 mg),与适量干燥的KBr粉末(1∶100)混合,研磨均匀后压片,置于傅立叶红外光谱仪上在4000~500 cm-1波长范围内进行红外扫描,对采集到红外吸收图谱进行分析。
1.2.5 新疆芜菁果胶多糖的单糖组成定量分析
1.2.5.1 样品水解 参照连紫宛等[19]的方法。称取5 mg纯化多糖样品于安瓿瓶中,加入2 mol/L的三氟乙酸(TFA)4 mL,将安瓿瓶封口后置于120 ℃下反应2 h,冷却至室温,减压旋干后,加入1 mL甲醇混合,继续蒸干,重复2~3次。
1.2.5.2 水解样品的PMP衍生化 参照连紫宛等[19]的方法。将100 μL酸水解溶液与0.6 mol/L的NaOH溶液等体积混合,加入0.5 mol/L的PMP甲醇溶液200 μL,混匀,置于70 ℃的干式恒温器中反应100 min,冷却至室温,再加入0.3 mol/L的HCl溶液100 μL;混合溶液在50 ℃条件下减压旋干,加入1 mL去离子水重新溶解,另加1 mL氯仿进行萃取,吸取水相,过0.45 μm水系滤膜后HPLC检测。所有的单糖标品(鼠李糖、阿拉伯糖、核糖、甘露糖、葡萄糖、半乳糖、葡萄糖醛酸、半乳糖醛酸及岩藻糖)和混合单糖标品(将上述所有单糖标品按1∶1混合并配制成不同浓度0.5、1、2、3及4 mg/mL)也按照上述步骤进行衍生化。
1.2.5.3 色谱条件 高效液相色谱连接二级管阵列检测器(DAD)及RP-C18色谱柱;柱温:30 ℃;流动相:0.1 mol/L的PBS缓冲液(pH6.7)和乙腈按83∶17 (v/v)混匀;流速:l.0 mL/min;检测波长:245 nm。
1.2.6 新疆芜菁果胶多糖的免疫调节活性研究 将处于对数生长期的小鼠巨噬细胞RAW264.7用胰蛋白酶消化后,配成浓度为(5~10)×105个/mL的细胞悬液,接种于96孔细胞培养板(100 μL/孔),置于CO2培养箱培养使细胞重新贴壁。24 h后,吸弃培养基,加入100 μL不同浓度(12.5、25、50、100、200 μg/mL)的新疆芜菁果胶多糖溶液,阳性对照组加入10 μg/mL的脂多糖100 μL(LPS),空白组加入100 μL的DMEM培养基,每组设3个平行孔。采用MTT法[20]检测新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7增殖活性及吞噬能力的影响;采用NO检测试剂盒和酶联免疫试剂盒(ELISA)对小鼠巨噬细胞RAW264.7的NO及不同细胞因子(TNF-α、IL-1β、IFN-γ)释放量进行测定。
1.3 数据处理
所有数据均以平均值±标准差(Mean±SD)表示,绘图采用Origin 8.5软件,显著性分析采用SPSS 20.0统计软件单因素方差分析(One-way ANOVA)中的Tukey检验。
2 结果与分析
2.1 新疆芜菁果胶多糖分子量测定
采用HPGPC法对新疆芜菁果胶多糖分子量进行检测,结果如图1所示。
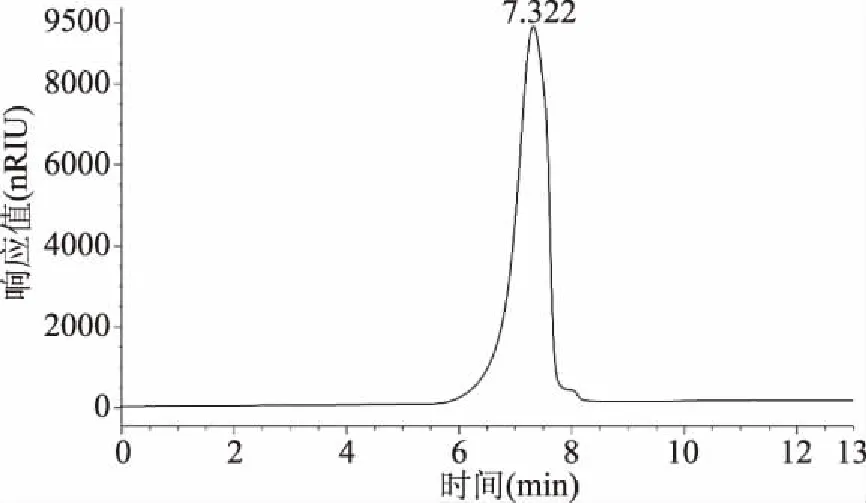
图1 新疆芜菁果胶多糖的HPGPC图谱Fig.1 HPGPC profile of BRP
由图1可知,新疆芜菁果胶多糖出现了单一对称的色谱峰,表明其具有较高的纯度;普鲁兰多糖标准品的线性回归方程为lg Mw=-0.4182t+8.9855,相关系数R2=0.9936,根据新疆芜菁果胶多糖的出峰时间计算得出其平均分子量为838 kDa。
2.2 新疆芜菁果胶多糖理化性质分析
通过理化分析,结果表明新疆芜菁果胶多糖的总糖含量为78.86%±1.01%、糖醛酸的含量为15.82%±1.05%、硫酸基的含量为0.14%±0.05%,但不含有蛋白质和总酚。
2.3 新疆芜菁果胶多糖的红外光谱分析
采用傅立叶红外光谱分析仪对新疆芜菁果胶多糖进行扫描,主要的吸收峰波数位置如图2所示。
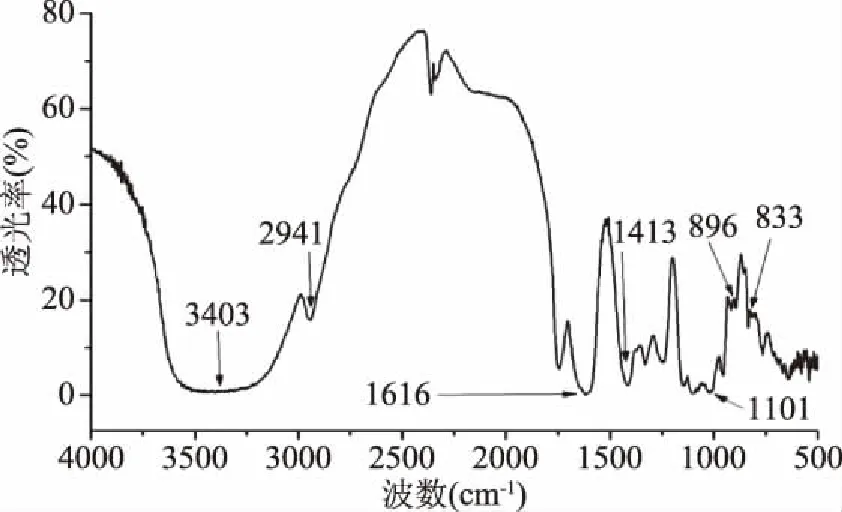
图2 新疆芜菁果胶多糖的红外光谱图Fig.2 FT-IR spectras of BRP
红外光谱法是用来研究不同原子之间和极性键间的振动,是糖类物质结构研究的一个重要手段。如图2,新疆芜菁果胶多糖在3403 cm-1处出现峰型较宽的吸收峰,是由于糖链中非游离O-H伸缩振动引起的;2941 cm-1处的吸收峰是由于C-H非对称伸缩振动引起的;1616 cm-1处的吸收峰是由于结合水的存在与COO-的非对称伸缩振动共同引起;1413 cm-1处的吸收峰是由于O-H变角振动和C-O的伸缩振动引起的[21];1101 cm-1是由于糖链中吡喃环的伸缩振动引起的[22];每种多糖在915~810 cm-1范围内都有特征吸收峰,而896及833 cm-1处的吸收峰表明新疆芜菁果胶多糖同时含有α-构型糖苷键及β-构型糖苷键[23]。由此可初步证明此样品为多糖结构,特征峰明显,无其他结构特征峰,应为多糖纯品。
2.4 新疆芜菁果胶多糖的单糖组成定量分析
采用PMP衍生化法对新疆芜菁果胶多糖的单糖组成进行分析,混合标准单糖PMP衍生色谱图如图3所示,果胶多糖PMP衍生化色谱图如图4所示。

图3 混合标准单糖的PMP衍生化色谱图Fig.3 Chromatogram of PMP derivatives of mixed monosaccharide standards
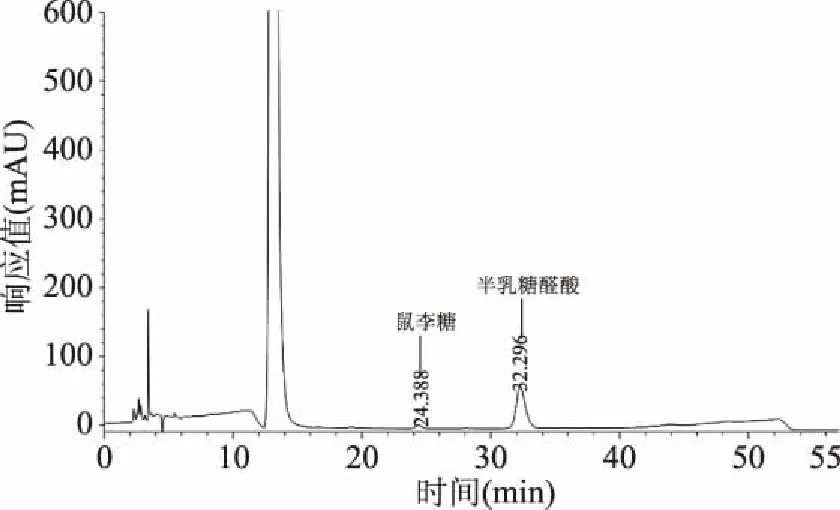
图4 新疆芜菁果胶多糖的PMP衍生化色谱图Fig.4 Chromatogram of PMP derivatives of BRP

图5 新疆芜菁果胶多糖对小鼠巨噬细胞 RAW264.7增殖活性的影响Fig.5 Effect of BRP on proliferation activity of RAW264.7 cell注:不同小写字母代表差异显著(P<0.05),图5~图10同。
由图4可知,根据样品在色谱图中出峰时间及峰面积,新疆芜菁果胶多糖由鼠李糖与半乳糖醛酸两种单糖组成,且主要为半乳糖醛酸,其对应的摩尔比为1.94∶98.06。该结果不同于Xie等[24]的研究发现,从西藏芜菁中纯化得到的多糖组分都不含有半乳糖醛酸。
2.5 新疆芜菁果胶多糖的免疫调节活性研究
2.5.1 新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7增殖活性的影响 巨噬细胞的增殖活性一般被认为是多糖免疫调节活性的标志[25]。新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7增殖活性的影响如图5所示。
采用MTT法检测细胞增殖活性时,用增殖指数表示样品对小鼠巨噬细胞RAW264.7增殖活性的影响。当细胞增殖指数大于1时,表示细胞增殖;当细胞增殖指数小于1时,表示细胞生长受到抑制。如图5所示,与空白组相比,当样品浓度在12.5~100 μg/mL时,不同浓度的新疆芜菁果胶多糖均可以显著提高(P<0.05)小鼠巨噬细胞RAW264.7的增殖活性,多糖浓度为100 μg/mL时,增殖指数达到1.57,呈现明显的剂量效应。但当多糖浓度为200 μg/mL时,差异不显著(与空白组相比,P>0.05)。以上结果表明新疆芜菁果胶多糖具有免疫调节活性。
2.5.2 新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7吞噬能力的影响 激活巨噬细胞最显著的特征是增加其吞噬能力[26],从而起到保护机体和清除异物的功效。新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7吞噬能力的影响如图6所示。
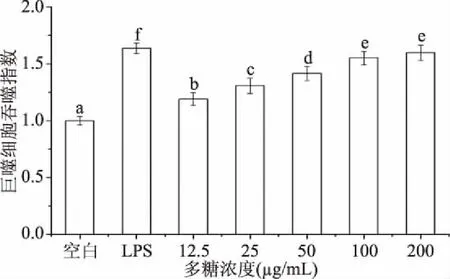
图6 新疆芜菁果胶多糖对小鼠巨噬细胞 RAW264.7吞噬能力的影响Fig.6 Effect of BRP on phagocytosis of RAW264.7 cell
采用MTT法检测细胞吞噬能力时,用吞噬指数表示样品对小鼠巨噬细胞RAW264.7吞噬能力的影响。当细胞吞噬指数大于1时,表示细胞吞噬能力增强;当细胞吞噬指数小于1时,表示细胞吞噬能力被抑制。如图6所示,与空白组相比,当样品浓度在12.5~100 μg/mL时,不同浓度的新疆芜菁果胶多糖均可以显著提高(P<0.05)小鼠巨噬细胞RAW264.7的吞噬能力,多糖浓度为100 μg/mL时,吞噬指数达到1.55,呈现明显的剂量效应。但当多糖浓度为200 μg/mL时,差异不显著(与空白组相比,P>0.05)。以上结果表明新疆芜菁果胶多糖具有免疫调节活性。
2.5.3 新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的NO释放量影响 NO是具有高活性自由基性质的效应分子,在宿主免疫应答及机体防御中起着非常关键的作用[27]。新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的NO释放量影响如图7所示。
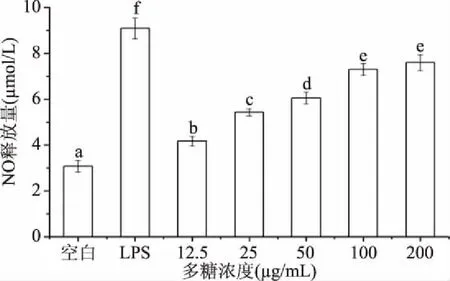
图7 新疆芜菁果胶多糖对小鼠巨噬细胞 RAW264.7的NO释放量影响Fig.7 Effect of BRP on production of NO of RAW264.7 cell
由图7可知,与空白组相比,当新疆芜菁果胶多糖浓度在12.5~100 μg/mL时,均可以显著促进(P<0.05)小鼠巨噬细胞RAW264.7的NO释放量,多糖浓度为100 μg/mL时,NO的释放量达到7.29 μmol/L,呈现明显的剂量效应,但仍然显著低于(P<0.05)10 μg/mL的LPS阳性对照组(9.09 μmol/L)。
2.5.4 新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的TNF-α释放量影响 TNF-α主要源自激活的巨噬细胞和T淋巴细胞所释放的重要细胞因子,具有抵御致病因子及参与免疫应答等生物效应[28]。新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的TNF-α释放量影响如图8所示。

图8 新疆芜菁果胶多糖对小鼠巨噬细胞 RAW264.7的TNF-α分泌量影响Fig.8 Effect of BRP on production of TNF-α of RAW264.7 cell
由图8可知,与空白组相比,当多糖浓度在12.5~200 μg/mL时,新疆芜菁果胶多糖均可以显著提高(P<0.05)小鼠巨噬细胞RAW264.7的TNF-α释放量,呈现明显的剂量效应;当其浓度为200 μg/mL时,TNF-α的释放量达到最大,释放量为35.15 ng/L,表明新疆芜菁果胶多糖具有免疫调节活性。
2.5.5 新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的IL-1β释放量影响 IL-1β对激活与调节免疫细胞发挥着重要的作用[29]。新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的IL-1β释放量影响如图9所示。
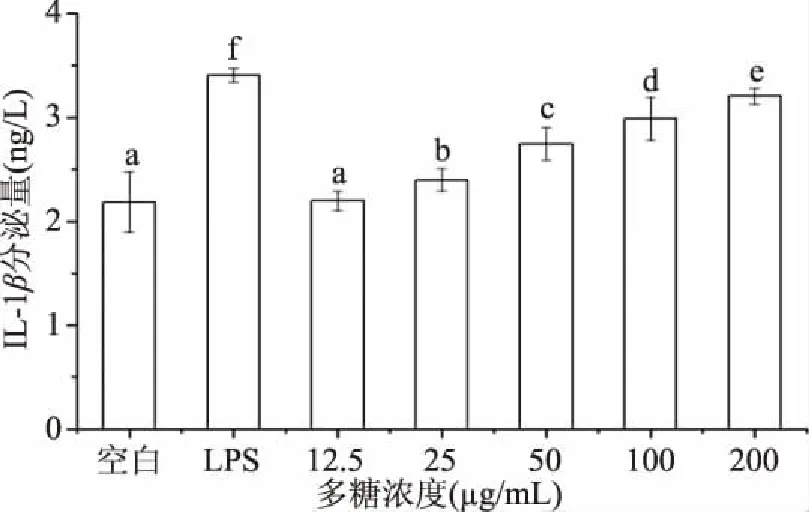
图9 新疆芜菁果胶多糖对小鼠巨噬细胞 RAW264.7的IL-1β分泌量影响Fig.9 Effect of BRP on production of IL-1β of RAW264.7 cell
由图9可知,与空白组相比,随着多糖浓度的不断增大,新疆芜菁果胶多糖均可以显著提高(P<0.05)小鼠巨噬细胞RAW264.7的IL-1β释放量,呈现明显的剂量效应;当其浓度为200 μg/mL时,IL-1β的释放量达到最大,释放量为3.21 ng/L,但仍然显著低于(P<0.05)10 μg/mL的LPS阳性对照组。
2.5.6 新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的IFN-γ释放量影响 IFN-γ是具有多种生物学功能的糖蛋白,也是重要的免疫调节细胞因子,可以增强巨噬细胞和T淋巴细胞的活力,起到免疫调节作用[30]。新疆芜菁果胶多糖对小鼠巨噬细胞RAW264.7的IFN-γ释放量影响如图10所示。
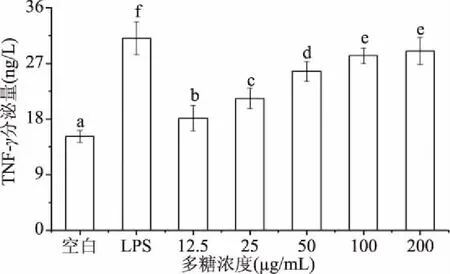
图10 新疆芜菁果胶多糖对小鼠巨噬细胞 RAW264.7的IFN-γ分泌量影响Fig.10 Effect of BRP on production of IFN-γ of RAW264.7 cell
由图10可知,与空白组相比,当多糖浓度在12.5~100 μg/mL时,不同浓度的新疆芜菁果胶多糖均可以显著促进(P<0.05)小鼠巨噬细胞RAW264.7的IFN-γ释放量,呈现明显的剂量效应;当其浓度为100 μg/mL时,IFN-γ的释放量达到最大,释放量为28.25 ng/L,但仍然显著低于(P<0.05)10 μg/mL的LPS阳性对照组。
3 结论
本论文采用水提醇沉法结合不同凝胶柱色谱分离纯化新疆芜菁果胶多糖,并对其进行组成分析及免疫活性评价。理化分析表明:新疆芜菁果胶多糖总糖含量为78.86%±1.01%、糖醛酸的含量为15.82%±1.05%、硫酸基的含量为0.14%±0.05%,但不含有蛋白质和总酚;傅立叶红外光谱、HPGPC及PMP衍生化分析表明:新疆芜菁果胶多糖为同时含有α-及β-构型糖苷键的吡喃糖,分子量为838 kDa,由鼠李糖与半乳糖醛酸两种单糖组成,其摩尔比为1.94∶98.06;RAW264.7细胞模型结果表明:当新疆芜菁果胶多糖浓度在12.5~100 μg/mL时,小鼠巨噬细胞RAW264.7的增殖活性、吞噬能力、NO及不同细胞因子的释放量随着新疆芜菁果胶多糖浓度的升高而升高,呈现明显的剂量效应,说明新疆芜菁果胶多糖具有很强的免疫调节活性。本文的研究结果为新疆芜菁果胶多糖类产品的开发和利用提供了一定的科学证据和研究思路。
