乳清蛋白组分在脱脂乳和乳清体系中热变性率的比较研究
2019-02-17麻志宁王媛媛李红娟李洪波于景华
麻志宁,王媛媛,李红娟,李洪波,于景华
(1.天津科技大学食品工程与生物技术学院,天津300457;2.梅花生物科技集团股份有限公司,河北廊坊065000)
0 引 言
乳清蛋白是脱脂乳粉的优质蛋白,不仅影响脱脂乳粉的营养价值,也与脱脂粉的多种应用特性有关。它通常由球状蛋白质组成,β-乳球蛋白(β-Lg),α-乳白蛋白(α-La)和牛血清白蛋白(BSA)是乳清蛋白中的主要蛋白质[1]。预热一般为脱脂乳粉加工的关键阶段,在杀菌加热条件下,乳清蛋白易发生变性和聚合,对乳清蛋白天然状态和稳定性会产生显著影响[2-3]。相比之下,酪蛋白热稳定性较高,在加热处理的常规条件下一般不产生变性[4],但当加热温度达到某种程度也与变性的乳清蛋白产生聚合,聚合物主要分成:(1)β-Lg与酪蛋白的聚集物,主要是β-Lg-κ-酪蛋白复合物[5];(2)随着加热温度升高,变性的α-La附 着在β-Lg-酪蛋白表面使其进入胶束相[6];(3)通过对牛乳的加热,因乳清蛋白中包含的二硫键和巯基,导致β-乳球蛋白的疏水基团暴露,发生巯基与二硫键的交换,而α-La随着不断地加热也发生变性,乳清蛋白在低温变性过程中α-La通过与β-Lg发生聚合间接与酪蛋白胶束结合,形成可溶性聚合物[7]。
近年来一些专家主要针对温度、p H[8-9]等对乳清蛋白变性的影响做了深入探讨,而酪蛋白作为乳中重要基质也对乳清蛋白的变性有一定作用,了解在低温下酪蛋白对乳清蛋白的影响可以在不同时间、温度下调节酪蛋白与乳清蛋白组间的热诱导聚合作用,朝着有利于乳粉加工特性的方向发展。新鲜牛乳在35℃左右离心去除脂肪得到脱脂乳。而将脱脂乳中酪蛋白沉淀离心后进行调酸调碱得到乳清上清液。将两种体系在一定条件下进行对比能够突出酪蛋白对乳清蛋白变性的作用。以往研究的样品多为脱脂乳、乳粉[10-11]等对比研究如此得到的检测结果不能完全反应乳清蛋白热变性及酪蛋白与乳清蛋白聚合情况。本研究以新鲜脱脂牛乳为基础实验材料,采用反相高效液相色谱法定量检测加热脱脂乳体系与乳清体系中未变性BSA、α-La、β-Lg的含量,通过探究乳清蛋白组间的相关性,了解低热脱脂乳粉关键温度的控制范围,研究乳清蛋白热变性趋势及酪蛋白对乳清蛋白变性影响大小,以及为乳粉的生产和使用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜牛奶(购于天津奶厂),预先离心除脂,5℃冷藏备用;三氟乙酸(色谱纯 天津赛孚瑞科技有限公司);乙腈(色谱纯博欧特(天津)化工贸易有限公司);超纯水。
1.2 仪器与设备
AB204-N电子天平上海METTLER TOLEDO集团;HWS24型电热恒温水浴锅上海-恒科学仪器有限公司;TDZ5-WS离心机湖南湘仪实验室仪器开发有限公司;FE20Mettler pH计梅特勒-托利多仪器(上海)有限公司;L2000高效液相色谱仪日本岛津公司;色谱柱(Venusil ASB-C8(250 mm×4.6 mm,5μm,300Å)。
1.3 试验方法
1.3.1 脱脂乳样品的制备
将脱脂乳分装在5个250 mL烧杯中分别水浴加热到55、65、75、85、95℃。5个样品在其对应加热温度下保持1、5、10、20、30 min,循环冰水浴中迅速自动冷却,然后用0.1 mol/L的HCl溶液沉淀酪蛋白和变性的蛋白质,直至溶液pH值调节至4.6达到沉淀终点。经6 500 g离心,取上清液过0.22μm滤膜,制成待检测样品。
1.3.2 乳清上清液的制备
脱脂乳用1 mol/L的HCl将p H值调节至4.6,沉淀酪蛋白,经6 500 g离心30 min后取上清液,用1 mol的NaOH溶液调节p H值至6.6~6.7,再将收集的乳清上清液按照1.3.1方法进行加热处理,检测结果与加热脱脂乳样品进行对比。
1.3.3 液相检测条件
液相条件:本实验采用RP-HPLC法分离并测定未变性的乳清蛋白的含量,实验用色谱柱为Venusil ASB-C8(250 mm×4.6 mm,5μm,300Å);流速为0.8 mL/min;进样量为10μL;检测波长为215 nm;柱温30℃;洗脱时间25 min;流动相A:0.1%的三氟乙酸水溶液;流动相B:0.1%的三氟乙酸乙腈溶液;采用梯度洗脱方式。
梯度洗脱:流动相B初始比例20%(流动相A为80%)在20 min内上升到80%(变化率为3%),然后在80%下等梯度洗脱6 min,最后1 min内降到20%,洗脱时间27 min。
1.3.4 BSA、α-La、β-Lg变性率的计算
根据所检测的未加热鲜脱脂奶和加热脱脂奶中检测到的蛋白含量,计算蛋白变性率。
蛋白变性率=(未加热样品中蛋白含量-加热样中蛋白含量)/未加热样中蛋白含量×100%
2 结果与分析
2.1 在乳清体系及脱脂乳体系中乳清蛋白主要组分对乳清蛋白热变性的影响
通过RP-HPLC方法分析脱脂乳在不同加热温度和加热时间下,乳清蛋白主要组分BSA、α-La、β-Lg的热变性率,并与同样处理的乳清体系中乳清蛋白的热变性率做比较分析,以评估乳清蛋白主要组分对乳清蛋白热变性的影响。
2.1.1 BSA对乳清蛋白热变性的影响
图1为不同加热温度(55~95℃)和不同加热时间(1~30 min)下,脱脂乳体系和乳清体系BSA的变性率比较结果。
如图1可得,在不同加热条件下,脱脂乳体系与乳清体系中BSA热变性趋势大致相同,当温度达到65℃时BSA变性显著,伴随着65~85℃加热温度的逐步升高,存在时间累积效应,即随着加热时间的增长,BSA变性率剧增,85~95℃几乎迅速全部变性。主要由于在加热温度达到60℃或以上时,BSA分子结构中自由巯基的显露致使BSA单体的稳定性减弱,分子结构打开生成聚合物[12]。BSA分子中的自由巯基能导致本身变化[13],温度的逐步升高使裸露的巯基发生巯基-二硫键的交换并且通过疏水作用本身产生聚合,最后生成凝胶。脱脂乳体系中酪蛋白几乎不对乳清蛋白变性产生影响,而BSA本身一般不会与酪蛋白产生聚集反应。Kang等[14]人猜想BSA也许与蛋白质间分子动力学不符,即BSA持续保留着不完整体形态,聚集反应不明显。BSA不仅可以利用本身聚集生成聚集物,而且能依靠二硫键与α-乳白蛋白生成少量可以溶解的聚集物。Hines等[15]人研究显示,BSA的聚合量与β-Lg关系不大。由此BSA也不可能依靠α-乳白蛋白与β-乳铁蛋白和酪蛋白生成不可溶解的聚集物,因此在含有一定乳清蛋白的牛乳状态中,BSA的变性趋向不可能呈现明显差别。
2.1.2 α-La对乳清蛋白热变性的影响

图1不同加热温度与加热时间下,脱脂乳体系与乳清体系中BSA的变性率
图2为不同加热温度(55~95℃)和不同加热时间(1~30 min)下,脱脂乳体系和乳清体系中α-La的变性率比较结果。
从图2可以看出65~95℃加热温度下,α-La的变性率随加热时间的延长而平稳增加。随着温度的不断升高,α-La打开了分子内二硫键通过疏基二硫键交换反应产生聚集[16]。温度低于75℃时,在加热脱脂乳体系与乳清体系中的α-La变性率差异较小,而在75~95℃的加热范围内变性率区别明显。α-La不含有游离巯基,不会出现自聚合反应,在加热温度低于75℃时,脱脂乳体系与乳清体系中的α-La大部分都只发生空间结构变化,在此温度之间,使得在乳清蛋白聚合中起主导作用的β-Lg没有发生大量变性[17],不能提供游离巯基,而BSA加热后发生的自聚现象,使单体BSA的量降低[18],α-乳白蛋白运用极小量的BSA供给的巯基与之发生聚合,但BSA自身含量较低,两者生成的复合物含量低微,聚合度不大,几乎不与酪蛋白聚合。加热温度高于75℃,特别是85℃左右时,脱脂乳体系与乳清体系中的α-乳白蛋白变性率差异趋于显著,或许是脱脂乳体系中β-乳铁蛋白的球状蛋白结构破坏失去稳定,α-乳白蛋白利用β-乳铁蛋白游离出的巯基参加与酪蛋白胶束的反应,α-乳白蛋白与酪蛋白聚集量逐渐增多,结合的α-La-β-Lg也与酪蛋白聚集,因而使α-La变性速度增快。95℃时脱脂乳体系与乳清体系中α-乳白蛋白变性率差异较小,乳清体系中原来被保存下来的α-乳白蛋白由于加热温度较高,加热时间太长而全都发生变性,并与乳清蛋白中的其它蛋白组分产成聚集物。

图2不同加热温度与加热时间下,脱脂乳体系与乳清体系中α-La的变性率
2.1.3 β-Lg对乳清蛋白热变性的影响
图3为不同加热温度(55~95℃)和不同加热时间(1~30 min)下,脱脂乳体系和乳清体系中β-Lg的变性率比较结果。
由图3可以看出,在加热温度为75~85℃时,脱脂乳体系与乳清体系中的β-Lg变性程度有明显差别。温度升高,β-Lg空间构象产生变化,巯基发生暴露,聚合量逐渐增多,但因酪蛋白的结构稳定,自身很难发生变性[19]。当温度达到80℃以上时,β-Lg变性率激增,脱脂乳体系中酪蛋白产生解离,覆盖在酪蛋白胶束表面的κ-CN会与己变性的β-Lg产生反应。对脱脂牛奶进行加热过程中,β-Lg的两个二硫键和一个巯基在与κ-CN反应中起到重要作用,κ-CN分子中含有2个巯基(-SH),受热形成二硫键(-S-S-),与变性的β-Lg分子中游离巯基发生分子间巯基-二硫键反应,形成κ-CN/β-Lg复合物质凝聚在酪蛋白胶束表面[20],同时在加热温度不断升高的情况下不止是通过改变分子的结构产生聚合反应,也可能是分子间的无规则布朗运动加剧,分子间的碰撞提高而促进聚合物的生成[21]。在脱脂奶中还有一些含量较低的乳铁蛋白和αs2-酪蛋白中含有的二硫键也可以与巯基产生交互作用形成热诱导聚集体[22]。
乳清体系中缺少酪蛋白,当加热温度低于75℃时,乳清蛋白变性率较低,其自身不会产生很大程度变性,85℃脱脂乳中部分变性的β-Lg与κ-酪蛋白聚合,在较高的温度下蛋白分子间疏水相互作用的增加也进一步促进反应向蛋白变性的方向进行[23]。由于加热温度的持续升高,乳清蛋白组分间产生的游离巯基继续促进变性蛋白通过巯基-二硫键交换聚合·成高聚物,直到最后β-Lg实现完全变性。
在β-Lg变性过程中,乳清体系中产生的盐离子也可能影响β-Lg的变性程度。盐离子浓度的增加使蛋白质的电荷分布发生变化,β-乳球蛋白以非共价键的形式存在且形成的聚合物一般为低聚体[24]。NaCI具有盐析作用,当盐离子浓度较高时,它能够稳定蛋白质的空间构象,使β-Lg的变性速率减慢。高浓度盐离子还能够加快蛋白的聚合。当盐离子浓度较低时,蛋白的表面特性发生改变,物理化学聚集速度提高,聚集物增大[25-26]。Nicorescu[27]发现在WPI溶液中加入NaCI溶液,有利于蛋白质单体和二聚体的盐析聚集,促进可溶性聚合物含量增加,乳清蛋白溶液的表面张力降低。Aymard[28]等研究发现在盐离子浓度增大的过程中,β-乳球蛋白中单体和二聚体失去了平衡,二聚体含量逐步增多。由此推测出由于加入的盐离子使蛋白分子产生静电排斥,所带电荷进行重新分布。所以盐离子浓度可能会影响β-乳球蛋白的聚集程度,进而影响变性速率。
从脱脂乳体系与乳清体系中3种蛋白热变性率对比趋势图能够得出,酪蛋白对BSA热变性影响不大,而一定程度上在65~95℃之间促进了α-La和β-Lg的热变性,但蛋白的最终变性趋势相同,即趋向全部变性。因此酪蛋白的缺失不会对乳清蛋白的最终变性产生很大影响,只是减缓了乳清蛋白的聚合速度,并没有使乳清蛋白在95℃加热下的最终变性程度下降。
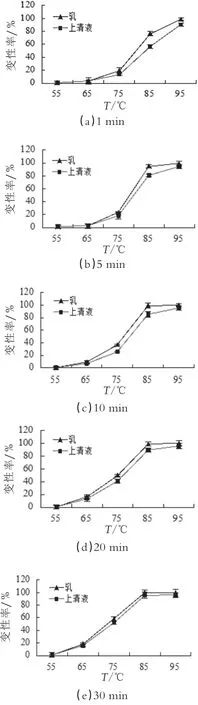
图3不同加热温度与加热时间下,脱脂乳体系与乳清体系中β-Lg的变性率
3 结 论
对比乳清体系与脱脂乳体系中BSA、α-La和β-Lg的热变性情况分析显示BSA在脱脂乳体系与乳清体系中变性趋势基本相同,α-La的变性率在75~95℃的加热范围内呈现一定差量,而β-Lg在75~85℃加热范围内变性率有明显差异。
3种蛋白的热变性率具有明显的温度与时间累积效应,BSA的热变性激增区间为55~85℃,β-Lg为65~75℃,而α-La的热变性率则在65~95℃间随加热时间和加热温度的升高而平稳增加,三种蛋白热稳定性大小顺序为:α-La>β-Lg>BSA。乳清体系中产生的盐离子在一定程度能够增强溶液中的离子强度,对β-乳球蛋白的变性可能会产生一定影响。
通过对两种体系中BSA、α-La和β-Lg的热变性比较表明酪蛋白对BSA的热变性几乎没有影响,而对65~95℃间α-La和β-Lg的热变性有一定的促进作用,能够加速乳清蛋白之间的诱导聚合反应。缺乏酪蛋白,乳清蛋白的聚合速度减缓,而95℃的最终变性率基本相同。
本文对脱脂乳体系和乳清体系中的乳清蛋白主要组分在不同条件下进行了比较分析,在低温下了解了乳清蛋白主要组分的变性情况,而在高温状态下两种体系中乳清蛋白主要组分的变化需进一步研究。在实际生产中的压力、p H、离子强度等因素也可能会影响蛋白变性情况,需要更深入进行全面系统研究。进一步了解脱脂乳体系和乳清体系中的蛋白变性情况更有利于实际生产中的加工运用。
