中国东北地区水稻纹枯病病原菌种类及融合群的分子鉴定
2019-02-10张照茹魏松红杨晓贺王海宁许月
张照茹 魏松红 杨晓贺 王海宁 许月


摘要 :為明确中国东北地区水稻纹枯病病原菌种类及融合群的归属情况,2015-2017年从黑龙江省、吉林省和辽宁省的17个水稻主产区采集水稻纹枯病标样,分离获得水稻纹枯病菌214株,运用水稻纹枯病菌的不同病原菌及融合群的特异性引物对214株水稻纹枯病菌进行病原菌种类和融合群鉴定,并利用rDNA内转录间隔区(ITS)序列,对供试水稻丝核菌的融合群归属进行了分析。结果表明:供试214株水稻纹枯病菌分属于茄丝核菌Rhizoctonia solani和水稻丝核菌Rhizoctonia oryzae sativae,菌株数分别为198株和16株,占比分别为92.52%和7.48%。茄丝核菌菌株分属于2个融合群,分别为AG1 IA和AG4,菌株数分别为191株和7株,占比分别为96.46%和3.54%。水稻丝核菌菌株均属于AG Bb融合群,菌株数为16株。不同年份水稻纹枯病的病原菌种类及融合群出现的频率和地域分布无明显变化,而不同地域间水稻纹枯病病原菌的种类及融合群具有明显的分化特征,AG1 IA融合群在中国东北三省各个水稻产区均有分布且均为优势融合群,AG4融合群在辽宁省盘锦市出现频率最高,水稻丝核菌AG Bb融合群在吉林省吉林市、通化市和梅河口市出现频率最高。
关键词 :水稻纹枯病; 茄丝核菌; 水稻丝核菌; 融合群
中图分类号:
S 435.111.42
文献标识码: A
DOI: 10.16688/j.zwbh.2018435
Molecular identification of pathogens and anastomosis groups of
rice sheath blight in Northeast China
ZHANG Zhaoru1, WEI Songhong1, YANG Xiaohe1,2, WANG Haining1, XU Yue1
(1. College of Plant Protection, Shenyang Agricultural University, Shenyang 110161, China;
2. Jiamusi Branch of Heilongjiang Academy of Agricultural Sciences, Jiamusi 154007, China)
Abstract
In order to elucidate the pathogens and anastomosis group of rice sheath blight in Northeast China from 2015 to 2017, 214 strains of rice sheath blight were isolated from 17 main rice producing areas in Heilongjiang, Jilin and Liaoning provinces. The specific primers of different pathogens and anastomosis groups of rice sheath blight pathogen were used to identify the pathogens and anastomosis group of 214 isolates, and sequence of the internal transcription spacer of rDNA (ITS) was used to analyze the belonging of the anastomosis group of Rhizoctonia oryzae sativae. The results showed that 214 isolates belonged to two pathogens. For Rhizoctonia solani and R.oryzae sativae, the number of strains was 198 and 16, accounting for 92.52% and 7.48%, respectively. R.solani strains belong to two anastomosis groups, the number of AG1 IA and AG4 strains was 191 and 7 accounting for 96.46% and 3.54%, respectively. Phylogenetic analysis of ITS sequence showed that R.oryzae sativae belonged to AG Bb. In different years, the occurrence frequency and regional distribution of different populations and anastomosis groups of rice sheath blight pathogen had no significant change, but different populations and anastomosis groups of rice sheath blight pathogen in different regions had obvious differentiation characteristics. AG1 IA anastomosis group distributed in all rice producing areas, and it was the major anastomosis group with the highest frequency in Panjin, Liaoning province. The AG Bb anastomosis group of R.oryzae sativae appeared most frequently in Jilin city, Tonghua city and Meihekou city, Jilin province.
Key words
rice sheath blight; Rhizoctonia solani; Rhizoctonia oryzae sativae; anastomosis group
水稻纹枯病是水稻种植过程中一种常见和多发的真菌性病害,近年来,随着施肥水平的提高和多蘖矮秆品种的种植,水稻纹枯病呈逐年加重的趋势,成为稳态流行病害[1]。水稻纹枯病主要由茄丝核菌Rhizoctonia solani引起,后又发现水稻枯斑丝核菌Rhizoctonia oryzae与水稻丝核菌Rhizoctonia oryzae sativae也可引起纹枯病,但致病力较弱[2]。丝核菌种内具有明显的分化现象,存在着不同的菌丝融合群,到目前为止茄丝核菌的融合群包括AG1~AG13和AG BI,每个融合群下又分为多个亚群。双核丝核菌融合群命名以1984年Ogoshi等[3]命名的英文字母编号为准。
将待测菌株与标准菌株对峙生长,观察两者之间的菌丝是否融合是目前鉴定水稻纹枯病菌融合群归属的常用方法,但该方法也有诸多缺点,例如该方法费时费力、观测时容易出现人为错误,且菌株长期培养后失去融合能力以及标准菌株较难获得等。近年来,用于水稻纹枯病菌融合群分类的分子生物学技术日益增多,包括DNA指纹技术、特异性PCR鉴定技术和rDNA测序技术等。
由于rDNA的ITS区在不同物种间具有明显的特异性,目前应用 rDNA ITS 序列进行特定融合群鉴定的研究越来越多。Matsumoto[4]设计出了鉴定茄丝核菌AG1融合群和AG2融合群下不同融合亚群rDNA的特异性引物,可以快速准确地鉴定AG1 IA、AG1 IB、AG1 IC、AG2 1和AG2 2融合亚群。伍恩宇[5]设计出了鉴定茄丝核菌AG4融合群的特异性引物。Lees等[6]设计出了鉴定茄丝核菌AG3融合群的特异性引物。Okubara等[7]根据rDNA的ITS序列,设计出可以快速鉴定茄丝核菌AG2 1融合亚群、AG8融合群、AG10融合群的特异性引物。
本研究利用水稻纹枯病菌不同病原菌和融合群的特异性引物以及ITS序列分析对分离自黑龙江省、吉林省和辽宁省的17个水稻主产区的214株水稻纹枯病菌病原菌和融合群进行分子鉴定,旨在为水稻抗病育种、水稻纹枯病预测预报以及水稻纹枯病的综合防治提供理论基础。
1 材料与方法
1.1 供试水稻纹枯病菌采集和分离
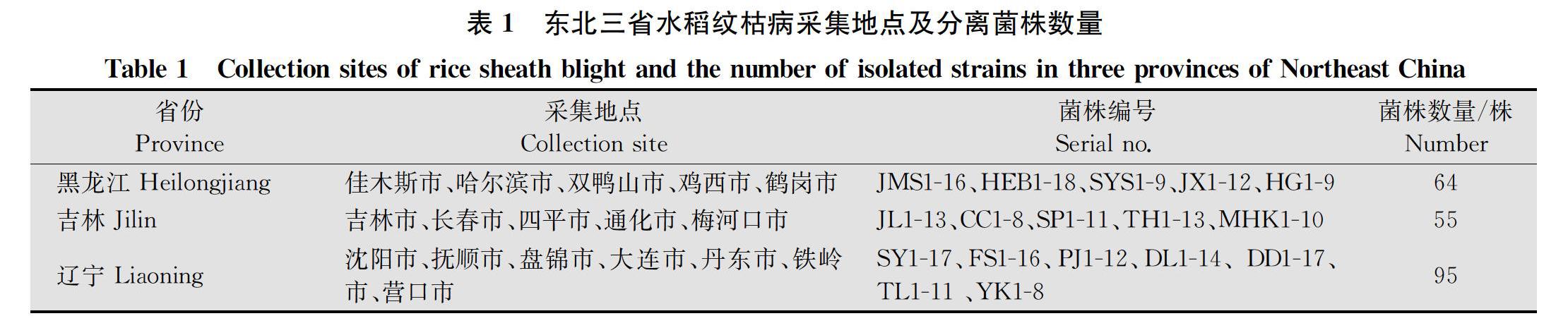
2015-2017年从黑龙江省、吉林省和辽宁省17个水稻主产区采集水稻纹枯病标样310份。参考周而勋等[8]的水稻纹枯病菌分离方法进行病原菌的分离、纯化,共获得水稻纹枯病菌214株,纯化菌株转入装有马铃薯葡萄糖琼脂培养基的试管中-4℃保存,供试菌株信息见表1。
1.2 供试水稻纹枯病菌DNA提取
1.2.1 菌丝培养
将供试菌株于PDA培养基上28℃恒温培养3 d,用直径5 mm打孔器打取3个菌饼,接种到PD培养液中,恒温摇床(28℃、120 r/min)培養5 d。
1.2.2 菌丝体制备及DNA提取
恒温摇床培养5 d后过滤收集菌丝体,在40℃的烘箱中恒温放置12 h,将烘干后的菌丝体在液氮中充分研磨,使用OMEGA真菌DNA提取试剂盒(D3390 01 OMEGA)提取供试菌株DNA。
1.3 不同水稻纹枯病病原物及融合群特异性引物检测
各融合群特异性引物(表2)均由上海生物工程股份有限公司合成。PCR反应体系(25 μL):2.5 μL 10×buffer PCR反应缓冲液、200 μmol/L dNTPs、1.25 mmol/L MgCl2、1U Taq DNA聚合酶、10 μmol/L上、下游引物、50 ng模板DNA,由ddH2O补齐至25 μL。反应条件:94℃预变性5 min;94℃变性1 min,60℃退火1 min,72℃延伸2 min,30个循环;72℃延伸1 min,4℃保存。PCR扩增产物在1%琼脂糖凝胶和1×TAE缓冲液中进行电泳检测,电压120 V,电泳45 min,凝胶成像系统拍照后保存并记录。
1.4 水稻丝核菌菌株ITS序列分析
利用ITS序列通用引物ITS1和ITS4(表2)对上述筛选出的水稻丝核菌菌株DNA进行PCR 扩增,PCR反应条件:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,重复30个循环;72℃延伸5 min。所得PCR产物由生工生物工程(上海)股份有限公司进行序列测定,测得的序列经NCBI进行BLAST比对后,用MEGA 6.0软件进行序列分析,构建系统发育树,确定其融合群归属[12]。
2 结果与分析
2.1 东北地区水稻纹枯病病原物种类鉴定
对214株供试水稻纹枯病病原物种类归属情况进行特异性分子鉴定,结果表明(图1~图2):2015年-2017年东北三省供试水稻纹枯病菌中茄丝核菌198株,水稻枯斑丝核菌0株,水稻丝核菌16株,占比分别为92.52%、0%和7.48%。2015年分离获得茄丝核菌和水稻丝核菌的菌株数分别为56株和6株、占比分别为90.32%和9.68%;2016年分离获得茄丝核菌和水稻丝核菌的菌株数分别为65株和5株、占比分别为92.86%和7.14%;2017年分离获得茄丝核菌和水稻丝核菌的菌株数分别为77株和5株、占比分别为93.90%和6.10%。不同年份间水稻纹枯病病原菌种类的出现频率无明显变化。源于黑龙江省的茄丝核菌和水稻丝核菌的菌株数分别为60株和4株、占比分别为93.75%和6.25%;源于吉林省的茄丝核菌和水稻丝核菌的菌株数分别为45株和10株、占比分别为81.82%和18.18%;源于辽宁省的茄丝核菌和水稻丝核菌的菌株数分别为93株和2株、占比分别为97.89%和2.11%。茄丝核菌在我国东北三省稻区均有分布,而水稻丝核菌在地域间存在较明显差异,水稻丝核菌出现频率较高的水稻产区主要集中在吉林省的吉林市、通化市和梅河口市。
2.2 茄丝核菌融合群分子鉴定
对上述筛选出的198株茄丝核菌进行不同融合群特异性分子鉴定,结果(图3~图4)表明:供试菌株分属于2个融合群,分别为AG1 IA融合群和AG4融合群,菌株数分别为191株和7株,占比分别为96.46%和3.54%。茄丝核菌AG1 IA融合群属于优势融合群,且在各水稻产区均有分布,AG4融合群出现频率及占比在不同年份间无明显差异,而在不同地域间存在较明显差异,辽宁省、吉林省和黑龙江省出现菌株数分别为5株、1株和1株,占比分别为71.42%、14.29%和14.29%。
2.3 水稻丝核菌融合群分子鉴定结果
对筛选出的16株水稻丝核菌进行ITS基因序列PCR扩增,经测序获得的目的片段大小均为748 bp。与GenBank中已知序列进行同源性比较,BLAST 结果表明,供试16株菌株与AG Bb融合群的相似度最高,达到99%,采用MEGA 6.0软件构建系统发育树(图5),供试16株菌株均与水稻丝核菌AG Bb融合群位于同一分支上。综上所述,将16株水稻丝核菌归属于AG Bb融合群。
3 结论与讨论
本研究利用水稻纹枯病不同病原物种类和融合群的特异性引物以及ITS序列分析对2015-2017年分离自黑龙江、吉林省和辽宁省17个水稻主产区的214株水稻纹枯病菌进行病原物种类和融合群的分子鉴定,发现我国东北地区水稻纹枯病的主要致病菌为茄丝核菌,占总菌株数的92.52%;其次为水稻丝核菌,占总菌株数的7.48%;未发现水稻枯斑丝核菌。茄丝核菌的优势融合群为AG1融合群下的AG1 IA亚群,占总菌株数96.46%;其次为AG4融合群,占总菌株数的3.54%。水稻丝核菌的融合群均为AG Bb。
据报道,水稻纹枯病致病菌有茄丝核菌、水稻枯斑丝核菌和水稻丝核菌[13]。本研究发现,我国东北三省稻区水稻纹枯病致病菌只有茄丝核菌和水稻丝核菌。茄丝核菌在我国东北三省稻区各地区均有分布,而水稻丝核菌主要集中在吉林省的吉林市、通化市和梅河口市。导致水稻丝核菌地理分布差异的原因还有待进一步研究。
茄丝核菌、水稻枯斑丝核菌和水稻丝核菌在致病性、生物学特性、遗传多样性以及对杀菌剂的敏感性等方面均存在较大差异[1416],本研究仅明确了我国东北地区水稻纹枯病的病原有茄丝核菌和水稻丝核菌,还需进行不同水稻纹枯病病原菌分布频率和地理分布差异的研究,为制定我国东北地区水稻纹枯病的综合防控策略奠定病原学基础。
本试验结果表明,AG1 IA融合亚群是东北地区水稻纹枯病菌的优势融合群,这一结果与中国其他地区的水稻纹枯病菌融合群鉴定结果一致[1718]。刘志恒等[19]和桑海旭等[20]分别对辽宁以及辽河三角洲地区的水稻纹枯病菌进行融合群鉴定,其结果中AG4融合群主要分布在辽宁省盘锦市和丹东市,与本试验结果一致。但本试验未发现杨根华等[21]報道的分离自云南水稻纹枯病的AG1 IC融合亚群和AG 6GW融合亚群,也未发现张俊华等[22] 报道的分离自黑龙江水稻纹枯病的AG5融合群,说明水稻纹枯病菌不同融合群的分布与地理区域具有一定相关性。
参考文献
[1] 桑海旭,王井士,刘郁,等.水稻纹枯病对水稻产量及米质的影响[J].北方水稻,2013,43(1):1013.
[2] 张优,魏松红,王海宁,等.东北地区水稻纹枯病菌遗传多样性和致病性分析[J].沈阳农业大学学报,2017,48(1):914.
[3] OGOSHI A.Studies on the taxonomy of the genus Rhizoctonia[J].Annals of the Phytopathological Society of Japan,1984,50(3):307309.
[4] MATSUMOTO M.Trials of direct detection and identification of Rhizoctonia solani,AG 1 and AG 2 subgroups using specifically primed PCR analysis [J].Mycoscience,2002,43(2):185189.
[5] 伍恩宇.茄科蔬菜立枯丝核菌的遗传分化及分子检测[D].泰安:山东农业大学,2008.
[6] LEES A K,CULLEN D W,SULLIVAN L,et al.Development of conventional and quantitative real time PCR assays for the detection and identification of Rhizoctonia solani AG 3 in potato and soil [J].Plant Pathology,2002,51(3):293302.
[7] OKUBARA P A,SCHROEDER K L,PAULITZ T C.Identification and quantification of Rhizoctonia solani and R.oryzae using real time polymerase chain reaction [J].Phytopathology,2008,98(7):837847.
[8] 周而勋,杨媚.从植物病组织中分离立枯丝核菌的快速、简便技术[J].华南农业大学学报,1998,19(1):125126.
[9] JOHANSON A,TURNER H C,MCKAY G J,et al.A PCR based method to distinguish fungi of the rice sheath blight complex,Rhizoctonia solani,R.oryzae and R.oryzae sativae [J].FEMS Microbiology Letters,1998,162(2):289294.
[10]劉连盟,王玲,黄世文.水稻纹枯病菌融合群判定的鉴定方法:CN 101792795 A [P].20100804.
[11]WHITE T J,BRUNS T D,LEE S B,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M].PCR protocols:a guide to methods and applications,1990:315322.
[12]王爱军,王娜,顾思思,等.我国水稻纹枯病菌的融合类群及致病性差异[J].草业学报,2018,27(7):5563.
[13]HU Chunjin, WEI Yuanwen, HUANG Siliang, et al. Identification and characterization of fungal strains involved in rice sheath blight complex in guangxi province [J].西北农业学报,2010,19(2):4551.
[14]刘志恒,胡积祥,王世维,等.吉林水稻纹枯病菌多核和双核菌株生物学特性比较[J].沈阳农业大学学报,2013,44(4):428433.
[15]刘志恒,胡积祥,侯悦,等.水稻茄丝核菌SRAP引物筛选与体系优化[J].植物保护学报,2013,40(5):407412.
[16]魏松红,王海宁,胡积祥,等.吉林地区水稻纹枯病菌对噻呋酰胺药物的敏感基线探讨[J].沈阳农业大学学报,2016,47(3):278282.
[17]邓先明.四川省西北部稻区水稻纹枯病菌系研究[J].西南大学学报,1991(4):380383.
[18]蒙姣荣,张超冲,李界秋,等.广西水稻纹枯病菌菌丝融合群鉴定初报[J].中国农学通报,2006,22(6):327.
[19]刘志恒,韩翔宇,杨红,等.辽宁省水稻纹枯病菌菌丝融合群鉴定初报[J].沈阳农业大学学报,2010,41(1):8285.
[20]桑海旭,王井士,李俊和,等.辽河三角洲水稻纹枯病菌丝融合群测定[J].北方水稻,2011,41(6):1922.
[21]杨根华,董文汉.云南省水稻纹枯病菌系研究[J].菌物学报,2002,21(2):274279.
[22]张俊华,常浩,牟明,等.黑龙江省水稻纹枯病菌菌丝融合群判定及遗传多样性分析[J]. 东北农业大学学报, 2017, 48(2): 2028.
(责任编辑:杨明丽)
