雨生红球藻多糖的分离纯化和免疫活性组分鉴定
2019-01-28刘晓娟
刘 涵,张 苗,刘晓娟,曹 庸
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东 广州 510642)
雨生红球藻(Haematococcus pluvialis),又称湖生红球藻或湖生血球藻,是一种单细胞绿藻,被认为是继螺旋藻、小球藻之后的又一高经济价值的微藻,富含虾青素、多糖、蛋白质、维生素和微量元素等营养成分,2010年被国家卫生和计划生育委员会批准为新食品原料[1]。目前雨生红球藻的研究主要集中在虾青素的高效生产,提取完虾青素后的藻渣作为动物饲料或直接丢弃,雨生红球藻资源未得到充分利用。雨生红球藻中碳水化合物所占比例较高,约占细胞干质量的30%~40%,且多糖含量高达干质量的6%~10%,多糖基本上都保留在脱脂后的藻渣中,因此对其进一步高值化开发利用具有重要意义。
近些年来,微藻多糖由于资源丰富、具有独特的化学结构和生物活性等备受关注。目前国内外报道的藻类多糖主要有抗氧化、抗衰老、抗炎、抗肿瘤、降血脂、增强免疫等生物活性[2-7],其中增强机体免疫力是大多数多糖包括微藻多糖所具有的生物活性。大量研究发现湖泊红球藻(Haematococcus lacustris)、小球藻(Chlorella)、紫球藻(Porphyridium cruentum)、绿色巴甫藻(Pavlova viridis)等微藻多糖均能促进脾淋巴细胞的增值,增强吞噬细胞的吞噬作用,促进巨噬细胞合成NO发挥正向免疫调节功能[8-11]。绿藻(Coccomyxa gloeobotrydiformis)中提取的多糖AEX可以促进细胞外的抗原呈递,抑制细胞内的抗原呈递,激活鸡外周血分子细胞PBMCs反应[12]。螺旋藻(Spirulina)水提物可增加免疫功能低下小鼠免疫器官质量,促进淋巴细胞转化,提高NK细胞活性,还能增强慢性乙型肝炎患者外周血单个核细胞的增殖能力,上调慢性乙型肝炎患者外周血单个核细胞IFN-γm RNA的表达[13-14]。
关于雨生红球藻多糖的研究还十分有限,有研究表明超声辅助碱提雨生红球藻多糖对1,1-二苯基-2-三硝基苯肼自由基有较好的清除效果,清除率达60%以上[15],还有研究报道雨生红球藻多糖具有促血栓溶解活性[16]。雨生红球藻胞外多糖以剂量依赖性方式抑制BGC-823和HL60细胞的生长,在2 mg/mL时抑制率分别为68%和40%[17]。本研究以虾青素提取后的雨生红球藻渣为原料,在体外免疫细胞模型活性跟踪下,对超声辅助提取的雨生红球藻粗多糖(Haematococcus pluvialis polysaccharide,HPP)进一步采用DEAE-52纤维素阴离子交换柱层析和Sephacryl S400葡聚糖凝胶柱层析进行分离纯化,使用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)法测定各组分多糖分子质量,对免疫活性组分进行鉴定,研究结果为雨生红球藻的高值化综合利用提供了有利指导。
1 材料与方法
1.1 材料与试剂
雨生红球藻渣 荆州天然虾青素有限公司;BALB/c小鼠,雄性,6~8 周(许可证号:SCXK粤2016-0041)南方医科大学SPF级实验动物中心;胎牛血清 杭州四季青生物有限公司;青-链霉素溶液、无酚红RPMI1640美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、0.4%台盼蓝、葡聚糖标准品 美国Sigma-Aldrich贸易有限公司;DEAE-52纤维素 英国Whatman公司;Sephacryl S400 美国GE公司;丙烯酰胺、高碘酸、无水乙醇、浓硫酸、碳酸氢铵、苯酚均为国产分析纯。
1.2 仪器与设备
AL104万分之一电子天平、DELTA320 pH计 梅特勒-托利多仪器(上海)有限公司;JY92-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;DF-101S数显电热恒温水浴锅 巩义予华仪器有限公司;SHZ-D(III)循环水式多用真空泵 巩义市英峪高科仪器厂;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;FD-1冷冻干燥机 北京博医康技术公司;DHG-970电热恒温鼓风干燥箱 上海齐心科学仪器有限公司;UV3010紫外分光光度计 日本日立高科技公司;TGL-16G高速台式离心机 上海安亭仪器厂;Φ1.6 cm×60 cm层析柱上海精科实业有限公司;LC-10A Tvp Plus分析高效液相色谱系统 日本岛津公司。
1.3 方法
1.3.1 HPP的提取
称取5.0 g干燥的雨生红球藻渣,加入125 mL蒸馏水,在超声功率400 W条件下提取30 min,然后置于90 ℃恒温水浴浸提3 h,冷却,4 000 r/min离心10 min,取上清液浓缩,加入4 倍体积无水乙醇,静置过夜,再经4 000 r/min离心10 min后取沉淀,用无水乙醇洗涤,冷冻干燥得HPP[18]。
1.3.2 HPP的分离纯化
1.3.2.1 DEAE-52纤维素柱层析法
将活化好的DEAE-52纤维素填料,用2~3 倍柱体积的蒸馏水以1.5 mL/min流速沿着玻璃棒缓慢均匀的流入层析柱(3.0 cm×35 cm)平衡6 h。配制质量浓度为10 mg/mL HPP溶液10 mL上样。梯度洗脱采用蒸馏水、0.1、0.3、0.5、1.0 mol/L NaCl溶液进行洗脱,流速为2 mL/min,每10 mL收集一管,恒流泵自动加入缓冲液。以硫酸-苯酚法追踪检测多糖流出,以管数为横坐标,吸光度为纵坐标,绘制多糖分级流出的出峰图谱[19]。每个峰收集为一个组分,每个组分注入3 500 Da透析袋进行透析,以蒸馏水作为外部渗透液,48 h透析完全,用0.1 mol/L的AgNO3溶液检测渗出液Cl-残留。透析后样品溶液浓缩冻干备用,并用HPGPC测定柱层析后分部收集的各多糖组分分子质量分布范围。
1.3.2.2 Sephacryl S400凝胶柱层析法
将Sephacryl S400凝胶填料纯水浸泡过夜使其充分溶胀后填装柱(1.6 cm×70 cm),上样方法同DEAE-52纤维素柱。配制质量浓度为20 mg/mL HPP-c3多糖溶液1 mL上样。以0.1 mol/L碳酸氢铵溶液为洗脱液,流速为0.3 mL/min,每5 mL收集一管,恒流泵自动加入洗脱液。以硫酸-苯酚法追踪检测多糖的流出,以管数为横坐标,吸光度为纵坐标,绘制多糖的出峰图谱。隔管采用HPGPC检测并根据HPGPC图谱合并洗脱液,浓缩冻干合并液得到各多糖组分[20]。
1.3.3 HPP增强免疫活性的测定
1.3.3.1 脾细胞悬液的制备
小鼠脱颈处死,75%乙醇溶液浴10 min后置于超净工作台。取出脾脏,放于盛有5 mL预冷的RPMI-1640完全培养基的培养皿中,用1 mL注射器从培养皿中吸取完全培养液,将针头纵向扎入脾脏内部,反复抽吸几次,获取足量脾细胞,剩余脾脏用一次性玻璃注射器芯轻轻研磨。将50 mL离心管口套一张200 目不锈钢筛(无菌),然后将脾细胞悬液过筛转移至离心管,1 000 r/min离心8 min,弃去上清液[21]。向细胞沉淀加入5 mL预冷的RPMI-1640完全培养基,吹打制成细胞悬液,用台盼蓝染色法进行活细胞计数。用预冷的RPMI-1640完全培养基稀释调整细胞密度至1.0×107~1.2×107个/mL。
1.3.3.2 接种培养
取96 孔细胞培养板,每孔加入细胞悬液50 µL,置于37 ℃、5% CO2培养箱中培养4 h。取出细胞培养板,空白对照组加入RPMI-1640完全培养基25 µL,样品组每孔加入不同质量浓度样品溶液25 µL,各多糖组分终质量浓度为3.9、7.8、15.6、31.2、62.5、125、250、500、1 000 µg/mL,再加入完全培养基25 µL,使每孔体积100 µL。每个质量浓度样品设6 个复孔,培养48 h。
1.3.3.3 MTT活性检测
在培养结束前4 h,每孔加MTT溶液20 µL。继续孵育4 h后终止培育。将96 孔板3 000 r/min离心10 min,弃去上清液,每孔加入150 µL DMSO,振荡5 min,使结晶物充分融解。测定波长570 nm处各孔光密度值,以样品质量浓度为横坐标,刺激指数为纵坐标绘制免疫调节效果图[22-23]。刺激指数按下式计算:

1.3.4 HPP-c3-s1纯度和分子质量检测
1.3.4.1 全波长扫描
将HPP-c3-s1配制成0.1 mg/mL,使用紫外分光光度计进行全波长扫描。
1.3.4.2 HPGPC法测定
将相对分子质量为5 000、12 000、25 000、50 000、8 0000、150 000、270 000、410 000、670 000的葡聚糖标准品,用流动相配制成4.0 mg/mL的溶液,并过0.22 µm水相滤头,进样量20 µL,检测时间45 min,记录色谱图。得到葡聚糖相对分子质量对数lgM与洗脱体积的曲线,并对曲线进行二次回归拟,得出与曲线相关度较好的葡聚糖HPGPC校正曲线,用于确定被测样品中多糖分子质量分布范围[24]。HPGPC校正曲线方程为y=0.225 6x2-5.135 7x+33.715(x为葡聚糖相对分子质量对数lgM,y为洗脱体积),线性相关系数R2为0.988 7。将柱层析后分部收集的各HPP组分用流动相配成一定质量浓度的样液,过0.22 µm水相滤头,进行色谱分析。
1.3.4.3 聚丙烯酰胺凝胶电泳法
取HPP-c3-s1样品1 mg,加入硼酸缓冲液0.1 mL溶解。以3∶1的比例与上样缓冲液混合,振荡完全溶解后10 000 r/min离心5 min,取上清液得供试品溶液。用移液枪移取10 μL供试品溶液到上样孔。电泳开始时,用40 V恒压电泳20 min,后加大电压至110 V恒压电泳1 h。电泳结束后,经过漂洗、高碘酸氧化、染色和脱色后拍照。
1.4 数据处理
2 结果与分析
2.1 利用DEAE-52纤维素柱层析对HPP进行分离纯化
2.1.1 HPP的DEAE-52纤维素柱层析洗脱曲线
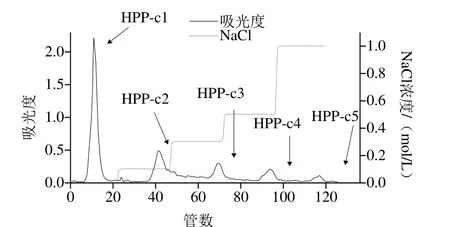
图 1 HPP的DEAE-52纤维素柱层析洗脱曲线Fig.1 Elution curve of Haematococcus pluvialis polysaccharides (HPPs)on DEAE-52 cellulose column
从粗多糖中得到均一高纯度活性多糖组分的分离纯化方法很多,主要包括沉淀法、膜分离法和柱层析法等。柱层析法主要有离子交换柱层析、凝胶渗透柱层析和亲和层析法等。目前,阴离子交换柱层析是多糖分离纯化应用最广泛的一种方法。阴离子交换柱层析法机理是吸附与解吸附[25],吸附力随着活性多糖分子中酸性基团的增加而增加[26],带电荷量少的偏中性的多糖最先被洗脱下来,所带电荷量越大,与纤维素填料的结合越紧密,越难被洗脱[27]。洗脱方式分为蒸馏水洗脱、不同盐离子浓度洗脱和不同pH值缓冲盐洗脱,用pH值相同而离子浓度不同的缓冲液可将酸性强弱不同的多糖分别洗脱出来,体积大的酸性、中性和黏多糖可先用阴离子交换柱层析初步分离纯化[28]。常用的阴离子交换剂有DEAE-纤维素、DEAE-葡聚糖和DEAE-琼脂糖,其中以DEAE-纤维素应用最广泛[29-32]。本实验首先采用DEAE-52纤维素柱层析对HPP进行分离纯化。由图1可以看出,HPP经DEAE-52纤维素柱层析得到5 个洗脱峰。当采用蒸馏水洗脱时,HPP-c1最先被洗脱下来,是中性糖,质量高达45.7 mg,所占比例为68.83%。当NaCl浓度为0.1、0.3、0.5 mol/L和1 mol/L时均有多糖被洗脱下来,分别为HPP-c2(6.5 mg)、HPP-c3(7 mg)、HPP-c4(4.8 mg)和HPP-c5(2.4 mg),是酸性多糖,其中0.3 mol/L NaCl洗脱得到的HPP-c3含量最高,所占比例为10.54%,1 mol/L NaCl洗脱得到的HPP-c5含量最低,仅占3.61%。因此,雨生红球藻多糖中含有中性多糖和酸性多糖,并且以酸性多糖为主。
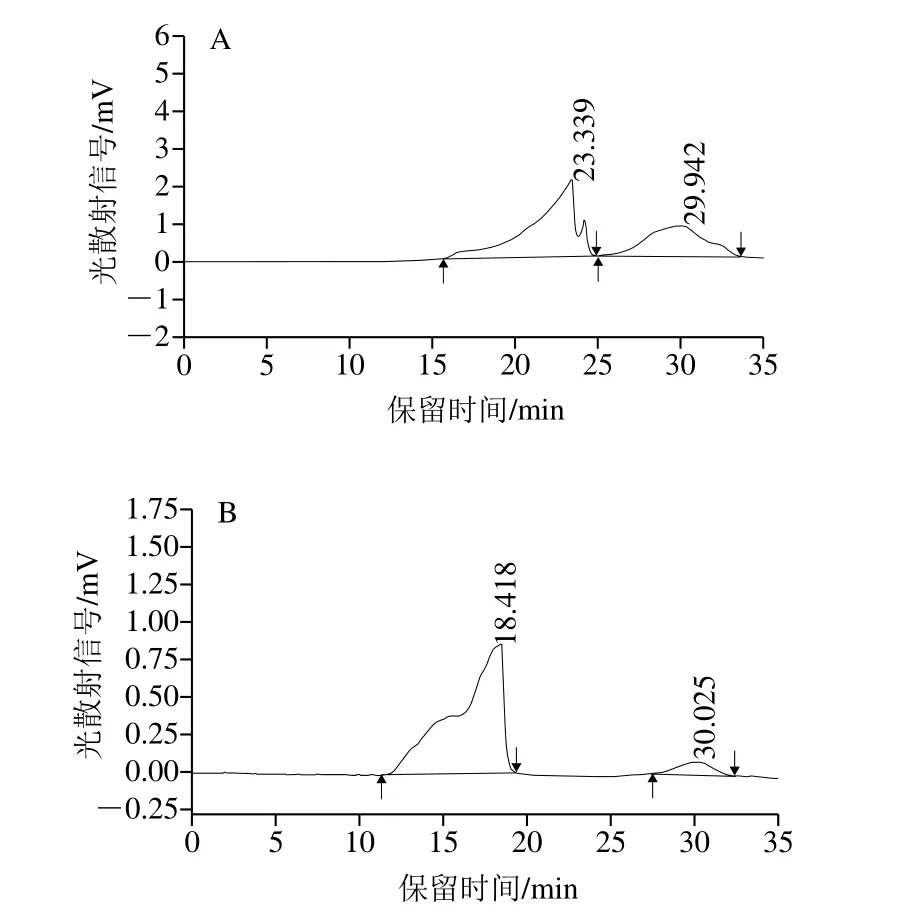
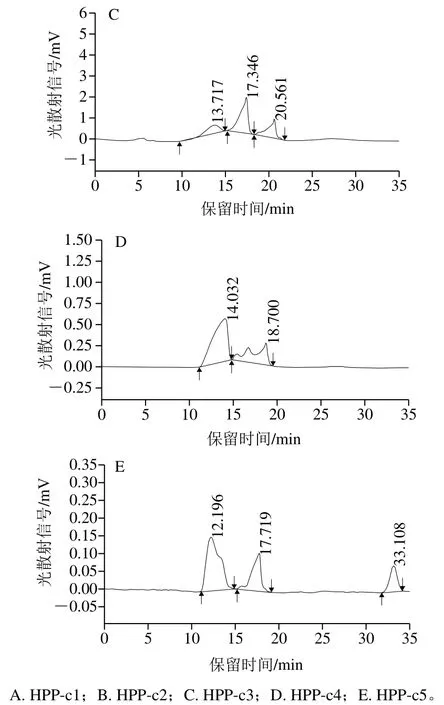
图2 DEAE-52柱层析各多糖组分的HPGPC图谱Fig.2 GPC chromatogram of HPPs on DEAE-52 cellulose column
2.1.2 HPP各多糖组分的HPGPC图谱采用HPGPC鉴定HPP经DEAE-52纤维素柱层析分离后的5 种多糖组分的纯度,如图2所示。结果表明,
HPP-c1、HPP-c2、HPP-c3、HPP-c4和HPP-c5五种多糖组分的HPGPC图谱均呈现2 个以上峰,峰形宽并且不对称,从而推断5 种多糖组分均是由几种多糖组成的混合物。因此,单独采用DEAE-52纤维素作为介质进行分离纯化不能得到雨生红球藻均一多糖,后续将进一步采用凝胶柱进一步进行分离纯化。
2.1.3 HPP各多糖组分单独刺激对小鼠脾细胞增殖的影响

图3 HPP各多糖组分单独刺激对小鼠脾细胞增殖的影响Fig.3 Stimulating effects of crude HPPs and fractions on mouse spleen cell proliferation
采用体外免疫细胞模型进行活性跟踪,对HPP经DEAE-52柱层析后各多糖组分的免疫活性进行检测,从而得到免疫活性较高的组分进行后续的分离纯化。由图3可知,在3.9~125 µg/mL质量浓度范围内,HPP和DEAE-52柱层析后各多糖组分(HPP-c1、HPP-c2、HPP-c3、HPP-c4和HPP-c5)均具有刺激小鼠脾细胞增殖的作用,在质量浓度250~1 000 µg/mL时,HPP各多糖组分对小鼠脾细胞的增殖均具有不同程度的抑制作用。由于多糖对脾细胞的促增值作用存在最适剂量,超过最适剂量可能导致毒性作用,从而使脾细胞增殖能力下降。由图3可知,HPP-c3、HPP-c4和HPP-c5在质量浓度为3.9~125 µg/mL时的刺激指数较HPP-c1和HPP-c2高。大量研究表明,酸性多糖往往具有更好的活性[33]。在DEAE-52柱层析得到的酸性多糖组分HPP-c3、HPP-c4和HPP-c5中,HPP-c3多糖质量为7 mg,所占比例最高,其次为HPP-c4,HPP-c5质量最低。综合考虑多糖质量和小鼠脾细胞增强免疫活性,后续采用HPP-c3进行进一步的分离纯化。
2.2 Sephacryl S400凝胶柱层析分离纯化
2.2.1 HPP-c3的Sephacryl S400凝胶柱层析洗脱曲线
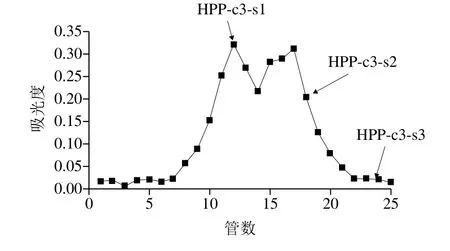
图4 HPP-c3的Sephacryl S400凝胶柱层析洗脱曲线Fig.4 Elution curve of HPP-c3 on Sephacryl S400 column
凝胶柱层析法类似于分子筛作用,采用去离子水或稀盐溶液为洗脱液,可进一步将多糖按相对分子质量大小和不同形状分离出来[34]。常用的凝胶填料有羟丙基葡聚糖凝胶、琼脂糖凝胶和丙烯葡聚糖凝胶(Sephacryl)等。Sephacryl是一种新型葡聚糖凝胶,它具有分离范围大、耐高温及较高压力、化学和机械稳定性好、适用于大部分溶剂等优点,且其稳定的工作pH值范围较大,一般为3~11,因此可以快速、高效地实现多糖的分离纯化。有研究者将龙须菜粗多糖和蜈蚣藻粗多糖经Sephacryl凝胶色谱柱分离纯化均获得了活性组分[35-36]。本实验采用Sephacryl S400对免疫活性较高且含量最多的HPP-c3进一步进行分离纯化,如图4所示。HPP-c3经过超纯水洗脱后,大致分成3 个区段,第1区段组分HPP-c3-s1(8~14 管)最先被洗脱出来,接着是第2区段组分HPP-c3-s2(15~20 管),最后为第3区段组分HPP-c3-s3(21~25 管)。
2.2.2 HPP-c3的各亚组分HPGPC图谱
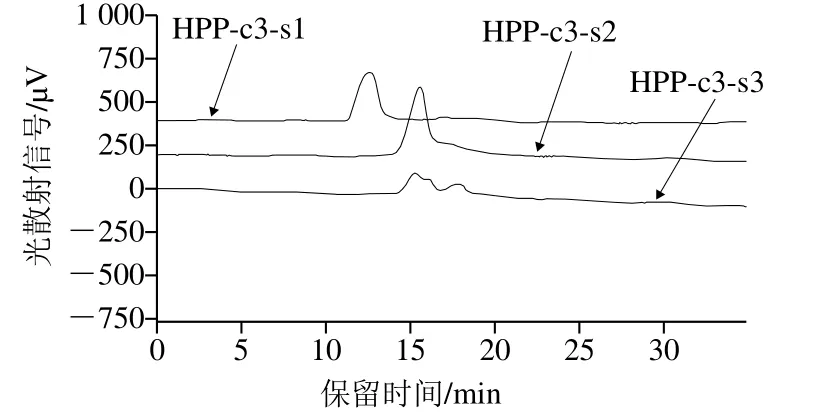
图5 HPP-c3的Sephacryl S400凝胶柱层析各多糖组分HPGPC图谱Fig.5 HPGPC chromatograms of HPP-c3 fractions on Sephacryl S400 column
由图5可知,HPP-c3经过凝胶柱层析得到3 个多糖组分HPP-c3-s1、HPP-c3-s2和HPP-c3-s3。其中,HPP-c3-s1组分的峰形单一,均匀对称,分子质量集中;HPP-c3-s2组分的峰形对称性不好;HPP-c3-s3组分峰形不单一,多于2 个峰,且多糖含量最低,后续实验不予考虑。
2.2.3 HPP-c3的各亚组分单独刺激对小鼠脾细胞增殖的影响
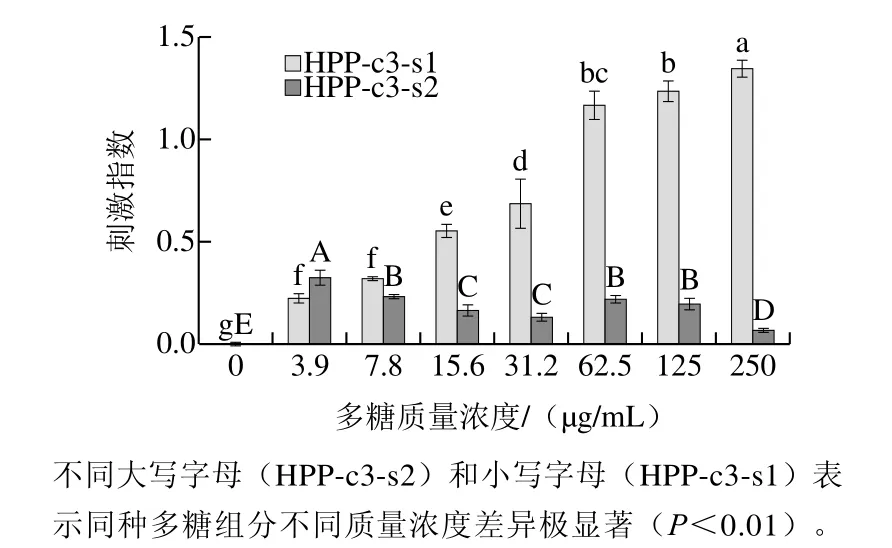
图6 HPP-c3的各亚组分单独刺激对小鼠脾细胞增殖的影响Fig.6 Stimulating effects of HPP-c3 fractions on proliferation of mouse spleen cells
由图6可知,HPP-c3多糖组分经过进一步分离纯化,其亚组分呈现出较高的增强免疫活性。其中HPP-c3-s1在0~250 µg/mL质量浓度范围内可以极显著刺激小鼠脾细胞增殖(P<0.01),并呈现出剂量效应,最高刺激指数达1.34。HPP-c3-s2在0~250 µg/mL质量浓度范围内也可以刺激小鼠脾细胞增殖(P<0.01),但在7.8~250 µg/mL质量浓度范围内,增殖刺激指数均低于HPP-c3-s1。因此,在体外免疫细胞模型活性跟踪下,从雨生红球藻中分离纯化得到免疫活性较高的活性组分HPP-c3-s1。
对比图6和图3,HPP和DEAE-52纤维素柱层析初步分离的各多糖组分对小鼠脾细胞增殖的刺激指数较低,在3.9~125 µg/mL质量浓度范围内,刺激指数范围在0.1~0.6之间。HPP-c3组分经Sephacryl S400凝胶柱层析进一步分离纯化后,小鼠脾淋巴细胞增殖的刺激指数显著增大,在62.5~250 µg/mL范围内刺激指数均高于1.0,并呈剂量依赖性增大。从而说明采用DEAE-52纤维素柱层析和Sephacryl S400凝胶柱层析能够有效地分离HPP的增强免疫高活性组分。由于DEAE纤维素阴离子柱层板分离多糖的原理主要是其可吸附离子型物质,比如蛋白质、酸性多糖等,大多数中性多糖可顺利流出,其分离效果与柱高、洗脱溶剂、粒径的关系很大,因此与凝胶柱层析结合使用能够更加有效地进行微藻多糖的分离纯化,在近些年来的研究中被广泛运用。有研究者对采用了DEAE-52纤维素柱层析和SephadexG凝胶柱层析对球等鞭金藻(Isochrysis galbana)和红江蓠(Gracilaria rubra)的多糖组分进行分离纯化,得到具有抗氧化活性的多糖组分和免疫活性最高的多糖组分[37-38]。金色奥杜藻(Odontella aurita)和小球藻(Chlorella)也采用2 种凝胶柱层析结合的分离方法,得到了具有清除自由基功能成分的多糖组分[39-40]。
2.3 HPP-c3-s1的纯度和分子质量
均一多糖的制备是后续多糖结构鉴定和生物活性检测的关键环节,对于揭示多糖的构效关系至关重要。多糖的性质和生物活性往往与其分子质量及其分布有关,因此测定多糖的分子质量非常重要。多糖的分子质量只代表相似链长的平均分布,通常表示方式有重均分子质量(mw)、数均分子质量(mn)和黏均分子质量(mv)等。目前测定方法主要有蒸汽压法、光散射法、黏度法、聚丙烯酰胺凝胶电泳法、凝胶过滤法和HPGPC法等。这几种方法中,HPGPC法是目前最常用也是公认较为正确的方法,具有快速、高分辨率和重复性好等优点,因此在国内外广泛使用[41-44]。本研究采用全波长扫描、HPGPC法和聚丙烯酰胺凝胶电泳法对HPP-c3-s1的纯度进行鉴定,并检测其分子质量。
2.3.1 HPP-c3-s1的全波长扫描分析
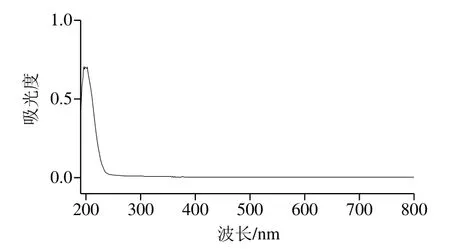
图7 HPP-c3-s1全波长扫描图Fig.7 Ultraviolet absorption spectrum of HPP-c3-s1
由图7可知,HPP-c3-s1没有核酸(260 nm)和蛋白质(280 nm)特征吸收峰,从而说明多糖HPP-c3-s1没有核酸和蛋白质干扰[45]。
2.3.2 HPP-c3-s1的纯度和分子质量检测
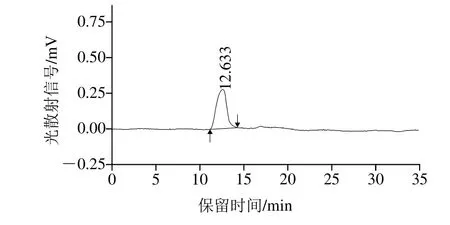
图8 HPP-c3-s1的HPGPC图谱Fig.8 HPGPC chromatogram of HPP-c3-s1
根据分子尺寸排阻原理,将HPP-c3-s1经过凝胶柱分离,用示差折光检测器进行检测。由图8可知,HPP-c3-s1经过HPGPC分析,HPP-c3-s1峰形均一并且对称,从而推断HPP-c3-s1为均一多糖。HPP-c3-s1的保留时间为12.633 min,根据HPGPC标准曲线公式,得出HPP-c3-s1分子质量为23 413 kDa。
2.3.3 聚丙烯酰胺凝胶电泳法鉴定纯度
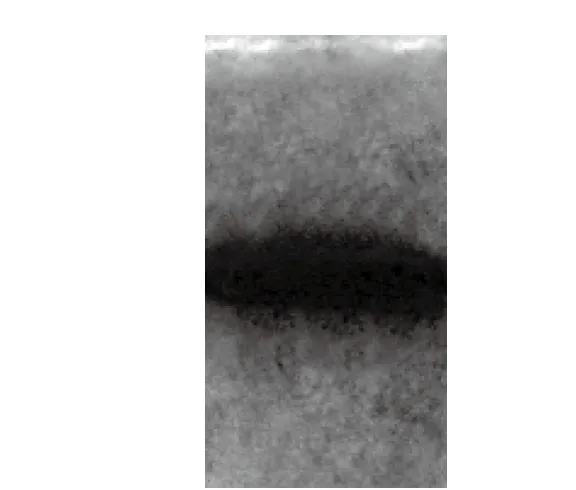
图9 HPP-c3-s1的电泳图Fig.9 PAGE electrophoresis pattern of HPP-c3-s1
从图9可知,HPP-c3-s1的聚丙烯酰胺凝胶电泳图成一条线状,得到单一色带,从而说明分离纯化得到的HPP-c3-s1多糖是均一多糖。
3 结 论
在体外免疫细胞模型活性跟踪下,HPP经DEAE-52柱层析分离纯化得到HPP-c1、HPP-c2、HPP-c3、HPP-c4和HPP-c5五个多糖组分,其中HPP-c3免疫活性较好且含量较高。HPP-c3经Sephacryl S400柱层析得到HPP-c3-s1、HPP-c3-s2和HPP-c3-s3,其中HPP-c3-s1为均一多糖,且具有最高的增强免疫活性,分子质量为23 413 kDa。HPP-c3-s1均一多糖的制备对于后续开展雨生红球藻多糖构效关系提供理论依据。
